Gabriel-Synthese
Mechanismus
Wir beginnen mit Phthalimid, behandeln es mit einer Base wie KOH oder NaOH, fügen ein Alkylhalogenid hinzu und setzen dann das resultierende Amin frei. Gehen wir die einzelnen Schritte des Mechanismus durch:
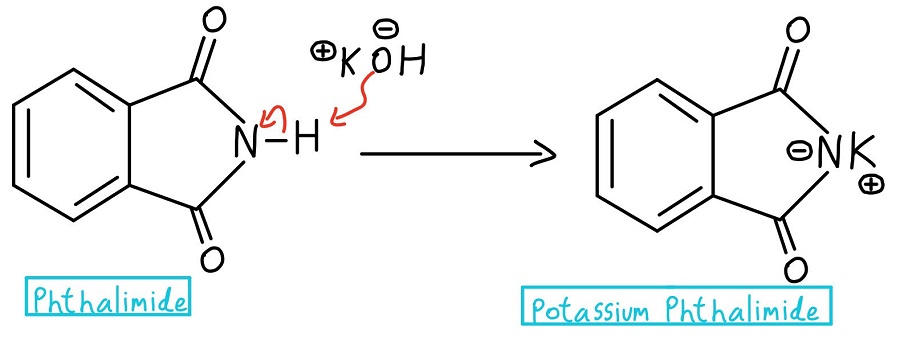
Stickstoffdeprotonierung
Im allerersten Schritt wird der Stickstoff des Phthalimids deprotoniert, um Kaliumphthalimid zu bilden. Achtung: Manche Professoren beginnen einfach mit Kaliumphthalimid und lassen den Schritt der Deprotonierung ganz weg.
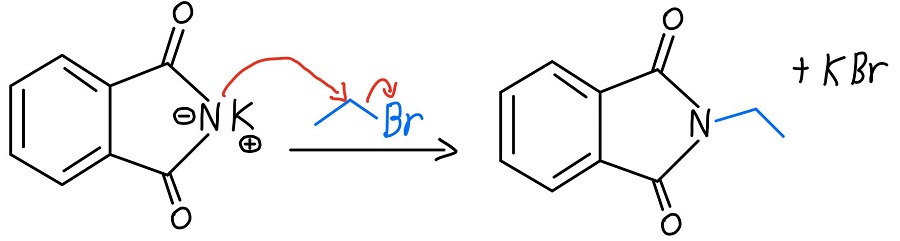
Stickstoffalkylierung
Nun, da der Stickstoff eine negative Ladung hat, kann er als Nukleophil fungieren und eine SN2-Reaktion an einem Alkylhalogenid durchführen. Sobald das passiert, haben wir ein primäres Amin, das nur darauf wartet, freigesetzt zu werden.
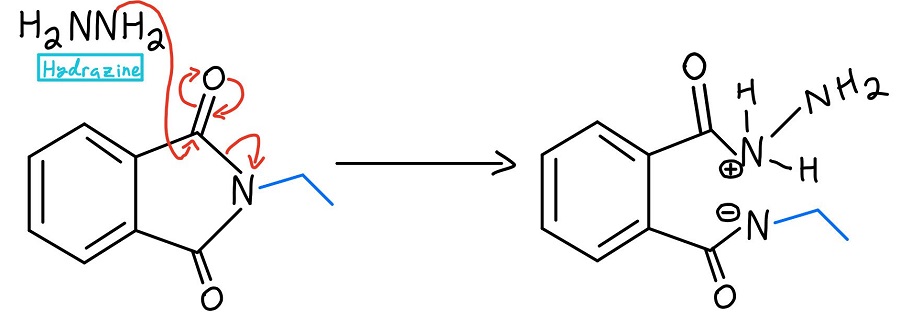
Nukleophile Acyl-Substitution mit Hydrazin
An dieser Stelle gibt es einige Varianten. Normalerweise wird Hydrazin (NH2NH2) verwendet, aber manchmal wird auch eine saure oder basische Hydrolyse eingesetzt. Wir werden uns diese Mechanismen später ansehen. In jedem Fall löst das Nucleophil den Stickstoff durch einen nucleophilen Acyl-Substitutionsmechanismus aus.
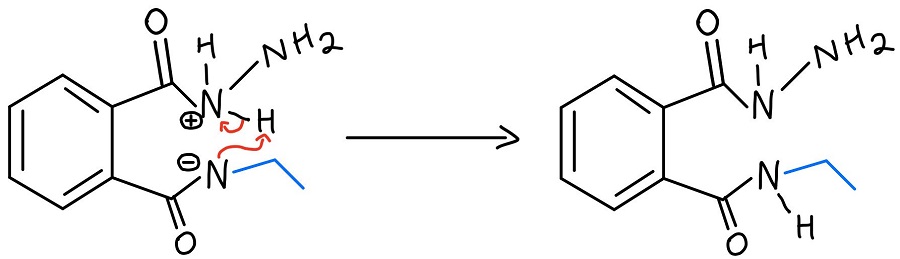
Intramolekularer N-N-Protonentransfer
Das protonierte Hydrazin wird dann durch den Stickstoff deprotoniert, der gerade aus einem Carbonyl herausgelöst wurde. Wir müssen noch das Amin vom zweiten Carbonyl abspalten, und das NH2 des Hydrazins wiederholt den Prozess, um es abzuspalten.
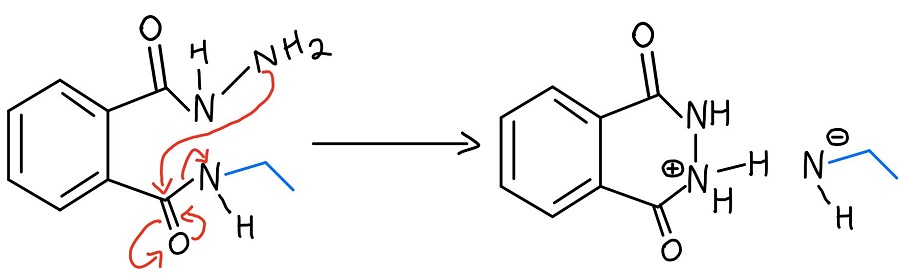
Zweiter NAS
Das nicht umgesetzte NH2 des Hydrazins greift dann das andere Carbonyl durch einen weiteren NAS-Mechanismus an, um schließlich das Amin abzuspalten. Jetzt gibt es eine negative Ladung und eine positive Ladung, um die man sich kümmern muss.
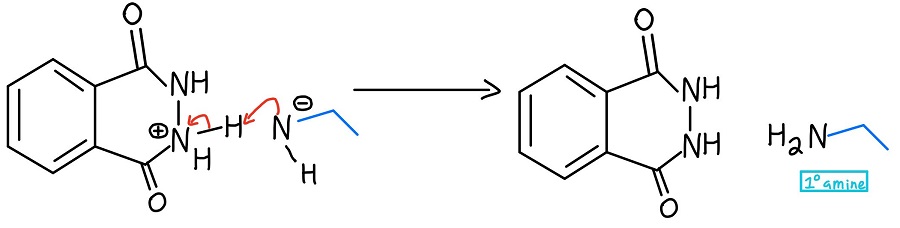
Primäre Aminbildung
Der negative Stickstoff deprotoniert den positiven Stickstoff, und Trommelwirbel bitte… wir haben unser primäres Amin (sowie das cyclische Produkt Phthalhydrazid)! Falls Sie den ganzen Mechanismus auf einmal sehen wollen, hier ist er:
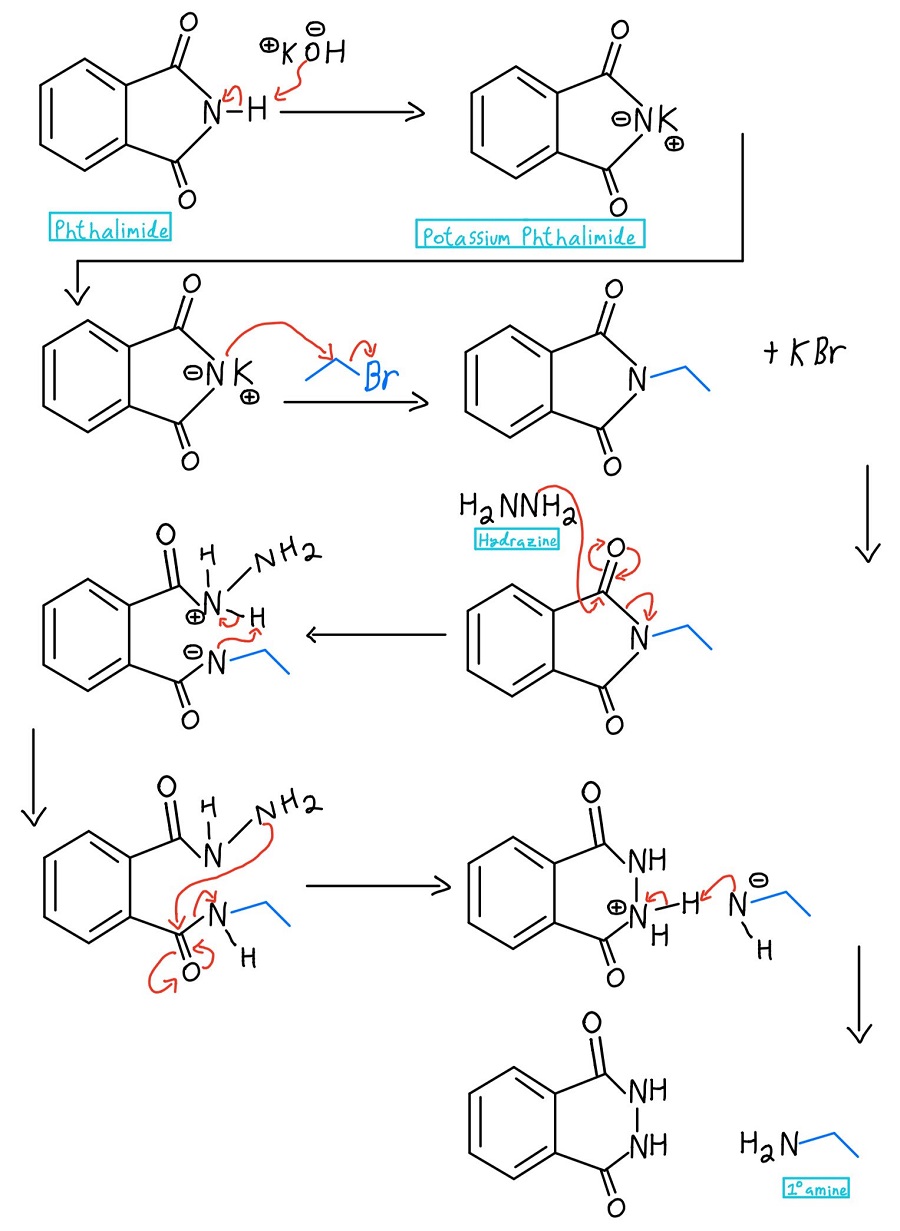
Hydrazin vollständiger Mechanismus
Leave a Reply