Frontiers in Immunology
Einführung
In Ermangelung einer Primärprävention durch Immunisierung und einer spezifischen Behandlung für COVID-19 können dennoch rationale Behandlungsstrategien zur Verfügung stehen. Neben Therapien, die direkt auf die Virusreplikation einwirken, wurden Immuntherapien vorgeschlagen, um die Auswirkungen der durch das Virus ausgelösten Entzündung zu verringern (2). Dazu gehört die Behandlung mit Kortikosteroiden, die aufgrund ihrer immunsuppressiven Wirkung, die im Vergleich zu unbehandelten Patienten zu einem schlechteren Ergebnis führen kann, nicht empfohlen wird. Spezifischere Ansätze zielen auf IL-6, TNFα, Januskinase-Inhibitoren (JAK1/JAK2) und Typ-1-Inteferone ab. Schließlich wurde auch das Komplementsystem als Ziel betrachtet (3-5). Diese Parameter können von prognostischer Bedeutung sein, da das Verhältnis von IL6/Interferon IFɤ den Schweregrad der Krankheit vorherzusagen scheint (6).
Die Erkenntnis, dass das Virus das membrangebundene Angiotensin Converting Enzyme 2 (ACE2) als Eintrittspunkt nutzt, eröffnet darüber hinaus potenzielle Strategien zur Veränderung der Aktivität dieses Systems. Es wurde vorgeschlagen, dass die Verwendung von Angiotensin-Rezeptorblockern, die zu einer erhöhten Expression von ACE2 führen, schädlich sein könnte (7). Andererseits wurde auch die Ansicht geäußert, dass diese Wirkstoffe aufgrund der physiologisch entzündungshemmenden und schützenden Wirkung dieses Enzyms eine positive Wirkung haben könnten (8). Diese Kontroverse wurde vor kurzem klar umrissen (9, 10). Die Herausforderung besteht darin, ACE2 als Eintrittspforte zu reduzieren, ohne die Entzündungsreaktion zu verschlimmern, sobald eine Infektion stattgefunden hat.
ACE2-Reduktion zur Verringerung des Covid-19-Eintritts?
Nach den mechanistischen Erkenntnissen würde eine Verringerung der ACE2-Expression die Anzahl der Eintrittspforten des Virus in den Körper während der Primärinfektion und möglicherweise die Ausbreitung im Körper verringern. Beides sollte zu einem potenziell milderen klinischen Verlauf führen. Zellen, die für die Infektion mit SARS empfänglich sind, scheinen in erster Linie Typ-II-Pneumozyten, ileale absorptive Enterozyten und nasale sekretorische Becherzellen zu sein (11). Daher könnte es sich lohnen, einen Mechanismus zur Verringerung der ACE2-Membranexpression in diesen Zellen zu finden (unter Berücksichtigung möglicher negativer Folgen). Um die Plausibilität eines solchen Ansatzes zu erhöhen, wäre es sinnvoll, die Berichte über den erfolgreichen Einsatz von Ansätzen der traditionellen chinesischen Medizin (TCM) zu verfolgen. Eines der am häufigsten verwendeten Präparate der TCM enthält einen Extrakt aus Glycyrrhiza glabra, d. h. der Süßholzpflanze (12), und interagiert mit dem Angiotensin-Aldosteron-System: Einer ihrer aktiven Bestandteile ist Glycyrrhizin (GL), das im Darm des Menschen in den systemisch aktiven Metaboliten Glycyrrhetinsäure (GA) umgewandelt wird. Die Verabreichung von GL und GA hat eine Reihe von relevanten Wirkungen: GA hemmt in erster Linie ein Enzym namens 11-beta-Hydroxysteroid-Dehydrogenase (11bHSD), sowohl Typ 1 als auch Typ 2 (13). Von Bedeutung ist hier der Typ 2 (11bHSD2). Seine Hemmung ermöglicht dem Cortisol den Zugang zu Mineralocorticoidrezeptoren (MR) in aldosteronspezifischem peripherem Gewebe, einschließlich der Niere, der Lunge, der Nase und der Endothelzellen, in denen es sonst daran gehindert werden würde. Dies geschieht durch seine Aktivität, Cortisol schnell intrazellulär abzubauen, um Aldosteron den Zugang zum Rezeptor zu ermöglichen. Mit anderen Worten, eine Hemmung dieses Enzyms führt zu einer aldosteronähnlichen Aktivierung von MR über Cortisol und kann den Auswirkungen hoher Aldosteronspiegel in diesen Organen ähneln. Interessant ist in diesem Zusammenhang, dass hohe Aldosteronspiegel zu einer Herabregulierung von ACE2 in der Niere führen (14), einem Gewebe, das 11bHSD2 ebenso exprimiert wie die Lungen- und Nasenepithelzellen, d. h. die Haupteintrittsstellen für COVID-19, während ein MR-Antagonismus in mehreren Geweben gegenteilige Auswirkungen hat (15). Dies steht im Einklang mit der Beobachtung, dass aldosteronsenkende Verbindungen wie Enalapril unter bestimmten Umständen zu einer Erhöhung der ACE2-Expression führen können (16, 17).
Direkte antivirale Wirkung von GA oder GL
Interessanterweise zeigt GL oder sein aktiver Metabolit GA in der Zellkultur antivirale Wirkungen für das verwandte SARS-Coronavirus (18, 19): Verum-Zellen, die mit Patientenplasmaproben infiziert wurden, zeigten eine signifikant verringerte Virusaufnahme und Replikationsrate, wenn GL mitverabreicht wurde (18); ein ähnlicher Effekt wurde von Chen et al. in einer Vero-E6-Zelllinie beschrieben, jedoch wurde kein Effekt in einer fRhK4-Zelllinie beobachtet (19). Wichtig ist, dass GA, die systemisch aktive Verbindung nach oraler Verabreichung, nicht untersucht wurde, so dass diese Ergebnisse möglicherweise auch für die lokale (inhalative) oder intravenöse Verabreichung relevant sind. In einer Studie mit menschlichen Atemwegszellen zeigte GA, nicht aber GL, eine Wirkung auf die Infektionsrate mit dem humanen Respiratory Syncytial Virus (20). Diese direkten antiviralen Wirkungen außerhalb der MR weisen auf einen zusätzlichen, aber unbekannten Mechanismus hin. In diesem Zusammenhang ist es vielleicht wichtig zu wissen, dass neben ACE2 auch die Serinprotease TMPRSS2 für die Infektion einer Zelle erforderlich ist (21). Die Hemmung dieses Enzyms durch einen Proteaseinhibitor wurde von den Autoren als therapeutischer Eingriff vorgeschlagen. TMPRSS2 ist sowohl bei Corona- als auch bei Influenzavirusinfektionen beteiligt (22). Interessanterweise wird die Expression dieses Enzyms durch GA reguliert (23), was die breitere antivirale Wirkung von GL erklären könnte (24). Es wird durch Androgene reguliert (23), was zum Teil die geschlechtsspezifischen Unterschiede in der klinischen Ausprägung von COVID-19-Infektionen erklären könnte.
ACE2 Antiinflammation und die entzündungshemmenden Wirkungen von Glycyrrhizin
Die nachgeschalteten Folgen einer verminderten ACE2-Expression sind, wie oben dargelegt, etwas umstritten (25). Die ACE2-Aktivität ist generell schützend, auch für das Lungengewebe (26). Sie tut dies, indem sie die Folgen der Aktivierung des Rezeptors für Endotoxin (LPS), d. h. des Toll-like-Rezeptors 4 (TLR4), und die damit verbundene Entzündung in der Lunge (Endotoxinsturm) unterdrückt (27): Die Überexpression von ACE2 hemmte in dieser Studie die LPS-induzierte Entzündung. Daher könnte die verringerte Expression von ACE2 als besorgniserregend angesehen werden. In diesem Zusammenhang wird eine zweite Eigenschaft von Glycyrrhizin wichtig, nämlich seine immunmodulierende Wirkung. Die bekannteste davon ist die antagonistische Wirkung auf TLR4-abhängige Mechanismen. Eine TLR4-antagonistische Wirkung von GL reduziert Entzündungen in verschiedenen Geweben, darunter auch in der Lunge (28). Darüber hinaus führte GL zu einer Verringerung der TLR4-Expression im Herzen und in der Lunge in einem LPS-Entzündungsmodell. Dies ging mit einer signifikanten Verringerung der Zytokinfreisetzung einher, d. h. der Freisetzung von TNFα, IL6 und IL1ß (29). In Übereinstimmung damit hat GL schützende Effekte beim akuten Atemnotsyndrom, das durch den TLR4-Aktivator LPS bei Mäusen ausgelöst wird (28). Das entzündungshemmende Potenzial in der Lunge wurde auch in einem Mausmodell für Streptococcus aureus-Infektionen nachgewiesen, wo die intraperitoneale Verabreichung von GL die Entzündungsmarker weitgehend unterdrückte (30). Diese Ergebnisse stehen im Einklang mit der Wirkung von GL oder GA auf die Hemmung von Entzündungswegen über TLR4 (31-34). Der Mechanismus von GL gegen Lungen- und Herzentzündungen könnte zum Teil indirekt sein, indem er das Verhältnis von myeloischen Suppressorzellen (MDSCs) zu myeloischen CD11b+Gr1-Zellen verändert (29). Insgesamt könnte die Wirkung von GL, die TLR4-Aktivität zu hemmen, eine entzündungshemmende Wirkung nach dem weniger aktiven ACE2 auslösen (35). Darüber hinaus führt GA zu einer Unterdrückung des klassischen, aber nicht des alternativen Komplementwegs (36). Schließlich wurde ein Einfluss auf die Interferon-Sekretion beschrieben: Glycyrrhiza-Extrakt führt zu einer erhöhten Sekretion von Interferon 1ß in Zellen der oberen und unteren Atemwege (20), ähnlich der Wirkung von GL und GA bei Mäusen, wie in Serumproben festgestellt wurde (37); außerdem reduziert GL den Tod von Mäusen, die mit einer tödlichen Dosis des Influenza-Virus infiziert wurden, über einen Interferon ɤ- und T-Zell-abhängigen Weg (38). Diese entzündungshemmenden Mechanismen könnten auch im ZNS von Bedeutung sein (39, 40) und daher vor den neurologischen und psychiatrischen Folgen einer COVID-19-Infektion schützen.
Aus praktischer Sicht könnte auch von Bedeutung sein, dass das Coronavirus SARS Co-V, das Ähnlichkeiten mit COVID-19 aufweist, häufig zu einer arteriellen Hypotonie führte (25), die bei Entzündungsprozessen nicht ungewöhnlich ist. Dieses potenziell kritische Symptom kann auch mit Glycyrrhizin überwunden werden, das zu einem Anstieg des Blutdrucks führt (13). Abbildung 1 gibt einen schematischen Überblick.
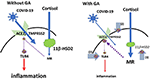
Abbildung 1. Schematisches Modell der Wirkung von Glycyrrhizin: Der Zugang von COVID-19 in die Zellen wird über ACE2 mit TMPRSS2 als Co-Faktor vermittelt. Die Expression von ACE2 wird durch Mineralocorticoidrezeptoren (MR) reguliert: Eine MR-Aktivierung führt zu einer Verringerung der ACE2-Expression; GA hemmt das 11βHSD2, wodurch Cortisol MR aktivieren kann, gefolgt von einer ACE2-Down-Regulierung (Pfeil 1). TMPRSS2 sensibilisiert ACE2 für die Aktualisierung des Virus in die Zelle. GA führt zu einer verringerten Expression von TMPRSS2 und könnte daher einen zusätzlichen Mechanismus darstellen, um den Zugang des Virus in die Zelle zu beschränken (Pfeil 2). ACE2 hat einen entzündungshemmenden Mechanismus durch die Bildung von Angiotensin 1-7 und Angiotensin 1-9. Durch die Aktivierung von MAS- oder Angiotensin-2-Rezeptoren werden Entzündungswege unterdrückt. Dazu gehört auch eine verminderte Expression und/oder Aktivierung des Membran-TLR4-Rezeptors (links), d.h. die verminderte ACE2-Expression könnte als problematisch angesehen werden (35). GA hemmt jedoch TLR4 direkt und unabhängig von der ACE2-Aktivierung (Pfeil 3). (ϕ und unterbrochene Linien symbolisieren die Hemmung; rote durchgehende Linien symbolisieren die Aktivierung).
Diskussion
Viele Fragen bleiben offen. Welche Rolle spielt das lösliche gegenüber dem membrangebundenen ACE2? Könnte lösliches ACE2 eine Rolle spielen, um die Membranbesetzung zu schützen? Dies wurde kürzlich auf der Grundlage von Ergebnissen aus Zellkulturexperimenten vorgeschlagen (41). Dies könnte jedoch in gewissem Widerspruch zu der Beobachtung stehen, dass Personen mit Herzinsuffizienz, die als Hochrisikopatienten angesehen werden sollten, hohe Konzentrationen von löslichem ACE2 aufweisen (42). Worin besteht der Unterschied in verschiedenen Organen mit oder ohne 11bHSD2-Expression? Welche Rolle spielt die gleichzeitige gegenregulatorische Senkung des Plasma-Aldosterons bei der Verabreichung eines 11betaHSD2-Inhibitors? Diese Fragen können in geeigneten klinischen Studien beantwortet werden. Die Bestimmung des Endprodukts des ACE2-Enzyms, d.h. Angiotensin 1-7, sowie die potenziellen klinischen Auswirkungen auf den Blutdruck könnten bei der Klärung einiger dieser Fragen hilfreich sein.
Wichtig ist, dass Glycyrrhizin insgesamt gut verträglich ist. Die FDA hat es als GRAS (generally regarded as safe) eingestuft (13). Insbesondere ist eine Dosis von bis zu 100 mg/Tag bei chronischer Anwendung sicher und führt nicht zu Veränderungen, die bei chronischer Anwendung höherer Dosen beobachtet wurden. Die bei hohen Dosen zu erwartenden unerwünschten Wirkungen, einschließlich Bluthochdruck und Hypokaliämie, sollten jedoch überwacht werden. Im Zusammenhang mit SARS wurde eine Dosis von bis zu 300 mg bei oraler Verabreichung und von etwa 240 mg bei intravenöser Verabreichung empfohlen (19). Chen et al. stellen jedoch fest, dass diese Dosis für die i.v.-Verabreichung unter Berücksichtigung der EC50 der Wirkung auf die Virusreplikation zu niedrig sein könnte. Es muss festgestellt werden, dass diese direkte Wirkung nur einer von drei relevanten Mechanismen ist, um den mit COVID-19 verbundenen Krankheitsprozess anzugehen. Auf der Website der WHO zur Registrierung klinischer Studien sind zwei offene klinische Studien registriert, eine randomisierte offene Studie (ChiCTR2000029768) und eine Fallserie (ChiCTR2000030490). Für die Studie wird eine Dosis von 300 mg Glycyrrhizin oral/Tag verwendet, die Dosis für die andere Untersuchung wurde nicht angegeben. Bei der Wahl des Verabreichungsweges ist zu berücksichtigen, dass für eine GA-induzierte Wirkung die orale Verabreichung von GL entscheidend ist, da GL nicht systemisch zu GA metabolisiert wird. Für eine lokalisierte Wirkung von GL kann jedoch eine intravenöse oder inhalative Verabreichung erforderlich sein, die mit einer oralen Verabreichung kombiniert werden sollte. Für den Einsatz als potentielle Primärprävention kann eine pragmatische Dosisauswahl von 150 mg/Tag oral für weitere Studien in Betracht gezogen werden, da diese Dosis die Aktivität des MR beeinflusst.
Schlussfolgerung
Glycyrrhizin ist eine weithin verfügbare und insgesamt sichere Verbindung. Es könnte in der Lage sein, die Expression von ACE2 in der Lunge zu reduzieren und trotzdem die Lungenentzündung zu verringern. Es wäre eine Überlegung wert, diesen Wirkstoff für eine Art von Primärprävention zu untersuchen, die nicht unbedingt das Risiko einer Infektion, aber möglicherweise den Schweregrad der Krankheit senkt und die bereits bestehende Symptomatik verringert. Dies könnte dazu beitragen, die Zahl der schwerkranken Patienten zu verringern, die derzeit das Gesundheitssystem überfordern.
Beiträge der Autoren
HM hat das Manuskript und die endgültige Fassung verfasst.
Interessenkonflikt
HM hält ein Patent für die Verwendung von Glycyrrhizin bei therapierefraktärer Depression.
Der Autor erklärt, dass die Forschung in Abwesenheit jeglicher kommerzieller oder finanzieller Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagungen
HM möchte Laura Zumpano für ihre Durchsicht und hilfreichen Kommentare für das Manuskript danken.
1. Sanders JM, Monogue ML, Jodlowski TZ, Cutrell JB. Pharmakologische Behandlungen für die Coronavirus-Krankheit 2019 (COVID-19): eine Übersicht. JAMA. (2020). doi: 10.1001/jama.2020.6019. .
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Reddy Bonam S, Kaveri SV, Sakuntabhai A, Gilardin L, Bayry J. Adjunct immunotherapies for the management of severely ill COVID-19 patients. Cell Rep Med. (2020) 7:22. doi: 10.1016/j.xcrm.2020.100016
CrossRef Full Text | Google Scholar
3. Maglakelidze N, Manto KM, Craig TJ. A review: Does complement or the contact system have a role in protection or pathogenesis of COVID-19? Pulm Ther. (2020) 1-8. doi: 10.1007/s41030-020-00118-5
CrossRef Full Text | Google Scholar
4. Mastaglio S, Ruggeri A, Risitano AM, Angelillo P, Yancopoulou D, Mastellos DC, et al. The first case of COVID-19 treated with the complement C3 inhibitor AMY-101. Clin Immunol. (2020) 215:108450. doi: 10.1016/j.clim.2020.108450
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Risitano AM, Mastellos DC, Huber-Lang M, Yancopoulou D, Garlanda C, Ciceri F, et al. Complement as a target in COVID-19? (2020) Nat. Rev. Immunol. 1-2. doi: 10.1038/s41577-020-0320-7
CrossRef Full Text | Google Scholar
6. Lagunas-Rangel FA, Chavez-Valencia V. High IL-6/IFN-gamma ratio could be associated with severe disease in COVID-19 patients. J. Med. Virol. (2020). doi: 10.1002/jmv.25900. .
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Esler M, Esler D. Can angiotensin receptor-blocking drugs perhaps be harmful in the COVID-19 pandemic? J. Hypertens. (2020) 38:781-2. doi: 10.1097/HJH.0000000000002450
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Fedson DS, Opal SM, Rordam OM. Hiding in plain sight: ein Ansatz zur Behandlung von Patienten mit schwerer COVID-19-Infektion. MBio. (2020) 11:e00398-20. doi: 10.1128/mBio.00398-20
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Sommerstein R, Kochen MM, Messerli FH, Grani C. Coronavirus-Krankheit 2019 (COVID-19): Haben Angiotensin-Converting-Enzym-Inhibitoren/Angiotensin-Rezeptor-Blocker eine biphasische Wirkung? J Am Heart Assoc. (2020) 9:e016509. doi: 10.1161/JAHA.120.016509
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Vaduganathan M, Vardeny O, Michel T, Mcmurray JJ, Pfeffer MA, Solomon SD. Renin-Angiotensin-Aldosteron-System-Hemmer bei Patienten mit Covid-19. N Engl J Med. (2020) 382:1653-9. doi: 10.1056/NEJMsr2005760
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Ziegler CG. Der SARS-CoV-2-Rezeptor ACE2 ist ein Interferon-stimuliertes Gen in menschlichen Epithelzellen der Atemwege und wird in spezifischen Zelluntergruppen in verschiedenen Geweben nachgewiesen. Cell. (2020) S0092-8674:30500-6. doi: 10.1016/j.cell.2020.04.035
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Luo H, Tang QL, Shang YX, Liang SB, Yang M, Robinson N, et al. Can Chinese medicine be used for prevention of corona virus disease 2019 (COVID-19)? Ein Überblick über historische Klassiker, Forschungsergebnisse und aktuelle Präventionsprogramme. Chin J Integr Med. (2020) 26:243-50. doi: 10.1007/s11655-020-3192-6
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Cosmetic Ingredient Review Expert Panel. Abschlussbericht über die Sicherheitsbewertung von Glycyrrhetinsäure, Kalium-Glycyrrhetinat, Dinatrium-Succinoyl-Glycyrrhetinat, Glyceryl-Glycyrrhetinat, Glycyrrhetinyl Stearate, Stearyl-Glycyrrhetinat, Glycyrrhizinsäure, Ammonium-Glycyrrhizat, Dikalium-Glycyrrhizat, Dinatrium-Glycyrrhizat, Trinatrium-Glycyrrhizat, Methyl-Glycyrrhizat und Kalium-Glycyrrhizinat. Int J Toxicol. (2007) 26 (Suppl. 2):79-112. doi: 10.1080/10915810701351228
CrossRef Full Text | Google Scholar
14. Fukuda S, Horimai C, Harada K, Wakamatsu T, Fukasawa H, Muto S, et al. Aldosterone-induced kidney injury is mediated by NFkappaB activation. Clin Exp Nephrol. (2011) 15:41-9. doi: 10.1007/s10157-010-0373-1
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Keidar S, Gamliel-Lazarovich A, Kaplan M, Pavlotzky E, Hamoud S, Hayek T, et al. Mineralocorticoid receptor blocker increases angiotensin-converting enzyme 2 activity in congestive heart failure patients. Circ Res. (2005) 97:946-53. doi: 10.1161/01.RES.0000187500.24964.7A
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Hu XS, Xie XD, Wang XX, Zeng CL, Ni YM, Yu GW, et al. Effects of angiotensin converting enzyme inhibitor on the expression of angiotensin converting enzyme 2 in atrium of patients with atrial fibrillation. Zhonghua Xin Xue Guan Bing Za Zhi. (2007) 35:625-8.
PubMed Abstract | Google Scholar
17. Malfitano C, De Angelis K, Fernandes T, Wichi RB, Rosa K, Pazzine M, et al. Low-dose enalapril reduces angiotensin II and attenuates diabetic-induced cardiac and autonomic dysfunctions. J Cardiovasc Pharmacol. (2012) 59:58-65. doi: 10.1097/FJC.0b013e3182354776
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Cinatl J, Morgenstern B, Bauer G, Chandra P, Rabenau H, Doerr HW. Glycyrrhizin, ein aktiver Bestandteil von Süßholzwurzeln, und Replikation des SARS-assoziierten Coronavirus. Lancet. (2003) 361:2045-6. doi: 10.1016/S0140-6736(03)13615-X
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Chen F, Chan KH, Jiang Y, Kao RY, Lu HT, Fan KW, et al. In vitro susceptibility of 10 clinical isolates of SARS coronavirus to selected antiviral compounds. J Clin Virol. (2004) 31:69-75. doi: 10.1016/j.jcv.2004.03.003
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Feng Yeh C, Wang KC, Chiang LC, Shieh DE, Yen MH, San Chang J. Water extract of licorice had anti-viral activity against human respiratory syncytial virus in human respiratory tract cell lines. J Ethnopharmacol. (2013) 148:466-73. doi: 10.1016/j.jep.2013.04.040
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Hoffmann M, Kleine-Weber H, Schroeder S, Kruger N, Herrler T, Erichsen S, et al. SARS-CoV-2 cell entry depends on ACE2 and TMPRSS2 and is blocked by a clinically proven protease inhibitor. Cell. (2020) 181:271-80 e278. doi: 10.1016/j.cell.2020.02.052
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Shen LW, Mao HJ, Wu YL, Tanaka Y, Zhang W. TMPRSS2: a potential target for treatment of influenza virus and coronavirus infections. Biochimie. (2017) 142:1-10. doi: 10.1016/j.biochi.2017.07.016
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Sun Y, Jiang M, Park PH, Song K. Transcriptional suppression of androgen receptor by 18beta-glycyrrhetinic acid in LNCaP human prostate cancer cells. Arch Pharm Res. (2020) 43:433-48. doi: 10.1007/s12272-020-01228-z
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Hoever G, Baltina L, Michaelis M, Kondratenko R, Baltina L, Tolstikov GA, et al. Antivirale Aktivität von Glycyrrhizinsäurederivaten gegen SARS-Coronavirus. J Med Chem. (2005) 48:1256-9. doi: 10.1021/jm0493008
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Gurwitz D. Angiotensin-Rezeptorblocker als vorläufige SARS-CoV-2-Therapeutika. Drug Dev. Res. (2020). doi: 10.1002/ddr.21656. .
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Kaparianos A, Argyropoulou E. Lokale Renin-Angiotensin-II-Systeme, Angiotensin-konvertierendes Enzym und sein Homolog ACE2: ihre potenzielle Rolle in der Pathogenese von chronisch obstruktiven Lungenerkrankungen, pulmonaler Hypertonie und akutem Atemnotsyndrom. Curr Med Chem. (2011) 18:3506-15. doi: 10.2174/092986711796642562
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Ye R, Liu Z. ACE2 zeigt schützende Effekte gegen LPS-induzierte akute Lungenverletzungen bei Mäusen durch Hemmung des LPS-TLR4-Wegs. Exp Mol Pathol. (2020) 113:104350. doi: 10.1016/j.yexmp.2019.104350
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Yu Z, Ohtaki Y, Kai K, Sasano T, Shimauchi H, Yokochi T, et al. Critical roles of platelets in lipopolysaccharide-induced lethality: effects of glycyrrhizin and possible strategy for acute respiratory distress syndrome. Int Immunopharmacol. (2005) 5:571-80. doi: 10.1016/j.intimp.2004.11.004
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Seo EH, Song GY, Kwak BO, Oh CS, Lee SH, Kim SH. Auswirkungen von Glycyrrhizin auf die Differenzierung von myeloischen Zellen des Herzens und der Lunge in Lipopolysaccharid-induzierten septischen Mäusen. Shock. (2017) 48:371-6. doi: 10.1097/SHK.0000000000000850
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Yao L, Sun T. Glycyrrhizin administration ameliorates Streptococcus aureus-induced acute lung injury. Int Immunopharmacol. (2019) 70:504-11. doi: 10.1016/j.intimp.2019.02.046
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Vitali R, Palone F, Pierdomenico M, Negroni A, Cucchiara S, Aloi M, et al. Dipotassium glycyrrhizate via HMGB1 or AMPK signaling suppresses oxidative stress during intestinal inflammation. Biochem Pharmacol. (2015) 97:292-9. doi: 10.1016/j.bcp.2015.07.039
CrossRef Full Text | Google Scholar
32. Wu CX, He LX, Guo H, Tian XX, Liu Q, Sun H. Inhibition effect of glycyrrhizin in lipopolysaccharide-induced high-mobility group box 1 releasing and expression from RAW264.7 cells. Shock. (2015) 43:412-21. doi: 10.1097/SHK.0000000000000309
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Thakur V, Nargis S, Gonzalez M, Pradhan S, Terreros D, Chattopadhyay M. Role of glycyrrhizin in the reduction of inflammation in diabetic kidney disease. Nephron. (2017) 137:137-47. doi: 10.1159/000477820
PubMed Abstract | Cross Text | Google Scholar
34. Wang XR, Hao HG, Chu L. Glycyrrhizin hemmt die LPS-induzierte Produktion von Entzündungsmediatoren in endometrialen Epithelzellen. Microb Pathog. (2017) 109:110-3. doi: 10.1016/j.micpath.2017.05.032
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Ingraham NE, Lotfi-Emran S, Thielen BK, Techar K, Morris RS, Holtan SG, et al. Immunomodulation in COVID-19. Lancet Respir Med. (2020) S2213-2600:30226-5. doi: 10.1016/S2213-2600(20)30226-5
PubMed Abstract | CrossRef Full Text | Google Scholar
36. Kroes BH, Beukelman CJ, Van Den Berg AJ, Wolbink GJ, Van Dijk H, Labadie RP. Hemmung des menschlichen Komplements durch Beta-Glycyrrhetinsäure. Immunology. (1997) 90:115-20. doi: 10.1046/j.1365-2567.1997.00131.x
PubMed Abstract | CrossRef Full Text | Google Scholar
37. Abe N, Ebina T, Ishida N. Interferon-Induktion durch Glycyrrhizin und Glycyrrhetinsäure in Mäusen. Microbiol Immunol. (1982) 26:535-9. doi: 10.1111/j.1348-0421.1982.tb00207.x
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Utsunomiya T, Kobayashi M, Pollard RB, Suzuki F. Glycyrrhizin, ein aktiver Bestandteil von Süßholzwurzeln, reduziert die Morbidität und Mortalität von Mäusen, die mit tödlichen Dosen des Influenzavirus infiziert sind. Antimicrob Agents Chemother. (1997) 41:551-6. doi: 10.1128/AAC.41.3.551
PubMed Abstract | CrossRef Full Text | Google Scholar
39. Kong ZH, Chen X, Hua HP, Liang L, Liu LJ. Die orale Vorbehandlung von Glycyrrhizin verhindert die chirurgisch induzierte kognitive Beeinträchtigung bei gealterten Mäusen, indem sie die Neuroinflammation und die mit Alzheimer verbundene Pathologie über die HMGB1-Hemmung reduziert. J Mol Neurosci. (2017) 63:385-95. doi: 10.1007/s12031-017-0989-7
PubMed Abstract | CrossRef Full Text | Google Scholar
40. Lai S, Wu G, Jiang Z. Glycyrrhizin-Behandlung erleichtert die Löschung von konditionierten Furchtreaktionen nach einmaliger längerer Stressbelastung bei Ratten. Cell Physiol Biochem. (2018) 45:2529-39. doi: 10.1159/000488271
PubMed Abstract | CrossRef Full Text | Google Scholar
41. Monteil V, Kwon H, Prado P, Hagelkruys A, Wimmer RA, Stahl M, et al. Inhibition of SARS-CoV-2 infections in engineered human tissues using clinical-grade soluble human ACE2. Cell. (2020) 181:905-913.e7. doi: 10.1016/j.cell.2020.04.004
PubMed Abstract | CrossRef Full Text | Google Scholar
42. Epelman S, Tang WH, Chen SY, Van Lente F, Francis GS, Sen S. Detection of soluble angiotensin-converting enzyme 2 in heart failure: insights into the endogenous counter-regulatory pathway of the renin-angiotensin-aldosterone system. J Am Coll Cardiol. (2008) 52:750-4. doi: 10.1016/j.jacc.2008.02.088
PubMed Abstract | CrossRef Full Text | Google Scholar
Leave a Reply