Synthèse Gabriel
Mécanisme
On part du phtalimide, on le traite avec une base comme KOH ou NaOH, on ajoute un halogénure d’alkyle, puis on libère l’amine résultante. Décomposons chaque étape du mécanisme :
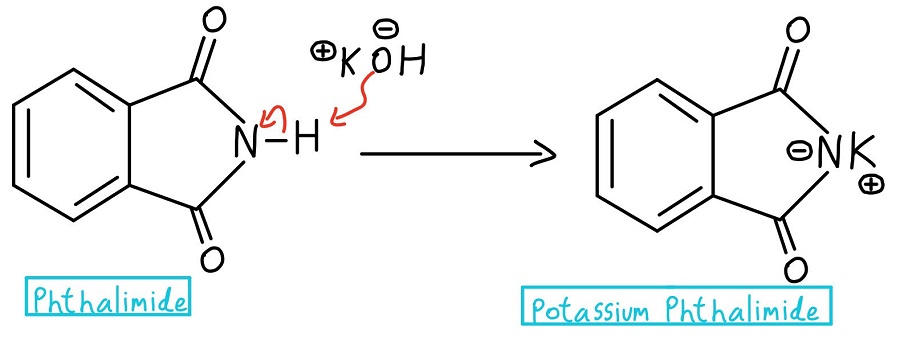
Déprotonation de l’azote
Dans la toute première étape, l’azote du phtalimide est déprotoné pour créer du phtalimide de potassium. Attention : certains professeurs pourraient simplement commencer par le phtalimide de potassium et sauter entièrement l’étape de déprotonation.
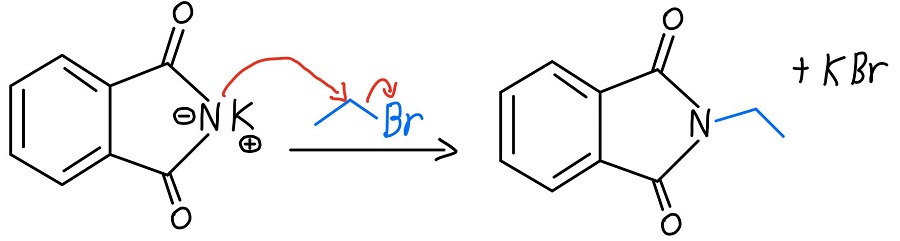
Alkylation de l’azote
Maintenant que l’azote a une charge négative, il peut agir comme un nucléophile et effectuer une réaction SN2 sur un halogénure d’alkyle. Une fois que cela se produit, nous avons une amine primaire qui n’attend que d’être libérée.
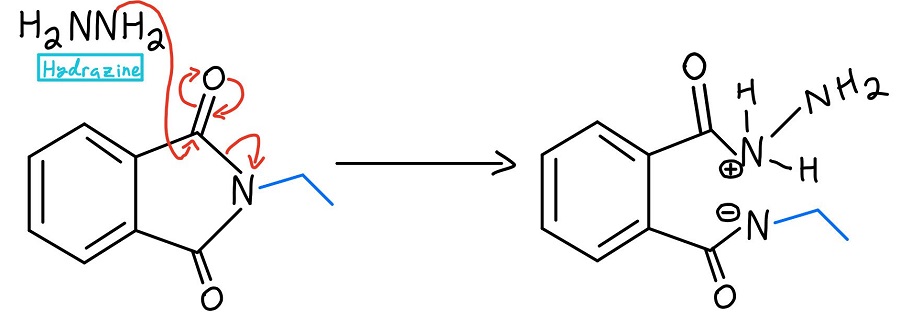
Substitution acylique nucléophile par l’hydrazine
À ce stade, il y a quelques variations. Habituellement, on utilise l’hydrazine (NH2NH2), mais parfois on utilise une hydrolyse acide ou une hydrolyse basique. Nous nous pencherons sur ces mécanismes plus tard. Dans tous les cas, le nucléophile donne un coup de pied à l’azote par un mécanisme de substitution acylique nucléophile.
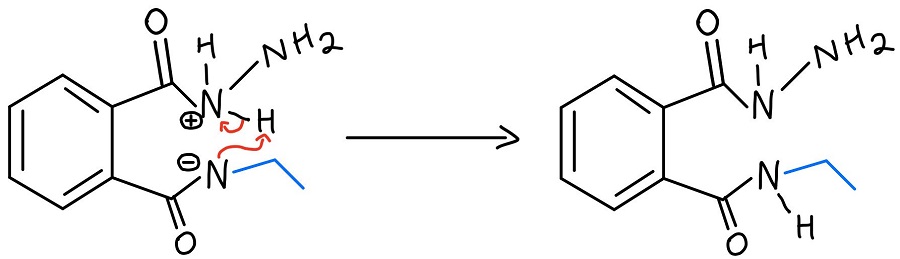
Transfert intramoléculaire de proton N-N
L’hydrazine protonée est ensuite déprotonée par l’azote qui vient de donner un coup de pied à un carbonyle. Nous devons encore faire sortir l’amine du second carbonyle, et le NH2 de l’hydrazine répète le processus pour le botter.
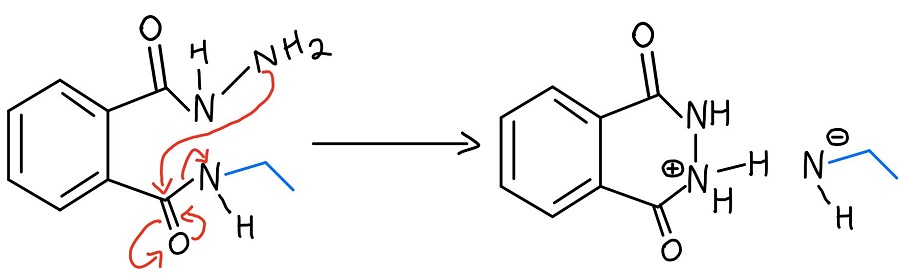
Deuxième NAS
Le NH2 de l’hydrazine qui n’a pas réagi attaque ensuite l’autre carbonyle par un autre mécanisme NAS pour finalement éjecter l’amine. Il y a maintenant une charge négative et une charge positive, et il faut s’en occuper.
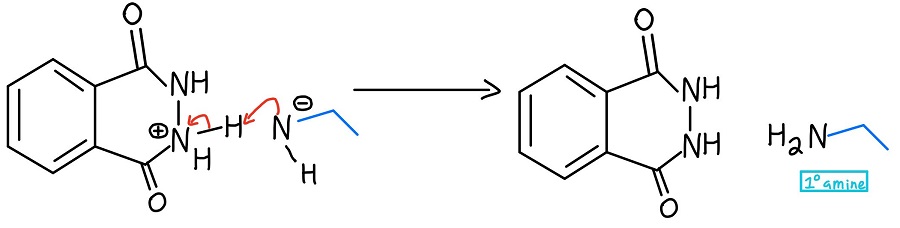
Formation de l’amine primaire
L’azote négatif déprotonise l’azote positif, et roulement de tambour s’il vous plaît… nous avons notre amine primaire (ainsi que le produit cyclique phtalhydrazide) ! Au cas où vous voudriez voir tout le mécanisme d’un coup, le voici :
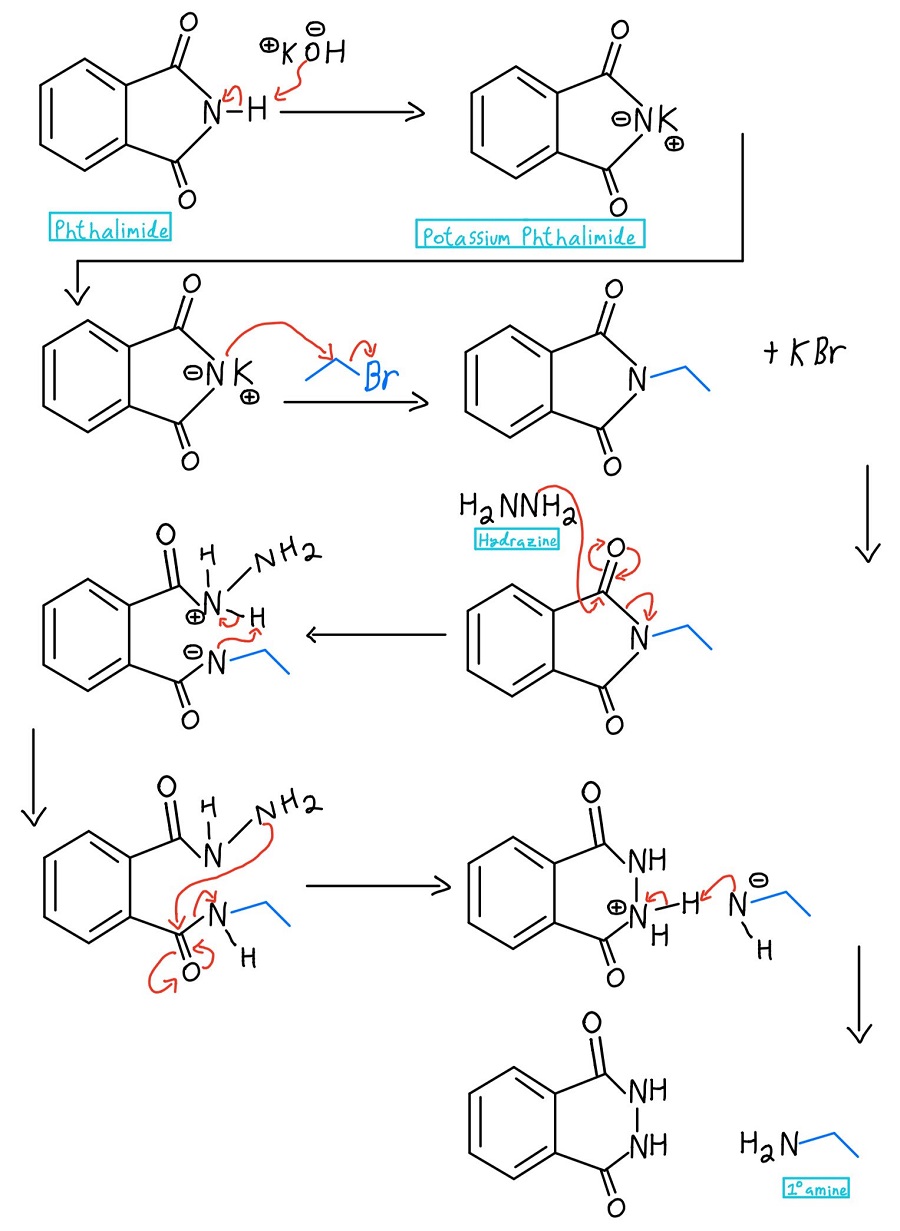
Mécanisme complet de l’hydrazine
Leave a Reply