Infection au complexe Burkholderia cepacia dans une unité de fibrose kystique pour adultes à Madrid | Enfermedades Infecciosas y Microbiología Clínica
Introduction
Le complexe Burkholderia cepacia (BCC) est apparu comme un agent pathogène important chez les patients atteints de fibrose kystique (FK) en raison du risque de syndrome cepacia (une pneumonie nécrosante mortelle avec bactériémie), de la multirésistance innée de l’organisme aux antibiotiques et de la transmissibilité des souches bactériennes entre patients par contact social.1 Le contact étroit et prolongé entre les patients atteints de FK et le partage des nébuliseurs facilitent l’acquisition et la transmission de la BCC.2,3 Il est prouvé que l’acquisition de la bactérie BCC est associée à l’hospitalisation et à l’infection croisée par contact social FK.
La taxonomie du genre Burkholderia a subi plusieurs révisions majeures au cours des dernières décennies. Au milieu des années 1990, il a été démontré que les souches de « B. cepacia » appartenaient à au moins cinq espèces différentes, qui ont été collectivement désignées sous le nom de complexe B. cepacia4. D’autres analyses taxonomiques ont révélé qu’il y avait encore plus d’espèces au sein du BCC et actuellement 17 espèces du complexe B. cepacia ont été décrites4-7 : B. cepacia, B. multivorans, B. cenocepacia, B. stabilis, B. vietanmiensis, B. dolosa, B. ambifaria, B. anthina, B. pyrrocinia, B. ubonensis, B. latens, B. diffusa, B. arboris, B. seminalis, B. metallica, B. lata et B. contaminans8.
À l’exception de B. ubonensis, toutes ces espèces ont été isolées de crachats de patients atteints de FK,6,7 avec B. cenocepacia et B. multivorans comme prédominantes.9
B. cenocepacia est subdivisé en 4 sous-types (IIIa, IIIb, IIIc et IIId), qui sont codés par quatre allèles du gène recA et il existe des différences dans la fréquence et la virulence des souches. En outre, B. cenocepacia est considéré comme l’un des agents pathogènes les plus graves, car il est fréquemment associé à une survie réduite et au risque le plus élevé de développer le syndrome de cepacia fatal.10 Les espèces de BCC sont intrinsèquement résistantes à de nombreux antibiotiques tels que les aminoglycosides et la polymyxine B et nécessitent souvent une thérapie combinée pour supprimer l’infection dans la FK11.
Les infections par les bactéries BCC chez les patients atteints de FK sont souvent corrélées à une morbidité et une mortalité accrues, et la résistance innée de ces organismes à un large éventail d’antibiotiques complique le traitement des patients infectés.12,13 Cette résistance est causée par divers mécanismes, notamment une perméabilité limitée, des modifications de la structure des lipopolysaccharides et la présence de plusieurs pompes d’efflux de médicaments multiples, de bêta-lactamases chromosomiques inductibles et de protéines de liaison à la pénicilline altérées. En outre, la formation in vitro de biofilms a été décrite pour de multiples souches du complexe B. cepacia et cela peut contribuer à leur capacité à survivre dans l’environnement pulmonaire de la FK en fournissant une protection supplémentaire contre les antibiotiques.14-16
Le traitement des patients infectés par le BCC doit être basé de préférence sur les résultats des tests de sensibilité et comprend souvent une thérapie combinée avec deux ou trois antibiotiques montrant une activité synergique.12,17,18Les études de sensibilité in vitro sur les souches de BCC montrent que les concentrations de rupture de la ceftazidime, de la ciprofloxacine, du méropénème, des tétracyclines ou de fortes doses de tobramycine ont une activité bactériostatique contre une fraction considérable de ces souches.19-21 Par conséquent, ces antibiotiques sont souvent utilisés pour traiter les patients CF infectés par le BCC. En outre, le cotrimoxazol est encore fréquemment utilisé dans le traitement des infections chroniques à BCC, bien que les tests de sensibilité de ces antibiotiques complémentaires aient révélé une faible activité contre de nombreuses souches de BCC.18,22
Le but de cette étude était d’évaluer les isolats et la susceptibilité du BCC et d’analyser les répercussions cliniques.
Méthodes
Les expectorations des patients atteints de FK ont été analysées pour les isolats finaux de BCC, à l’unité de FK pour adultes de l’hôpital La Princesa qui fonctionne depuis mars 1997. Ces échantillons ont été traités dans le département de microbiologie selon la procédure standard23 ; nous avons utilisé un milieu sélectif spécifique et un streak quantitatif, en utilisant la procédure conventionnelle de dilution en série pour l’échantillon. Les crachats ont subi un processus d’homogénéisation avec de la N-acétylcystéine avant d’être mis en culture. Dans notre laboratoire, les milieux de culture utilisés étaient les suivants : gélose au sang, gélose bacitracine chocolat, gélose manitol-sel, gélose MacConkey, gélose Sabouraud cloranfenicol et milieu sélectif pour B. cepacia appelé BCSA (Biomèrieux). Le temps d’incubation des plaques était de 3 à 5 jours à 35°C. La gélose Bacitracin chocolat a été incubée sous atmosphère de CO2.
L’identification préliminaire des souches de BCC a été réalisée par MicroScan (Siemens) et Api 20 NE (Biomérieux). Ces procédures ont été réalisées conformément aux recommandations du fabricant.24
Par la suite, les souches ont été remises au Centro Nacional de Microbiología (Majadahonda, Madrid) pour la confirmation et la détermination de l’espèce et de la génospécie. Pour cette étude, les méthodes suivantes ont été appliquées : Api 20 NE (biomérieux, Marcy l’Etoile) et GN2 Microplate (BIOLOG, Hayward, CA) et méthodes moléculaires. Toutes les procédures ont été réalisées conformément aux recommandations du fabricant.
Extraction de l’ADN chromosomique
L’extraction de l’ADN a été réalisée avec le kit commercial QIAamp DNA Mini Kit (QIAGEN, GmbH, Hilden, Allemagne) en suivant les instructions du fabricant.
Analyse PCR
L’amplification des gènes a été réalisée dans un volume final de 25μl, à l’aide du kit PuReTaq Ready-To-Go PCR Beads (Amersham Biosciences, Buckinghamshire, UK), et contenant 5μl d’ADN extrait et 10pmol de chaque amorce : fD1 et rP225 pour l’ADNr 16S, et BCR1 et BCR426 pour recA. Le cyclage thermique a été effectué dans un TaKaRa PCR Thermal Cycler v. III mod TP600 (TAKARA BIO Inc., Otsu, Shiga) dans les conditions suivantes pour l’ADNr 16S : 94°C pendant 5min pour le premier cycle, 35 cycles de 15s à 94°C, recuit pendant 15s à 55°C, et extension à 72°C pendant 1min et 50s. Les conditions d’amplification de recA étaient les suivantes : 94°C pendant 5min, 30 cycles de 30s à 94°C, recuit pendant 45s à 55°C, et extension à 72°C pendant 10min.
Nous avons visualisé 2μl de chaque produit PCR par électrophorèse sur gel d’agarose avec une concentration d’agarose ajustée à 1,5% et en utilisant un tampon TAE 1×. Des marqueurs de taille moléculaire ont été inclus sur tous les gels : Marker X 0,07-12,2kbp (Roche Applied Sciences, Mannheim, Allemagne) et GeneRuler 100bp DNA Ladder (Fermentas GmbH, St. Leon-Rot, Allemagne) pour les produits 16s rDNA et recA, respectivement.
Les souches identifiées comme étant B. cenocepacia ont été soumises à la méthode PCR avec des amorces spécifiques pour le groupe RecA-IIIA (BCRG3A1 et BCRG3A2) et RecA-IIIB (BCRG3B1 et BCRG3B2) dans des conditions précédemment décrites24.
Ten μl de produits PCR ont été visualisés par électrophorèse sur gel d’agarose dans les mêmes conditions que celles décrites ci-dessus.
Analyse des séquences nucléotidiques
Les produits PCR d’ADNr 16s et de recA ont été séquencés en utilisant respectivement fD1 et rP2 et BCR1 comme amorces. Les réactions de séquençage ont été préparées à l’aide de Big Dye Terminator v 3.1 (Applied Biosystem, USA) dans un volume final de 10μl conformément aux instructions du fabricant, et analysées avec le système d’électrophorèse capillaire ABI PRISM 3100 genetic analyzer (Applied Biosystem, USA). Les séquences ont été assemblées à l’aide du logiciel SeqMan 3.61 (DNA Star, Inc, Madison, WI, USA). L’analyse a également impliqué l’utilisation du Basic Local Alignment Search Tool (BLAST : www.ncbi.nlm.nih.gov) pour établir l’identité correcte des gènes.
Analyse PFGE
La relation entre les souches a été analysée par électrophorèse en champ pulsé (PFGE). La préparation des bouchons, la lyse, le lavage des cellules et la digestion de restriction ont été effectués comme décrit précédemment25,26 avec de légères différences. L’enzyme de restriction XbaI (40U, Fermentas GmbH, St. Leon-Rot, Allemagne) a été utilisée. La PFGE a été réalisée selon le protocole décrit pour Stenotrophomonas maltophilia par Valdezate et al,27 et en utilisant le système DRIII Chef (Bio-Rad Laboratories, Hercules, USA) et des concaténaires de phages lambda (Biolabs, New England, UK) comme marqueur de poids moléculaire. Les images ont été obtenues avec le logiciel Quantity One v. 4.6.1 (BioRad). L’analyse des images a été réalisée visuellement et les isolats ont été considérés comme génotypiquement indiscernables s’ils présentaient un motif de bandes identique.
La sensibilité aux antibiotiques a été réalisée par microdilution avec MicroScan et diffusion sur disque simultanément. Les deux méthodes ont été considérées comme des points d’arrêt CLSI.28 Pour la ciprofloxacine et l’imipénème, les points d’arrêt de la lévofloxacine et du méropénème ont été utilisés, respectivement. Les antibiotiques suivants ont été étudiés : ceftazidime, ciprofloxacine, lévofloxacine, cotrimoxazol, minocycline, imipénème et méropénème.
Les patients atteints de BCC ont été étudiés avec les variables suivantes : âge (au début et actuellement), sexe, poids (au début et actuellement), mutation gén Cystic Fibrosis Transmembrana Regulator, évolution de la fonction respiratoire qui a été déterminée par le pourcentage selon la valeur théorique du volume expiré dans la première seconde (FEV1) depuis leur premier isolement ainsi que les ponctuations radiologiques de Brasfield et des cliniques de Shawchman au début de l’isolement du BCC et actuellement.
La co-colonisation avec d’autres micro-organismes a été évaluée.
Le score de Brasfield a été évalué de 0 à 5 (de faible à élevé) en fonction des signes radiologiques : emprisonnement de l’air, ombres linéaires, lésions kystiques nodulaires, consolidation segmentaire ou lobaire et de l’impression globale de la sévérité. La ponctuation globale obtenue a été soustraite à 25. La plus faible valeur obtenue correspondait à une radiologie plus sévère. La radiologie thoracique et son correspondant au score de Brasfield étaient réalisés chaque année.
Score clinique Shwachman évaluait 4 items avec une ponctuation maximale de 25 chacun : activité générale, examen physique, croissance et nutrition et radiographie thoracique. La ponctuation idéale était de 100 et le statut des patients a été classé en fonction de la ponctuation : excellent (86-100 points), bon (71-85 points), léger (56-70 points), modéré (40-55 points) ou grave (inférieur ou égal à 40).
Résultats
Le BCC a été isolé chez 12 des 70 patients adultes atteints de FK (17,1%) pendant 10 ans. Deux des patients ont eu une transplantation pulmonaire, l’un d’eux est décédé après la transplantation et l’autre, le BCC a été éradiqué en 2005 avant la transplantation qui a eu lieu en 2011. Le BCC a été éradiqué chez un autre patient en 2009. Ces patients n’ont été étudiés que pendant quelques mois, et l’évolution de la clinique n’a donc pas été enregistrée. B. cenocepacia a été isolé chez 4 patients (33,3%), B. contaminans chez 3 patients (25%), B. stabilis chez 2 patients (16,7%), B. vietnamiensis chez 2 patients (16,7%), B. cepacia chez un patient (8,3%), B. multivorans chez un patient (8,3%) et B. lata chez un patient (8,3%). Parmi B. cenocepacia, le sous-type IIIa a été identifié chez deux patients sur quatre (50 %), et le sous-type IIIb chez les deux autres patients (50 %). Un patient avait d’abord B. cenocepacia, puis une B. lata. De même, un autre patient avait B. stabilis et ensuite B. contaminans. Dans notre étude, 50 % des patients atteints de BCC présentaient des souches de Staphylococcus aureus (tableau 1).
Isolations des différentes espèces du complexe Burkholderia cepacia et co-colonisation avec d’autres pathogènes de la FK chez les patients de façon chronique.
| Patient | Isolation 1 | Isolation 2 | Co-colonisation | Observations |
| 1 | B. contaminans | H. influenzae | ||
| 2 | B. cepacia | P. aeruginosa | ||
| 3 | B. cenocepacia (sub. IIIa) | – | ||
| 4 | B. multivorans | S. aureusH. influenzae | ||
| 5 | B. vietnamiensis | S. aureus | ||
| 6 | B. stabilis | S. aureus | ||
| 7 | B. cenocepacia (sub. IIIb) | S. aureus | ||
| 8 | B. cenocepacia (sub. IIIb) | B. lata | P. aeruginosa | Eradiqué |
| 9 | B. stabilis | B. contaminans | S. aureus | |
| 10 | B. cenocepacia (sub IIIa) | – | Transplantée et morte | |
| 11 | B. vietnamiensis | S. aureus | Eradiqué et transplanté | |
| 12 | B. contaminans | – |
L’analyse PFGE montre que la même souche a été isolée chez chaque patient atteint de FK mais elle était différente entre les patients, donc cela certifie qu’il n’y a pas eu de transmission croisée.
90% des BCC étaient sensibles au méropénème, 80% au cotrimoxazol, 60% à la minocycline, 50% à la ceftazidime et 40% à la lévofloxacine, 20% à la ciprofloxacine et 10% à l’imipénème.
Les 50% des patients atteints de FK étaient des hommes et l’âge moyen auquel ces patients ont eu leur premier isolement de BCC était de 24,4 (SD : 7,71). Les 41,7% des patients avaient une mutation F508del/autre, 33,3% une mutation F508del/F508 et 25% une autre/autre mutation.
Au début, le score de Brasfield et Shwachman a été calculé pour tous les patients inclus dans cette étude, et la ponctuation moyenne était de 18,6 et 82,3. Cependant, le score actuel de Brasfield et Shwachman est réalisé avec les patients colonisés. La ponctuation moyenne était de 21,1 et 81. Un seul patient était diabétique et 6 patients avaient une insuffisance pancréatique. Le tableau 2 montre les caractéristiques cliniques des patients atteints de mucoviscidose qui ont eu un BCC.
Caractéristiques cliniques des patients atteints de mucoviscidose.
| Fréquence du sexe (%) | |
| Homme | 6 (50%) |
| Femme. | 6 (50%) |
| Moyenne d’âge (ET) | |
| Primo-infection (n=12) | 24.4 ans (7,71) |
| Actuel (n=9) | 29 ans (8,04) |
| Poids moyen (ET) | |
| Primo-infection (n=12) | 57.9kg (8,5) |
| Actuelle (n=9) | 58,7kg (8,6) |
| Fréquence de mutation (%) | |
| F508del/F508del (n=12) | 4 (33. 3%) |
| F508del/autre (n=12) | 5 (41.7%) |
| Autre/autre (n=12) | 3 (25%) |
| Moyenne de la ponctuation de Brasfield | |
| Primo-infection (n=12) | 18.6 |
| Courant (n=9) | 21.1 |
| Poncture Shwachman moyenne | |
| Primo-infection (n=12) | 82.3 |
| Actuelle (n=9) | 81 |
| Fréquence du diabète. (%) | |
| Actuel (n=9) | 0 (0%) |
| Insuf. pancréatique fréquence (%) | |
| Actuelle (n=9) | 6 (66.6%) |
La fig. 1 montre l’évolution de la fonction pulmonaire (%FEV1) des patients qui avaient plus d’un isolement de BCC.
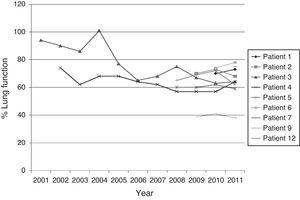
Évolution de la fonction pulmonaire des patients chroniques atteints de FK à partir du premier isolement du BCC dans les expectorations.
Discussion
Il y a peu d’études liées à l’évolution clinique des patients avec une espèce isolée de BCC, et il y a une idée générale que l’espèce B. cenocepacia est associée à une plus grande morbidité et mortalité chez les patients atteints de FK19. Par conséquent, il n’existe pas beaucoup de données récentes sur les patients atteints de BCC en Espagne. Une étude menée à l’Hospital Universitario de Cruces montre une augmentation de l’incidence de la colonisation par le BCC.29
Il est important que l’identification des espèces de BCC soit effectuée dans un centre spécialisé, car les facultés aident à superviser une surveillance étroite de ces patients qui sont colonisés par ces espèces, car elles peuvent évoluer de manière négative.
Une étude réalisée par Van Pelt et al.30 montre que l’API 20 NE était plus précis que le MicroScan. 90 % des isolats ont été correctement identifiés avec l’API 20NE contre 68 % avec le MicroScan. Ils suggèrent l’utilisation de plaques BCSA pour l’isolement initial de B. cepacia directement à partir de matériel clinique. La sensibilité de ces milieux de croissance est apparue excellente (96%) ; la spécificité n’était pas de 100%. Il était assez frappant de constater que pour les tests automatisés, comme le MicroScan, la précision était insuffisante. Le principal résultat de la présente analyse est le fait que l’identification moléculaire par analyse PCR-RFLP est supérieure aux procédures d’identification biochimique et microbiologique des espèces, bien qu’il faille souligner que les résultats obtenus avec API20 NE étaient satisfaisants30.
Dans notre étude, les B. cenocepacia, B. contaminans, B. vietnamiensis, B. stabilis, B. multivorans, B. cepacia et B. lata ont été isolés à partir des sécrétions respiratoires de 12 patients FK examinés et B. cenocepacia était l’espèce la plus répandue comme la plupart des données décrites dans la littérature européenne sur les patients FK.19 Cependant, cette découverte ne concorde pas avec une étude portugaise (Susana Correia et cols), dans laquelle les espèces les plus fréquentes étaient B. cepacia 57% et B. stabilis 13%. Cela est peut-être dû à l’utilisation de solutions salines non stériles intrinsèquement contaminées par B. cepacia.19 Ces solutions contaminées ont été détectées par Infarmed lors d’une inspection microbiologique de routine.19 Dans notre étude, B. cepacia et B. stabilis ont été isolés dans une proportion plus faible comme d’autres études en Europe et en Amérique.19
Parmi les isolements de B. cenocepacia, il y avait la même proportion entre les sous-types IIIa et IIIb de B. cenocepacia.
Un des patients a eu B. cenocepacia comme premier isolement, B. lata comme deuxième isolement puis a été éradiqué. Un autre patient avait B. vietnamiensis en 2004 qui a été éradiqué, et une transplantation pulmonaire a été faite chez lui en 2011, et un autre patient a été isolé avec B. cenocepacia sous-type IIIa en 2004, mais il est décédé la même année après une transplantation pulmonaire. Les résultats de survie de la transplantation pulmonaire sont pires chez les patients qui sont colonisés par B. cenocepacia, de sorte que certaines unités de transplantation contre-indiquent la transplantation dans ce cas. Il a été reconnu que B. cenocepacia a un plus mauvais pronostic que B. multivorans avec une survie plus courte lorsqu’il est apparié avec des témoins Pseudomonas aeruginosa.31 Le syndrome de Cepacia a été rapporté avec ces deux espèces.26 La pathophysiologie exacte de ce syndrome est mal comprise, et le taux de mortalité précis n’est pas connu, bien qu’on pense qu’il approche les 100%.32
Nos patients ont des valeurs de VEMS faibles. Un grand nombre de patients s’étaient déjà détériorés avant l’isolement du BCC en raison de la colonisation par d’autres agents pathogènes et de la progression de la maladie. Chez les patients cliniquement stables, aucune altération significative n’a été observée dans les valeurs du VEMS et l’état nutritionnel. Il est prouvé que la colonisation pulmonaire peut ne pas être détectée par les cultures standard pendant un certain temps (jusqu’à 2 ans) après l’acquisition du BCC.33 De plus, il n’est pas clair si, dans les cas d’isolement intermittent, il y a une réinfection par une nouvelle souche ou s’il y a une recrudescence de la souche initiale.20 Dans la majorité des cas de nos différents isolements, aucun remplacement des souches initiales de BCC n’a été observé.
Des cas ont été enregistrés dans lesquels la même souche (avec le même génotype), qui a infecté de manière persistante un patient pendant plusieurs années, a été éradiquée par une antibiothérapie ou n’a eu aucun impact apparent sur le tableau clinique d’autres patients. La raison pour laquelle les souches des différentes espèces de BCC diffèrent dans leur persistance, leur épidémiologie et leur potentiel pathogène dans la FK et pourquoi les mêmes souches peuvent être associées à des évolutions cliniques très différentes n’est pas claire.Cela dépend de facteurs inhérents à chaque patient, de la co-colonisation par d’autres pathogènes et d’autres facteurs encore à identifier, soulignant l’importance d’entreprendre des études de ce type19.
La résistance aux antibiotiques est considérée comme un important facteur de virulence des organismes BCC.14 Bien que la thérapie soit généralement guidée par les tests de sensibilité aux antimicrobiens, l’éradication des organismes BCC est rarement atteinte.21 De multiples hypothèses ont été formulées pour expliquer cet échec, notamment des concentrations inadéquates d’antibiotiques ou l’inactivation de l’antibiotique dans les expectorations, l’altération des défenses de l’hôte chez les patients atteints de FK, la formation de biofilms, l’effet » inoculum » et le taux de croissance in vivo de ces organismes34.
Elke et al. ont rapporté dans une étude belge que le méropénem, la minocycline et la ceftazidime étaient les antibiotiques les plus actifs contre l’isolement des BCC et que la ciprofloxazine et le triméthoprime/sulfaméthoxazole avaient l’activité la plus faible.35 Cependant, notre étude a révélé que le méropénem était le plus actif avec 90% de sensibilité, suivi par le triméthoprime/sulfaméthoxazole, la minocycline et la ceftazidime avec 80%, 60% et 50%, respectivement. Bien que les organismes du BCC soient généralement résistants aux aminoglycosides, de fortes doses de tobramycine ont inhibé la majorité des souches testées. La tobramycine nébulisée donnant des concentrations maximales élevées dans les expectorations est de plus en plus utilisée pour traiter les patients atteints de FK.36-38
En conséquence, ces concentrations plus élevées doivent être prises en compte lors de l’évaluation de l’utilité de cet antibiotique.35 Plusieurs rapports confirment que la tobramycine nébulisée est très prometteuse dans le traitement des patients FK infectés par le BCC : par exemple, Weidmann et al.39 ont récemment décrit l’éradication complète des organismes BCC des poumons de patients FK en utilisant une combinaison de tobramycine nébulisée et d’amiloride. De plus, une thérapie combinée de méropenem et de tobramycine nébulisés et intraveineux a également permis de traiter avec succès une patiente FK souffrant du syndrome de cepacia, bien que les échantillons d’expectoration de cette dernière soient restés positifs pour B. cenocepacia.39
Les espèces de BCC sont intrinsèquement résistantes à de nombreux antibiotiques tels que les aminoglycosides et la polymyxine B et nécessitent souvent une thérapie combinée pour supprimer l’infection dans la FK.11 Les antibiotiques polymyxine, gentamicine et vancomycine sont utilisés à des concentrations élevées dans la gélose sélective B. cepacia, un milieu très efficace pour leur isolement à partir des expectorations de FK.11 Nzula et al.13 ont comparé la sensibilité aux antibiotiques de six espèces de BCC et ont conclu qu’elle était très variable, à l’exception de la résistance innée à la polymyxine, et qu’elle n’était pas liée au statut taxonomique des isolats examinés. L’efflux, la sécrétion de bêta-lactamases chromosomiques et l’imperméabilité de l’enveloppe externe des bactéries BCC ont été impliqués dans la résistance aux antibiotiques14.
En revanche, la base moléculaire de la résistance aux biocides des bactéries BCC a été peu étudiée bien que ces organismes soient liés à de nombreux cas de contamination dans les désinfectants et autres solutions anti-infectieuses.40
La mission et donc le défi posé par l’identification des espèces BCC pour les laboratoires de microbiologie clinique de routine sont différents. Les souches isolées sur des milieux sélectifs et provisoirement identifiées comme appartenant au BCC à l’aide de systèmes commerciaux doivent être confirmées à l’aide des tests biochimiques classiques décrits.41
La détection précoce du BCC est extrêmement importante tant pour le patient atteint de FK que pour la communauté FK. Cependant, une étude récente5 indique que moins de la moitié des centres américains interrogés utilisent des milieux sélectifs spécifiques à « B. cepacia » ou incubent les cultures pendant des périodes prolongées, deux conditions qui améliorent le rendement de cet organisme. Dans cette étude, nous n’avons éradiqué B. cenocepacia que chez un seul patient ; un autre patient est décédé immédiatement après la transplantation, et aucun des deux patients n’a eu le syndrome de cepacia et n’a souffert d’une détérioration clinique importante, bien que la période d’observation ait été courte parce qu’ils ont acquis le BCC récemment.
L’amélioration du diagnostic des infections causées par les membres du BCC et d’autres organismes similaires à B. cepacia aidera à l’interprétation des résultats des études de résultats cliniques et, ce faisant, fournira des informations cruciales concernant la pathogénicité et/ou la transmissibilité des souches spécifiques impliquées5.
Conflit d’intérêt
Aucun des auteurs n’a de conflit d’intérêt à déclarer.
Leave a Reply