Frontières en Immunologie
Introduction
En l’absence de prévention primaire par la vaccination et d’un traitement spécifique pour le COVID-19 des stratégies de traitement rationnelles peuvent néanmoins être disponibles. Outre les thérapies visant à affecter directement la réplication du virus, des immunothérapies ont été proposées pour réduire les effets de l’inflammation induite par le virus (2). Celles-ci incluent le traitement par corticostéroïdes, qui n’est pas recommandé en raison de ses effets immunosuppresseurs, lesquels peuvent entraîner une aggravation de l’issue par rapport aux sujets non traités. Des approches plus spécifiques ciblent l’IL-6, le TNFα, les inhibiteurs de la Janus kinase (JAK1/JAK2) et les intéférons de type 1 . Enfin, le système du complément a été considéré comme une cible (3-5). Ces paramètres peuvent avoir une importance pronostique, car le rapport IL6/interféron IFɤ semble prédire la gravité de la maladie (6).
En outre, la perspicacité que le virus utilise l’enzyme de conversion de l’angiotensine 2 (ECA2) liée à la membrane comme point d’entrée ouvre la voie à des stratégies potentielles pour modifier l’activité de ce système. Il a été proposé que l’utilisation d’antagonistes des récepteurs de l’angiotensine, qui conduisent à une expression régulée de l’ACE2, puisse être nuisible (7). L’opinion alternative d’un effet bénéfique potentiel de ces composés a également été exprimée (8), sur la base des effets physiologiquement anti-inflammatoires et protecteurs de cette enzyme. Cette controverse a récemment été clairement exposée (9, 10). Le défi est de réduire l’ACE2 comme point d’entrée sans aggraver la réaction inflammatoire, une fois l’infection survenue.
Réduction de l’ACE2 pour réduire l’entrée du Covid-19 ?
Suivant les résultats mécanistes, la réduction de l’expression de l’ACE2 réduirait le nombre de points d’accès du virus à l’organisme lors de la primo-infection et potentiellement la propagation à l’intérieur du corps. Ces deux facteurs devraient conduire à une évolution clinique potentiellement plus douce. Les cellules sensibles à l’infection par le SRAS semblent être principalement les pneumocytes de type II, les entérocytes absorbants iléaux et les cellules sécrétoires des gobelets nasaux (11). Par conséquent, il peut être intéressant d’identifier un mécanisme permettant de réduire l’expression membranaire de l’ACE2 dans ces cellules (en gardant à l’esprit les conséquences négatives potentielles). Pour augmenter la plausibilité d’une telle approche, il serait utile de suivre les rapports sur l’utilisation réussie des approches de la médecine traditionnelle chinoise (MTC). L’un des composés les plus fréquemment utilisés par la MTC contient un extrait de glycyrrhiza glabra, c’est-à-dire de la plante de réglisse (12) et interagit avec le système angiotensine-aldostérone : L’un de ses constituants actifs est la glycyrrhizine (GL), qui est métabolisée dans l’intestin de l’homme en un métabolite systémique actif, l’acide glycyrrhétinique (GA). L’administration de GL et de GA a un certain nombre d’effets pertinents : GA inhibe principalement une enzyme appelée 11-bêta-hydroxystéroïde déshydrogénase (11bHSD), de type 1 et 2 (13). Le type 2 (11bHSD2) est le plus important. Son inhibition permet au cortisol d’accéder aux récepteurs minéralocorticoïdes (MR) dans les tissus périphériques spécifiques de l’aldostérone, notamment les reins, les poumons, les cellules nasales et endothéliales, dans lesquels il serait autrement empêché de le faire. Cela est dû à son activité de dégradation rapide du cortisol au niveau intracellulaire pour permettre à l’aldostérone d’accéder au récepteur. En d’autres termes, l’inhibition de cette enzyme conduit à une activation de type aldostérone du MR via le cortisol et peut ressembler aux effets de niveaux élevés d’aldostérone dans ces organes. Dans ce contexte, il est intéressant de noter que des niveaux élevés d’aldostérone entraînent une régulation négative de l’ECA2 dans le rein (14), un tissu qui exprime la 11bHSD2 comme le poumon et les cellules épithéliales nasales, c’est-à-dire les principaux points d’entrée de COVID-19, alors que l’antagonisme du MR a des effets opposés dans plusieurs tissus (15). Ceci est en accord avec l’observation que, dans certaines circonstances, les composés réducteurs d’aldostérone, comme l’énalapril, peuvent conduire à une augmentation de l’expression de l’ACE2 (16, 17).
Effet antiviral direct de GA ou GL
Intéressant que GL ou son métabolite actif GA exprime des effets antiviraux pour le virus apparenté SARS-corona (18, 19) en culture cellulaire : Les cellules Verum infectées par des échantillons de plasma de patients ont montré une réduction significative de l’absorption du virus et du taux de réplication, lorsque le GL était co-administré (18) ; Un effet similaire a été décrit par Chen et al. dans une lignée cellulaire Vero-E6, cependant, aucun effet n’a été observé dans une lignée cellulaire fRhK4 (19). Il est important de noter que GA, le composé systémique actif après administration orale, n’a pas été étudié, ce qui rend ces résultats potentiellement pertinents pour une administration locale (inhalée) ou intraveineuse. Dans une étude sur des cellules des voies respiratoires humaines, GA, mais pas GL, a montré un effet sur le taux d’infection par le virus respiratoire syncytial humain (20). Ces effets antiviraux directs en dehors du MR indiquent un mécanisme supplémentaire, mais inconnu. Dans ce contexte, il peut être important de noter qu’en plus de l’ACE2, la sérine protéase TMPRSS2 est nécessaire pour l’infection d’une cellule (21). L’inhibition de cette enzyme par un inhibiteur de protéase comme intervention thérapeutique a été proposée par les auteurs. La TMPRSS2 a été impliquée dans les infections par le corona et le virus de la grippe (22). Il est intéressant de noter que l’expression de cette enzyme est régulée par GA (23), ce qui pourrait expliquer les effets antiviraux plus larges de GA (24). Elle est régulée par les androgènes (23), ce qui peut expliquer en partie les différences de genre dans l’expression clinique des infections COVID-19.
Anti-inflammation de l’ACE2 et effets anti-inflammatoires de la Glycyrrhizine
Les conséquences en aval d’une expression réduite de l’ACE2 sont, comme souligné ci-dessus, quelque peu controversées (25). L’activité de l’ACE2 est généralement protectrice, y compris pour les tissus pulmonaires (26). Elle le fait en supprimant les conséquences de l’activation du récepteur de l’endotoxine (LPS), c’est-à-dire le récepteur 4 de type péage (TLR4) et, par conséquent, l’inflammation connexe dans le poumon (tempête d’endotoxine) (27) : La surexpression de l’ACE2 a inhibé l’inflammation induite par le LPS dans cette étude. Par conséquent, l’expression réduite de l’ACE2 pourrait être considérée comme préoccupante. Dans ce contexte, une deuxième propriété de la glycyrrhizine devient importante, c’est-à-dire son effet immunmodulateur. Le plus connu d’entre eux est son effet antagoniste des mécanismes dépendants de TLR4. Un effet antagoniste de TLR4 de GA réduit l’inflammation dans plusieurs tissus, y compris le poumon (28). En outre, l’AG a conduit à une réduction de l’expression de TLR4 dans le cœur et le poumon dans un modèle d’inflammation au LPS. Ceci a été accompagné d’une réduction significative de la libération de cytokines, c’est-à-dire de la libération de TNFα, IL6 et IL1ß (29). Conformément GL a des effets protecteurs dans le syndrome de détresse respiratoire aiguë induit par l’activateur TLR4 LPS chez les souris (28). Le potentiel anti-inflammatoire au sein du poumon a également été démontré dans un modèle murin d’infection à Streptococcus aureus, où l’administration intrapéritonéale de GL a largement supprimé les marqueurs inflammatoires (30). Ces résultats sont en accord avec l’activité du GL ou de l’AG pour inhiber les voies inflammatoires, via TLR4 (31-34). Le mécanisme du GL contre l’inflammation pulmonaire et cardiaque peut en partie être indirect en modifiant le rapport entre les cellules suppressives dérivées des myéloïdes (MDSC) et les cellules myéloïdes CD11b+Gr1 (29). Globalement, l’action de GL pour inhiber l’activité de TLR4 peut induire une activité anti-inflammatoire en aval de l’ACE2 moins actif (35). De plus, l’AG conduit à une suppression de la voie classique, mais pas de la voie alternative du complément (36). Enfin, une influence sur la sécrétion d’interféron a été décrite : l’extrait de glycyrrhiza entraîne une augmentation de la sécrétion d’interféron 1ß dans les cellules des voies respiratoires supérieures et inférieures (20), similaire à l’effet de GL et GA chez les souris, tel que déterminé dans les échantillons de sérum (37) ; en outre, GL réduit la mort chez les souris infectées par une dose létale de virus de la grippe par le biais de l’interféron ɤ et des cellules T (38). Ces mécanismes anti-inflammatoires peuvent également avoir une importance dans le SNC (39, 40) et peuvent donc protéger contre les conséquences neurologiques et psychiatriques d’une infection par COVID-19.
D’un point de vue plus pratique, il peut également être pertinent que le coronavirus SRAS Co-V, qui présente des similitudes avec COVID-19, a fréquemment conduit à une hypotension artérielle (25), ce qui n’est pas rare dans les processus inflammatoires. Ce symptôme potentiellement critique peut également être surmonté avec la glycyrrhizine, qui entraîne une augmentation de la pression artérielle (13). Veuillez consulter la figure 1 pour un aperçu schématique.
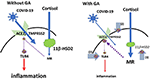
Figure 1. Modèle schématique de l’effet de la glycyrrhizine : L’accès du COVID-19 dans les cellules est médié par l’ACE2 avec le TMPRSS2 comme cofacteur. L’expression de l’ACE2 est régulée par les récepteurs minéralocorticoïdes (MR) : L’activation du MR conduit à une réduction de l’expression de l’ACE2 ; l’AG inhibe la 11βHSD2, ce qui permet au cortisol d’activer le MR, suivi d’une dérégulation de l’ACE2 (flèche 1). Le TMPRSS2 sensibilise l’ACE2 pour la mise à jour du virus dans la cellule. GA conduit à une expression réduite de TMPRSS2 et peut donc fournir un mécanisme supplémentaire pour restreindre l’accès du virus dans la cellule (flèche 2). L’ACE2 a un mécanisme anti-inflammatoire par la génération d’angiotensine 1-7 et d’angiotensine 1-9. Par l’activation des récepteurs de l’ACE ou de l’angiotensine 2, les voies inflammatoires sont supprimées. Cela inclut également une réduction de l’expression et/ou de l’activation du récepteur TLR4 membranaire (à gauche), c’est-à-dire que l’expression réduite de l’ACE2 pourrait être considérée comme problématique (35). Cependant, GA inhibe directement TLR4 indépendamment de l’activation de ACE2 (Flèche 3). (Les lignes ϕ et interrompues symbolisent l’inhibition ; les lignes continues rouges symbolisent l’activation).
Discussion
De nombreuses questions restent ouvertes. Quel est le rôle de l’ACE2 soluble par rapport à l’ACE2 liée à la membrane ? Peut-il y avoir un rôle de l’ACE2 soluble pour protéger l’occupation de la membrane ? Cela a été récemment proposé sur la base des résultats des expériences de culture cellulaire (41). Cependant, cela pourrait contredire quelque peu l’observation selon laquelle les sujets atteints d’insuffisance cardiaque, qui devraient être considérés comme à haut risque, présentent des niveaux élevés d’ACE2 soluble (42). Quelle est la différence entre les différents organes avec ou sans expression de 11bHSD2 ? Quel est le rôle de la réduction contre-régulatrice concomitante de l’aldostérone plasmatique avec l’administration d’un inhibiteur de la 11betaHSD2 ? Ces questions peuvent trouver une réponse dans des essais cliniques appropriés. La détermination du produit final de l’enzyme ACE2, c’est-à-dire l’angiotensine 1-7 ainsi que les conséquences cliniques potentielles sur la pression artérielle peuvent être utiles pour clarifier certaines de ces questions.
Important, la glycyrrhizine est globalement bien tolérée. Elle a une déclaration de la FDA de GRAS (généralement considéré comme sûr) (13). En particulier, une dose allant jusqu’à 100 mg/jour utilisée de manière chronique est sûre et n’entraîne pas de changements, qui ont été observés lors de l’utilisation chronique de doses plus élevées. Les effets indésirables attendus des doses élevées, notamment l’hypertension et l’hypokaliémie, doivent cependant être surveillés. Dans le contexte du SRAS, une dose allant jusqu’à 300 mg a été recommandée pour une administration orale et d’environ 240 mg pour une administration intraveineuse (19). Toutefois, Chen et al. affirment que cette dose pour l’administration i.v. pourrait être trop faible, compte tenu de la CE50 de l’effet sur la réplication du virus. Il faut préciser que cet effet direct n’est qu’un des trois mécanismes pertinents pour cibler le processus pathologique lié au COVID-19. Deux essais cliniques ouverts sont enregistrés sur le site d’enregistrement des essais cliniques de l’OMS, un essai ouvert randomisé (ChiCTR2000029768) et une série de cas (ChiCTR2000030490). Pour l’essai, une dose de 300 mg de glycyrrhizine par voie orale/jour est utilisée, la dose pour l’autre investigation n’a pas été rapportée. Pour le choix du mode d’administration, il est important de considérer que pour une action induite par l’AG, l’administration orale de GL est cruciale, car le GL n’est pas métabolisé en AG au niveau systémique. Cependant, pour un effet localisé du GL, une administration par voie intraveineuse ou par inhalation peut être nécessaire, qui doit être associée à une administration orale. Pour l’utilisation d’une prévention primaire potentielle, une sélection pragmatique de la dose de 150 mg/jour par voie orale peut être envisagée pour des études ultérieures, car cette dose affecte l’activité du MR.
Conclusion
La glycyrrhizine est un composé largement disponible et globalement sûr. Il peut être capable de réduire l’expression de l’ACE2 dans le poumon et malgré cela réduire l’inflammation pulmonaire. Il devrait être intéressant d’étudier ce composé pour un type de prévention primaire, qui ne réduit pas nécessairement le risque d’être infecté, mais potentiellement la gravité de la maladie, et en réduisant la symptomatologie déjà existante. Cela pourrait aider à réduire le nombre de patients gravement malades, qui submergent actuellement le système de santé.
Contributions de l’auteur
HM a rédigé le manuscrit et la version finale.
Conflit d’intérêt
HM détient un brevet pour l’utilisation de la glycyrrhizine dans la dépression réfractaire à la thérapie.
L’auteur déclare que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Remerciements
HM tient à remercier Laura Zumpano pour sa révision et ses commentaires utiles pour le manuscrit.
1. Sanders JM, Monogue ML, Jodlowski TZ, Cutrell JB. Traitements pharmacologiques pour la maladie à coronavirus 2019 (COVID-19) : une revue. JAMA. (2020). doi : 10.1001/jama.2020.6019. .
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Reddy Bonam S, Kaveri SV, Sakuntabhai A, Gilardin L, Bayry J. Adjunct immunotherapies for the management of severely ill COVID-19 patients. Cell Rep Med. (2020) 7:22. doi : 10.1016/j.xcrm.2020.100016
CrossRef Full Text | Google Scholar
3. Maglakelidze N, Manto KM, Craig TJ. Une revue : le complément ou le système de contact ont-ils un rôle dans la protection ou la pathogenèse du COVID-19 ? Pulm Ther. (2020) 1-8. doi : 10.1007/s41030-020-00118-5
CrossRef Full Text | Google Scholar
4. Mastaglio S, Ruggeri A, Risitano AM, Angelillo P, Yancopoulou D, Mastellos DC, et al. Le premier cas de COVID-19 traité avec l’inhibiteur du complément C3 AMY-101. Clin Immunol. (2020) 215:108450. doi : 10.1016/j.clim.2020.108450
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Risitano AM, Mastellos DC, Huber-Lang M, Yancopoulou D, Garlanda C, Ciceri F, et al. Complement as a target in COVID-19 ? (2020) Nat. Rev. Immunol. 1-2. doi : 10.1038/s41577-020-0320-7
CrossRef Full Text | Google Scholar
6. Lagunas-Rangel FA, Chavez-Valencia V. High IL-6/IFN-gamma ratio could be associated with severe disease in COVID-19 patients. J. Med. Virol. (2020). doi : 10.1002/jmv.25900. .
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Esler M, Esler D. Les médicaments bloquant les récepteurs de l’angiotensine peuvent-ils peut-être être nocifs dans la pandémie de COVID-19 ? J. Hypertens. (2020) 38:781-2. doi : 10.1097/HJH.0000000000002450
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Fedson DS, Opal SM, Rordam OM. Hiding in plain sight : an approach to treating patients with severe COVID-19 infection. MBio. (2020) 11:e00398-20. doi : 10.1128/mBio.00398-20
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Sommerstein R, Kochen MM, Messerli FH, Grani C. Maladie à coronavirus 2019 (COVID-19) : les inhibiteurs de l’enzyme de conversion de l’angiotensine/bloqueurs des récepteurs de l’angiotensine ont-ils un effet biphasique ? J Am Heart Assoc. (2020) 9:e016509. doi : 10.1161/JAHA.120.016509
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Vaduganathan M, Vardeny O, Michel T, Mcmurray JJ, Pfeffer MA, Solomon SD. Inhibiteurs du système rénine-angiotensine-aldostérone chez les patients atteints de Covid-19. N Engl J Med. (2020) 382:1653-9. doi : 10.1056/NEJMsr2005760
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Ziegler CG. Le récepteur ACE2 du SRAS-CoV-2 est un gène stimulé par l’interféron dans les cellules épithéliales des voies respiratoires humaines et est détecté dans des sous-ensembles cellulaires spécifiques à travers les tissus. Cell. (2020) S0092-8674:30500-6. doi : 10.1016/j.cell.2020.04.035
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Luo H, Tang QL, Shang YX, Liang SB, Yang M, Robinson N, et al. La médecine chinoise peut-elle être utilisée pour la prévention de la maladie à virus corona 2019 (COVID-19) ? Un examen des classiques historiques, des preuves de la recherche et des programmes de prévention actuels. Chin J Integr Med. (2020) 26:243-50. doi : 10.1007/s11655-020-3192-6
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Groupe d’experts de la révision des ingrédients cosmétiques. Rapport final sur l’évaluation de la sécurité de l’acide glycyrrhétinique, du glycyrrhétinate de potassium, du succinoyl-glycyrrhétinate de disodium, du glycéryl-glycyrrhétinate, du stéarate de glycyrrhétinyle, Stearyl Glycyrrhetinate, Acide Glycyrrhizique, Glycyrrhizate d’ammonium, Glycyrrhizate dipotassique, Glycyrrhizate disodique, Glycyrrhizate trisodique, Glycyrrhizate de méthyle et Glycyrrhizinate de potassium. Int J Toxicol. (2007) 26 (Suppl. 2):79-112. doi : 10.1080/10915810701351228
CrossRef Full Text | Google Scholar
14. Fukuda S, Horimai C, Harada K, Wakamatsu T, Fukasawa H, Muto S, et al. Aldosterone-induced kidney injury is mediated by NFkappaB activation. Clin Exp Nephrol. (2011) 15:41-9. doi : 10.1007/s10157-010-0373-1
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Keidar S, Gamliel-Lazarovich A, Kaplan M, Pavlotzky E, Hamoud S, Hayek T, et al. Le bloqueur des récepteurs minéralocorticoïdes augmente l’activité de l’enzyme de conversion de l’angiotensine 2 chez les patients atteints d’insuffisance cardiaque congestive. Circ Res. (2005) 97:946-53. doi : 10.1161/01.RES.0000187500.24964.7A
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Hu XS, Xie XD, Wang XX, Zeng CL, Ni YM, Yu GW, et al. Effets de l’inhibiteur de l’enzyme de conversion de l’angiotensine sur l’expression de l’enzyme de conversion de l’angiotensine 2 dans l’oreillette des patients atteints de fibrillation auriculaire. Zhonghua Xin Xue Guan Bing Za Zhi. (2007) 35:625-8.
PubMed Abstract | Google Scholar
17. Malfitano C, De Angelis K, Fernandes T, Wichi RB, Rosa K, Pazzine M, et al. L’énalapril à faible dose réduit l’angiotensine II et atténue les dysfonctionnements cardiaques et autonomes induits par le diabète. J Cardiovasc Pharmacol. (2012) 59:58-65. doi : 10.1097/FJC.0b013e3182354776
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Cinatl J, Morgenstern B, Bauer G, Chandra P, Rabenau H, Doerr HW. Glycyrrhizine, un composant actif des racines de réglisse, et réplication du coronavirus associé au SRAS. Lancet. (2003) 361:2045-6. doi : 10.1016/S0140-6736(03)13615-X
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Chen F, Chan KH, Jiang Y, Kao RY, Lu HT, Fan KW, et al. Sensibilité in vitro de 10 isolats cliniques du coronavirus du SRAS à certains composés antiviraux. J Clin Virol. (2004) 31:69-75. doi : 10.1016/j.jcv.2004.03.003
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Feng Yeh C, Wang KC, Chiang LC, Shieh DE, Yen MH, San Chang J. L’extrait aqueux de réglisse avait une activité antivirale contre le virus respiratoire syncytial humain dans les lignées cellulaires des voies respiratoires humaines. J Ethnopharmacol. (2013) 148:466-73. doi : 10.1016/j.jep.2013.04.040
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Hoffmann M, Kleine-Weber H, Schroeder S, Kruger N, Herrler T, Erichsen S, et al. L’entrée des cellules du SRAS-CoV-2 dépend de l’ACE2 et du TMPRSS2 et est bloquée par un inhibiteur de protéase cliniquement prouvé. Cell. (2020) 181:271-80 e278. doi : 10.1016/j.cell.2020.02.052
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Shen LW, Mao HJ, Wu YL, Tanaka Y, Zhang W. TMPRSS2 : une cible potentielle pour le traitement des infections par le virus de la grippe et les coronavirus. Biochimie. (2017) 142:1-10. doi : 10.1016/j.biochi.2017.07.016
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Sun Y, Jiang M, Park PH, Song K. Suppression transcriptionnelle du récepteur des androgènes par l’acide 18beta-glycyrrhétinique dans les cellules cancéreuses de la prostate humaine LNCaP. Arch Pharm Res. (2020) 43:433-48. doi : 10.1007/s12272-020-01228-z
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Hoever G, Baltina L, Michaelis M, Kondratenko R, Baltina L, Tolstikov GA, et al. Activité antivirale des dérivés de l’acide glycyrrhizique contre le SARS-coronavirus. J Med Chem. (2005) 48:1256-9. doi : 10.1021/jm0493008
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Gurwitz D. Angiotensin receptor blockers as tentative SARS-CoV-2 therapeutics. Drug Dev. Res. (2020). doi : 10.1002/ddr.21656. .
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Kaparianos A, Argyropoulou E. Systèmes locaux de rénine-angiotensine II, enzyme de conversion de l’angiotensine et son homologue ACE2 : leur rôle potentiel dans la pathogenèse des maladies pulmonaires obstructives chroniques, de l’hypertension pulmonaire et du syndrome de détresse respiratoire aiguë. Curr Med Chem. (2011) 18:3506-15. doi : 10.2174/092986711796642562
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Ye R, Liu Z. ACE2 exhibits protective effects against LPS-induced acute lung injury in mouse by inhibiting the LPS-TLR4 pathway. Exp Mol Catholique. (2020) 113:104350. doi : 10.1016/j.yexmp.2019.104350
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Yu Z, Ohtaki Y, Kai K, Sasano T, Shimauchi H, Yokochi T, et al. Rôles critiques des plaquettes dans la létalité induite par le lipopolysaccharide : effets de la glycyrrhizine et stratégie possible pour le syndrome de détresse respiratoire aiguë. Int Immunopharmacol. (2005) 5:571-80. doi : 10.1016/j.intimp.2004.11.004
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Seo EH, Song GY, Kwak BO, Oh CS, Lee SH, Kim SH. Effets de la glycyrrhizine sur la différenciation des cellules myéloïdes du cœur et des poumons chez les souris septiques induites par le lipopolysaccharide. Choc. (2017) 48:371-6. doi : 10.1097/SHK.0000000000000850
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Yao L, Sun T. L’administration de glycyrrhizine améliore les lésions pulmonaires aiguës induites par Streptococcus aureus. Int Immunopharmacol. (2019) 70:504-11. doi : 10.1016/j.intimp.2019.02.046
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Vitali R, Palone F, Pierdomenico M, Negroni A, Cucchiara S, Aloi M, et al. Le glycyrrhizate dipotassique via la signalisation HMGB1 ou AMPK supprime le stress oxydatif pendant l’inflammation intestinale. Biochem Pharmacol. (2015) 97:292-9. doi : 10.1016/j.bcp.2015.07.039
CrossRef Full Text | Google Scholar
32. Wu CX, He LX, Guo H, Tian XX, Liu Q, Sun H. Effet d’inhibition de la glycyrrhizine dans la libération et l’expression de la boîte 1 du groupe de haute mobilité induites par le lipopolysaccharide à partir des cellules RAW264.7. Shock. (2015) 43:412-21. doi : 10.1097/SHK.0000000000000309
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Thakur V, Nargis S, Gonzalez M, Pradhan S, Terreros D, Chattopadhyay M. Role of glycyrrhizin in the reduction of inflammation in diabetic kidney disease. Nephron. (2017) 137:137-47. doi : 10.1159/000477820
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Wang XR, Hao HG, Chu L. La glycyrrhizine inhibe la production de médiateurs inflammatoires induits par le LPS dans les cellules épithéliales endométriales. Microb Pathog. (2017) 109:110-3. doi : 10.1016/j.micpath.2017.05.032
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Ingraham NE, Lotfi-Emran S, Thielen BK, Techar K, Morris RS, Holtan SG, et al. Immunomodulation dans COVID-19. Lancet Respir Med. (2020) S2213-2600:30226-5. doi : 10.1016/S2213-2600(20)30226-5
PubMed Abstract | CrossRef Full Text | Google Scholar
36. Kroes BH, Beukelman CJ, Van Den Berg AJ, Wolbink GJ, Van Dijk H, Labadie RP. Inhibition du complément humain par l’acide bêta-glycyrrhétinique. Immunologie. (1997) 90:115-20. doi : 10.1046/j.1365-2567.1997.00131.x
PubMed Abstract | CrossRef Full Text | Google Scholar
37. Abe N, Ebina T, Ishida N. Induction d’interféron par la glycyrrhizine et l’acide glycyrrhétinique chez la souris. Microbiol Immunol. (1982) 26:535-9. doi : 10.1111/j.1348-0421.1982.tb00207.x
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Utsunomiya T, Kobayashi M, Pollard RB, Suzuki F. La glycyrrhizine, un composant actif des racines de réglisse, réduit la morbidité et la mortalité des souris infectées par des doses létales de virus de la grippe. Antimicrob Agents Chemother. (1997) 41:551-6. doi : 10.1128/AAC.41.3.551
PubMed Abstract | CrossRef Full Text | Google Scholar
39. Kong ZH, Chen X, Hua HP, Liang L, Liu LJ. Le prétraitement oral de la glycyrrhizine prévient la déficience cognitive induite par la chirurgie chez les souris âgées en réduisant la neuroinflammation et la pathologie liée à Alzheimer via l’inhibition de HMGB1. J Mol Neurosci. (2017) 63:385-95. doi : 10.1007/s12031-017-0989-7
PubMed Abstract | CrossRef Full Text | Google Scholar
40. Lai S, Wu G, Jiang Z. Le traitement à la glycyrrhizine facilite l’extinction des réponses de peur conditionnée après une seule exposition prolongée au stress chez les rats. Cell Physiol Biochem. (2018) 45:2529-39. doi : 10.1159/000488271
PubMed Abstract | CrossRef Full Text | Google Scholar
41. Monteil V, Kwon H, Prado P, Hagelkruys A, Wimmer RA, Stahl M, et al. Inhibition des infections SARS-CoV-2 dans les tissus humains fabriqués en utilisant l’ACE2 humaine soluble de qualité clinique. Cell. (2020) 181:905-913.e7. doi : 10.1016/j.cell.2020.04.004
PubMed Abstract | CrossRef Full Text | Google Scholar
42. Epelman S, Tang WH, Chen SY, Van Lente F, Francis GS, Sen S. Détection de l’enzyme soluble de conversion de l’angiotensine 2 dans l’insuffisance cardiaque : aperçu de la voie de contre-régulation endogène du système rénine-angiotensine-aldostérone. J Am Coll Cardiol. (2008) 52:750-4. doi : 10.1016/j.jacc.2008.02.088
PubMed Abstract | CrossRef Full Text | Google Scholar
.
Leave a Reply