26.13 : Comment fonctionnent les enzymes ? Citrate synthase
Oxaloacétate en citrate catalysé par la citrate synthase
La citrate synthase est une protéine de 433 acides aminés avec divers groupes fonctionnels qui peuvent réagir avec des substrats. Cette enzyme catalyse l’oxaloacétate pour produire éventuellement du citrate dans le cadre du cycle de l’acide citrique (Krebs). Dans la première étape du cycle de l’acide citrique (Krebs), l’acétyl CoA se condense avec l’oxaloacétate pour former du (S)-citryl CoA. Le groupe carboxylate d’un acide aspartique (B 🙂 sur la citrate synthase élimine le proton alpha acide sur l’acétyl CoA, tandis qu’un site histidine (H-A) donne un proton pour former l’énol. Ensuite, un deuxième site histidine (H-A) protonise l’oxygène du carbonyle de l’oxaloacétate, tandis que le carbone du carbonyle est attaqué par l’énol. Simultanément, cette première histidine (:A-) déprotonise l’énol de l’acétyl CoA. Le (S)-citryl CoA est généré.
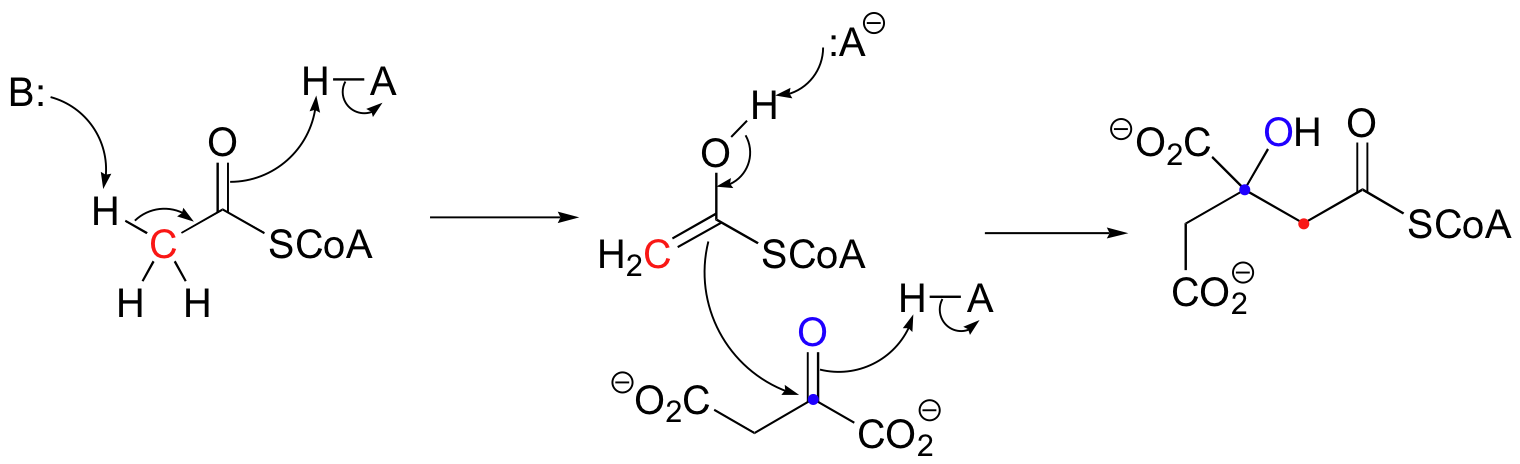
Le groupe acyle d’un thioester du (S)-citryl CoA peut être transféré à une molécule d’eau dans une réaction d’hydrolyse pour convertir le (S)-citryl CoA en citrate. Là encore, les sites d’histidine sur la citrate synthase font partie intégrante du mécanisme et aident à l’élimination et à l’addition des protons.
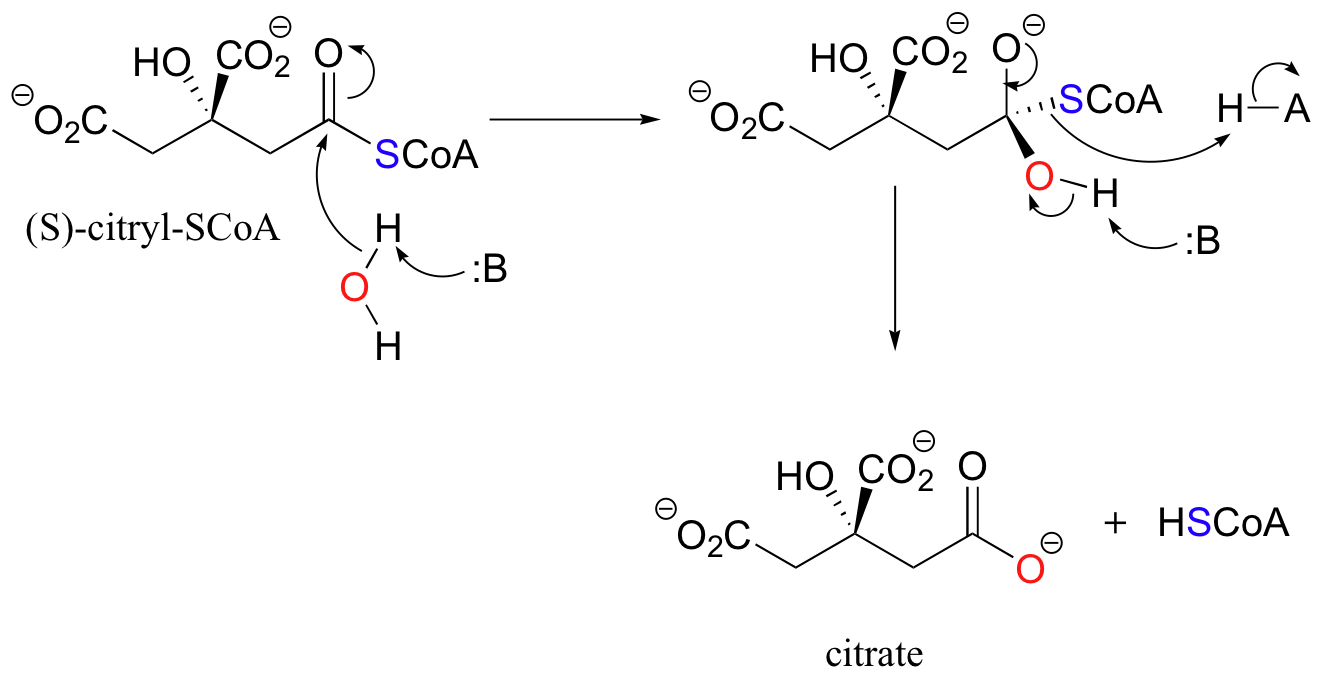
.
Leave a Reply