Kræftkacheksi
One Page Owner – Anthonia Abraham som en del af One Page Project
Definition
Cancer cachexia eller kræftrelateret træthed er defineret som et multifaktorielt syndrom, der er karakteriseret ved et vedvarende tab af skeletmuskelmasse (med eller uden tab af fedtmasse), som ikke kan vendes fuldt ud ved konventionel ernæringsmæssig støtte og fører til progressiv funktionel svækkelse.
Det karakteristiske træk er den negative protein-energibalance, der opstår på grund af nedsat fødeindtagelse og en abnorm metabolisme.
Klassifikation
Der er 3 stadier af klinisk relevans, der danner et spektrum, men ikke alle disse personer gennemløber hele spektret.
- Præcachecia: De tidlige kliniske tegn som anoreksi og metaboliske tegn som nedsat glukosetest går forud for vægttabet (≤5%). Progressionen varierer og afhænger af kræfttype og stadieinddeling, lavt fødeindtag, eventuel systemisk inflammation, dårlig respons på anti-cancerbehandling.
- Kacheksi: Et stabilt vægttab på mere end 5 % i løbet af 6 måneder ELLER et Body mass index (BMI) på mindre end 20 kg/m² ELLER sacrcopeni og et løbende vægttab på mere end 2 %, men som endnu ikke er gået ind i det refraktære stadium, der klassificeres som kacheksi.
- Refraktær kacheksi: Meget fremskreden kræft ELLER hurtigt fremadskridende kræft, der ikke reagerer på kræftbehandling. Associeret med aktiv katabolisme, og de faktorer, der er forbundet med aktiv håndtering af vægttab, står her ikke længere til rådighed. Lav præstationsstatus og en forventet levetid på mindre end 3 måneder er karakteristiske.
Patofysiologi
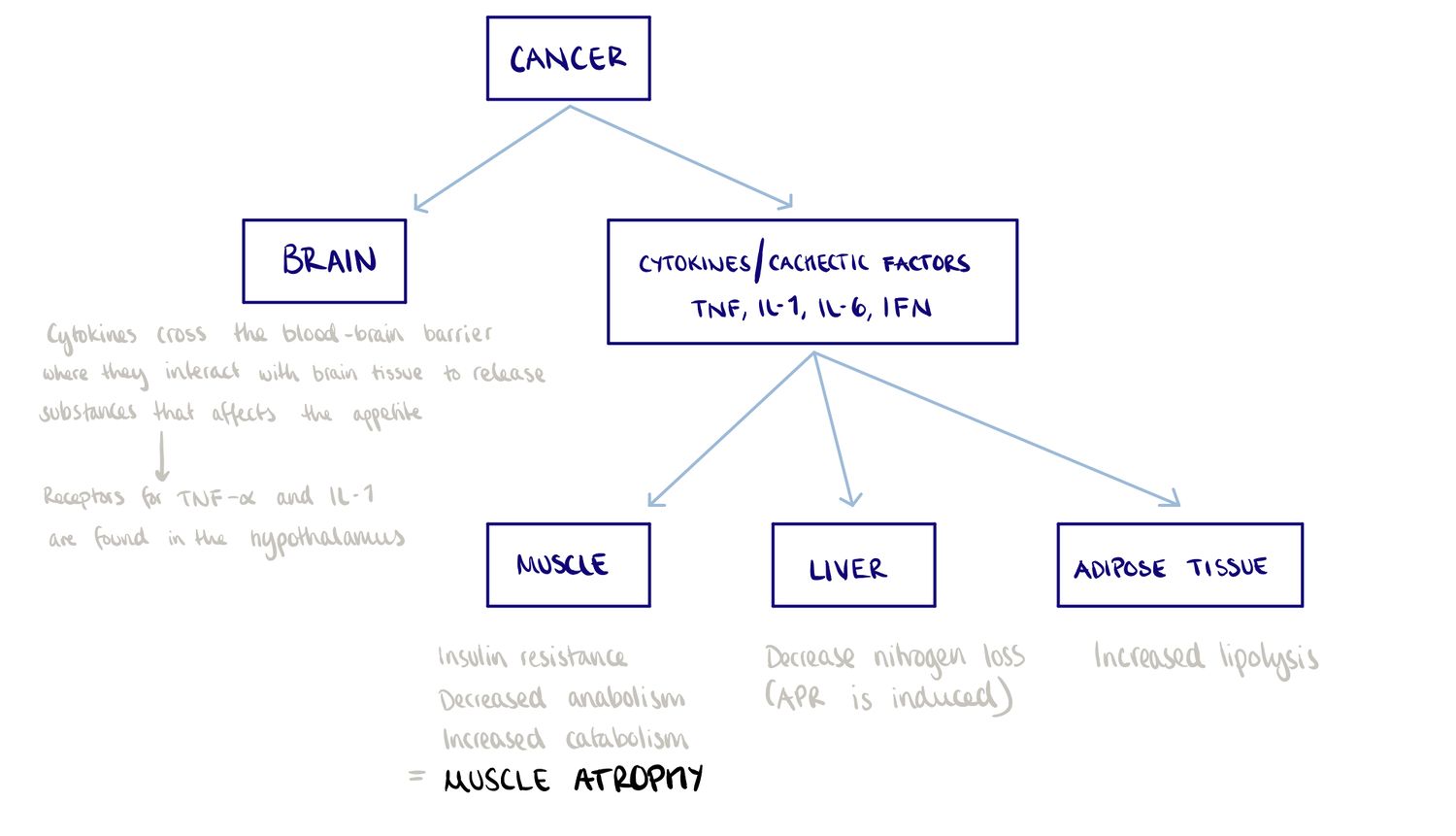
Diagnose af kræftkacheksi
- BMI <20 og enhver grad af vægttab >2%;
- Vægttab >5% i løbet af de seneste 6 måneder (i fravær af simpel sult)
- Appendiculært skeletmuskelindeks i overensstemmelse med sarkopeni (mænd <7-26 kg/m²; kvinder <5-45 kg/m²) og enhver grad af vægttab >2%
Vurdering
Muskelmasse og -styrke: Tværsnitsbillede CT eller MRI, røntgenbilleder med dobbelt energi, bioimpedansanalyse og antropometri, herunder primært omkredsen i midten af armen.
Anoreksi og nedsat fødeindtagelse:
Anoreksi og nedsat fødeindtagelse: Kvantificering af protein kan være relevant. Mekanismerne bag dette kan være kemosensoriske forstyrrelser, nedsat øvre gastrointestinal mobilitet, distal tractus dysmobilitet. De sekundære årsager omfatter stomatitis, consti
Behandling
Der er 4 grundlæggende trin i behandlingsstrategier:
- Korrektion af årsagen til den nedsatte ernæringsoptagelse
- Tilstrækkelig ernæringsmæssig støtte
- Multimodal intervention mod kræftkacheksi:
- Opsporing af eventuelle relaterede psykosociale lidelser og behandling af samme
Multimodale anabole interventioner er bedst i symptombehandling. Individualiseret ernæring og motion optimerer lægemiddelvirkningerne Rådgivning, herunder adfærdsændring, anticancer- eller antineoplastisk behandling, total parenteral ernæring, prokinetika, progestiner, cannabinoider, Eicosapentaensyre, Cyclo-oxygenasehæmmere, kortikosteroider og motionsinterventioner er behandlingerne.
Træningsinterventioner
Mekanismer
Træning kan øge muskelmassen, muskelfunktionen, styrken, den kardiovaskulære kondition og reducere træthed og dermed indirekte forbedre livskvaliteten ved at reducere træthedsniveauet. Der er flere foreslåede mekanismer for det samme. De omfatter:
Træning og inflammation
Akut træning fremkalder et immunrespons, som øger cytokinniveauet i kroppen, men disse cytokiner giver dog ikke den proinflammatoriske effekt. IL-6 er det typiske cytokin, der frigives og forventes i forhøjede niveauer, sammen med IL-10 og IL-1ra, Dette udløser et antiinflammatorisk respons, som spekuleres at reducere den systemiske inflammation på grund af kræft, og dermed dæmpe kacheksiprocessen. Lige fra koncentriske øvelser med moderat intensitet til excentriske øvelser med kraftig intensitet øger disse indgreb transkriptionen og udtrykker IL-6-proteinet, som er nødvendigt for muskelkontraktion.
Inflammation og træning i fedtvævet
Udholdenhedsøvelser blokerer virkningen af TNF-α, et inflammatorisk cytokin, der stimulerer lipolyse og støtter den inflammatoriske kaskade.
Træning og oxidativ stress
Træning øger de antioxidative enzymer såsom superoxiddismutase, glutathionperoxidase i skeletmuskulaturen og mitokondriel superoxiddismutase og katalase er i lungerne og diafragmaet. Også de ikke-enzymatiske antioxidantniveauer stiger i kroppen og beskytter dermed vævene mod skader.
Træning og insulinfølsomhed
Det er blevet spekuleret, at insulinresistens opstår som reaktion på tumorvækst og som den normale inflammatoriske reaktion. Motion reducerer TNF-α-faktoren og forbedrer dermed kroppens følsomhed over for insulin. Også glukosetransportproteiner som Glutathion-4 stiger i skeletmuskulaturen, hvilket øger glukosetransporten ind i musklen. Kreatininphosphat, der forhindrer glutathionets virkning, reduceres under træning.
Træning
- Højintensiv intervaltræning i 8 uger har en effekt på stadie III og stadie IV ikke-småcellet lungekræft hos patienter, der modtager kemoterapi. Disse patienter havde en høj risiko for respirationssvigt på grund af kræftkacheksi, og motionstræning bidrog til at forbedre deres lungekapacitet.
- Progressiv træning af modstandstræning (2-3 dage om ugen i 12 uger) forbedrede patienternes compliance og lean body mass med 1-2 Kgs. Effektiviteten er dog endnu ikke fastlagt i hoved- og halskræftgruppen, der modtager strålebehandling.
- Aerob træning er gavnlig i form af, at den øger den mitokondrielle biogenese og reducerer proteolysen ved at reducere inflammationen.
- Pedometerbaserede øvelser(7 uger) bidrager til at forbedre skeletmassen, funktionsevnen og livskvaliteten hos kræftkacheksi på kemoterapi.
- Modstandsøvelser hos patienter med prostatakræft, der modtager androgen deprivationsterapi og strålebehandling, forebygger tab af muskelmasse og styrke
- 1,0 1,1 Fearon K, Strasser F, Anker SD, Bosaeus I, Bruera E, Fainsinger RL, Jatoi A, Loprinzi C, MacDonald N, Mantovani G, Davis M. Definition and classification of cancer cachexia: an international consensus. Lancet Oncol. 2011 May 1;12(5):489-95.
- Blum D, Omlin A, Fearon K, Baracos V, Radbruch L, Kaasa S, Strasser F, European Palliative Care Research Collaborative. Udviklende klassifikationssystemer for kræftcachexia: klar til klinisk praksis? Support Care Cancer. 2010 Mar 1;18(3):273-9.
- Wallengren O, Lundholm K, Bosaeus I. Diagnostic criteria of cancer cachexia: relation to quality of life of life, exercise capacity and survival in unselected palliative care patients. Support Care Cancer. 2013 Jun 1;21(6):1569-77.
- 4.0 4.1 Blum D, Omlin A, Fearon K, Baracos V, Radbruch L, Kaasa S, Strasser F, European Palliative Care Research Collaborative. Udviklende klassifikationssystemer for kræftcachexia: klar til klinisk praksis? Support Care Cancer. 2010 Mar 1;18(3):273-9.
- 5.0 5.1 Anderson LJ, Albrecht ED, Garcia JM. Opdatering om håndtering af kræftrelateret kacheksi. Curr Oncol Rep. 2017 Jan 1;19(1):3.
- 6,0 6,1 Gould DW, Lahart I, Carmichael AR, Koutedakis Y, Metsios GS. Forebyggelse af kræftcachexia via fysisk træning: molekylære mekanismer. J Cachexia Sarcopenia Muscle. 2013 Jun;4(2):111-24.
- Gandhi A, Samuel SR, Kumar KV, Saxena PU, Mithra P. Effect of a Pedometer-based Exercise Program on Cancer Related Fatigue and Quality of Life among Patients with Breast Cancer Receiving Chemotherapy. Asian Pac J Cancer Prev. 2020 Jun 1;21(6):1813-8.
Leave a Reply