26.13: Wie arbeiten Enzyme? Citrat-Synthase
Oxaloacetat zu Citrat katalysiert durch Citrat-Synthase
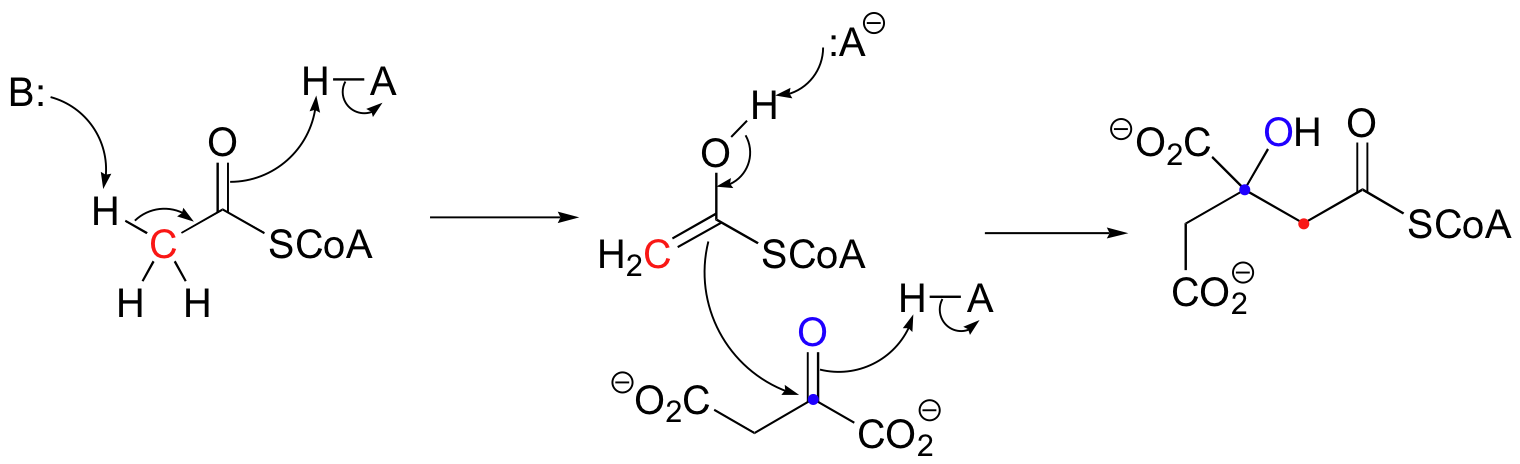
Citrat-Synthase ist ein Protein mit 433 Aminosäuren mit verschiedenen funktionellen Gruppen, die mit Substraten reagieren können. Dieses Enzym katalysiert Oxalacetat, um schließlich Citrat als Teil des Zitronensäurezyklus (Krebs) zu produzieren. Im ersten Schritt des Zitronensäure-(Krebs-)Zyklus kondensiert Acetyl-CoA mit Oxalacetat zu (S)-Citryl-CoA. Die Carboxylatgruppe einer Asparaginsäure (B:) auf der Citrat-Synthase entfernt das saure Alpha-Proton von Acetyl-CoA, während eine Histidin-Stelle (H-A) ein Proton zur Bildung des Enols abgibt. Dann protoniert eine zweite Histidinstelle (H-A) den Carbonylsauerstoff von Oxalacetat, während der Kohlenstoff des Carbonyls vom Enol angegriffen wird. Gleichzeitig deprotoniert das erste Histidin (:A-) das Acetyl-CoA-Enol. Es entsteht (S)-Citryl-CoA.
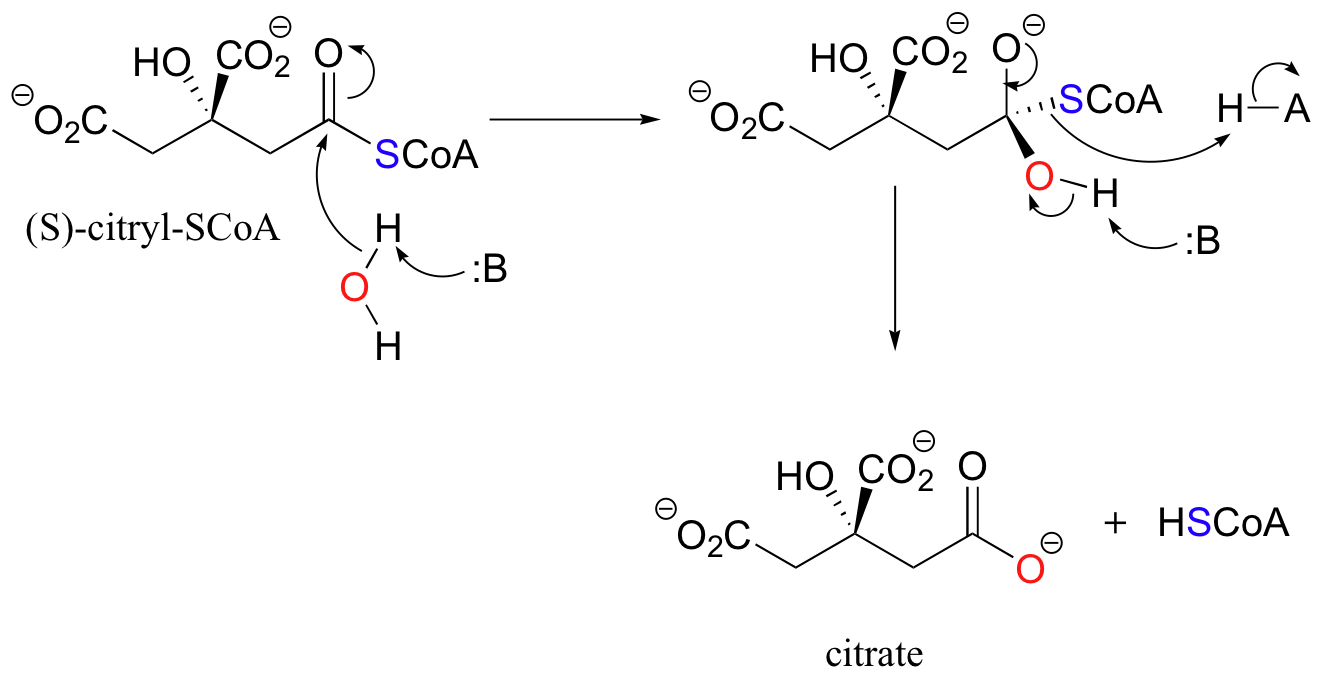
Die Acylgruppe eines Thioesters von (S)-Citryl-CoA kann in einer Hydrolysereaktion auf ein Wassermolekül übertragen werden, um (S)-Citryl-CoA in Citrat zu überführen. Auch hier sind Histidinstellen an der Citrat-Synthase ein integraler Bestandteil des Mechanismus und helfen bei der Entfernung und Zugabe von Protonen.
Leave a Reply