Was ist Elektronegativität?
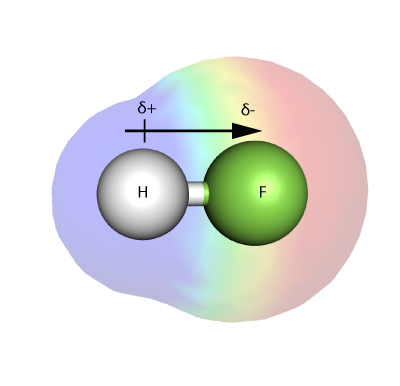
ELECTRONEGATIVITÄT
Die Elektronegativität ist ein Maß dafür, wie stark ein Atom – in einem Molekül – in der Lage ist, Elektronen in einer Bindung an sich zu ziehen.
Faktoren, die die Elektronegativität beeinflussen:
1) Die Ordnungszahl
Die Ordnungszahl ist die Anzahl der Protonen im Kern eines Atoms.
Sie bestimmt die chemischen Eigenschaften eines Elements und seinen Platz im Periodensystem.
Je höher die Ordnungszahl, desto stärker die Elektronegativität.
2) Der Atomradius
Der Atomradius eines chemischen Elements wird gewöhnlich durch den Abstand vom Zentrum des Kerns bis zur Grenze der äußersten Elektronenschicht gemessen.
Je größer der Atomradius, desto schwächer die Elektronegativität.
Beispiel für den Atomradius eines Sauerstoffatoms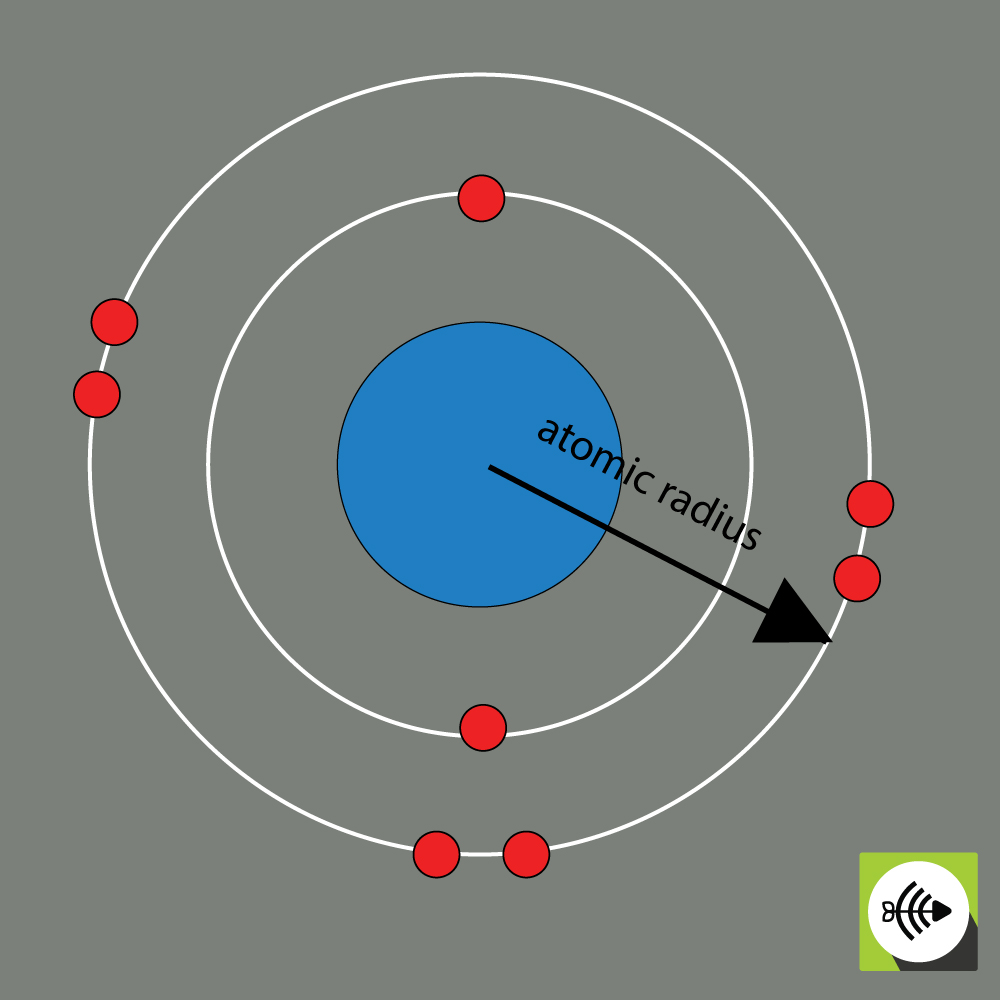
Woran wird die Elektronegativität gemessen?
Das gebräuchlichste Maß für die Elektronegativität ist die Pauling-Skala, die vom zweifachen Nobelpreisträger Linus Pauling entwickelt wurde. Die Elektronegativitätsskala für Elemente gibt an, wie stark jedes Element (im Verhältnis zu den anderen) die Bindungselektronen an sich binden kann. Je höher die Elektronegativitätszahl, desto mehr versucht das Atom, Elektronen an sich zu ziehen.
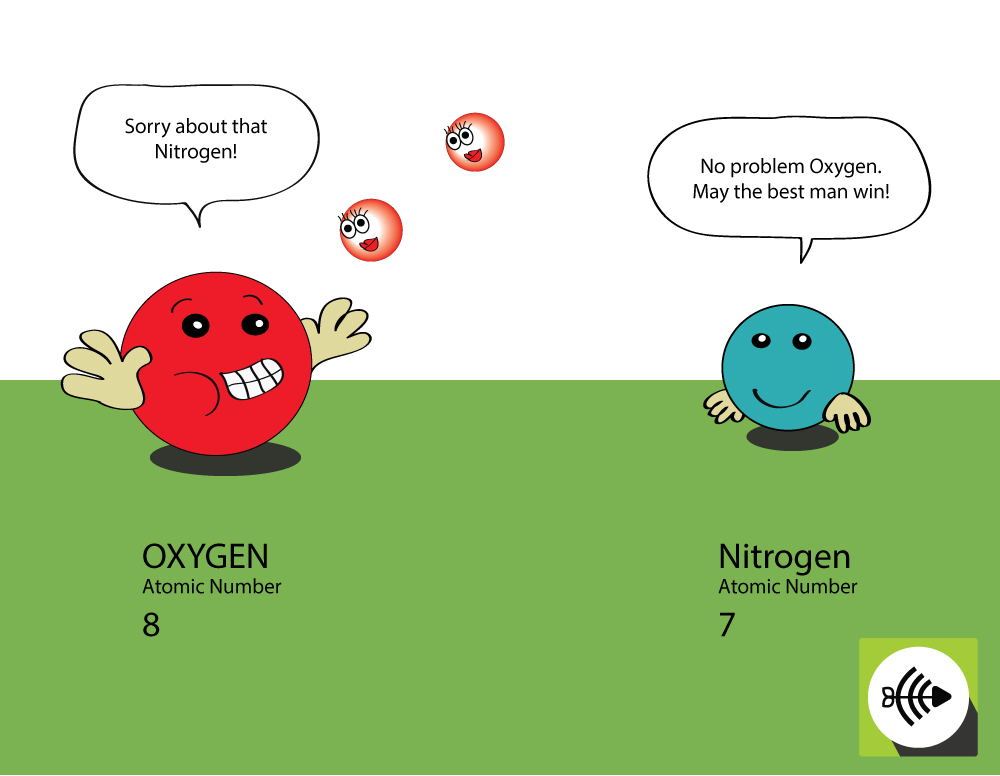
Warum ist Sauerstoff elektronegativer als Stickstoff?
Sauerstoff hat eine höhere Ordnungszahl
- Sauerstoff hat 8 Protonen im Kern, während Stickstoff nur 7 hat.
- Ein bindendes Elektronenpaar wird vom Sauerstoffkern stärker angezogen als vom Stickstoffkern, daher ist die Elektronegativität von Sauerstoff größer.
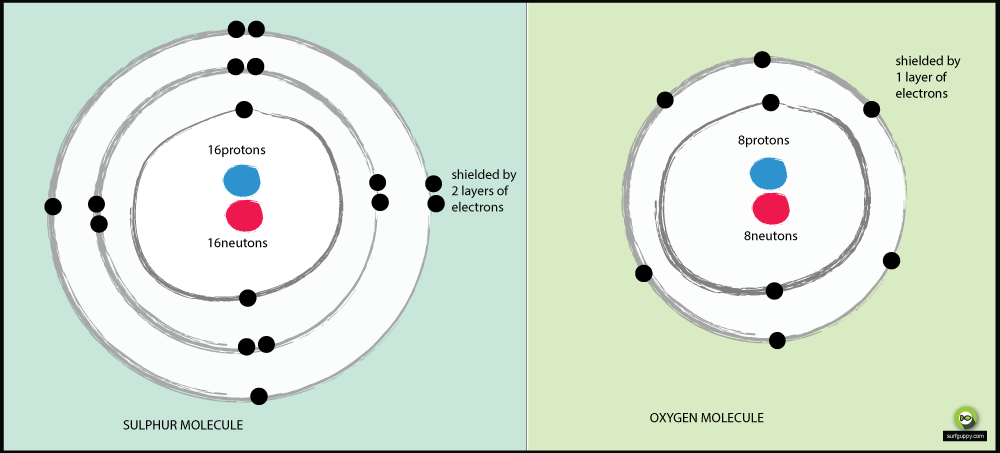
Warum ist Schwefel weniger elektronegativ als Sauerstoff?
Gründe, warum Sauerstoff elektronegativer ist als Schwefel:
- Sauerstoff hat 2 Energieniveaus, Schwefel hat 3
- Die Bindungselektronen in Schwefel sind weiter vom Atomkern entfernt
- Wenn Bindungselektronen weiter vom Atomkern entfernt sind, ist die Anziehungskraft des Atomkerns geringer
- Das Bindungselektronenpaar des Sauerstoffs erfährt eine stärkere Anziehungskraft des Atomkerns als die Bindungselektronen des Schwefels
- Daher ist Sauerstoff ein elektronegativeres Atom
Bitte informieren Sie sich über Valenzelektronen, bevor Sie fortfahren. Valenzelektronen

Das kleinere Atom hat eine höhere Elektronegativität
Elektronegativitätstendenzen im Periodensystem
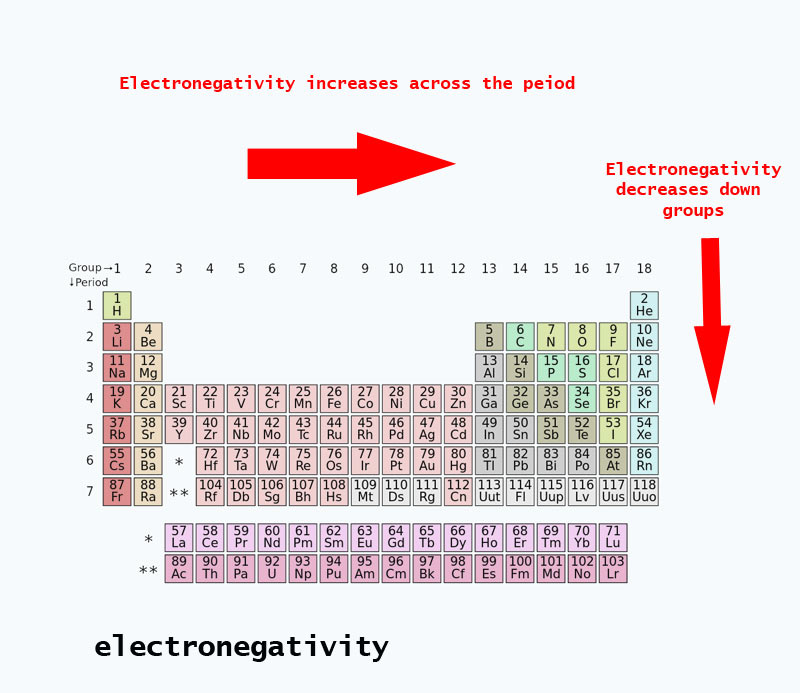
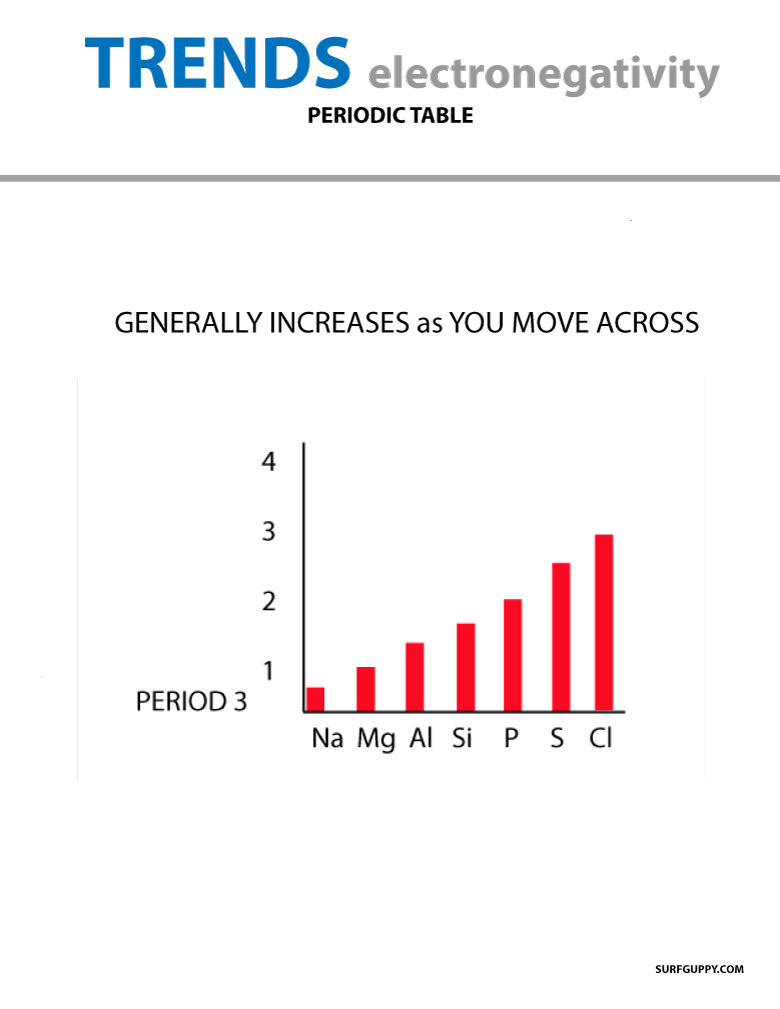
Wenn man sich im Periodensystem bewegt, nimmt die Anzahl der Protonen im Kern zu (ohne Erhöhung des Energieniveaus), daher steigt die Elektronegativität.
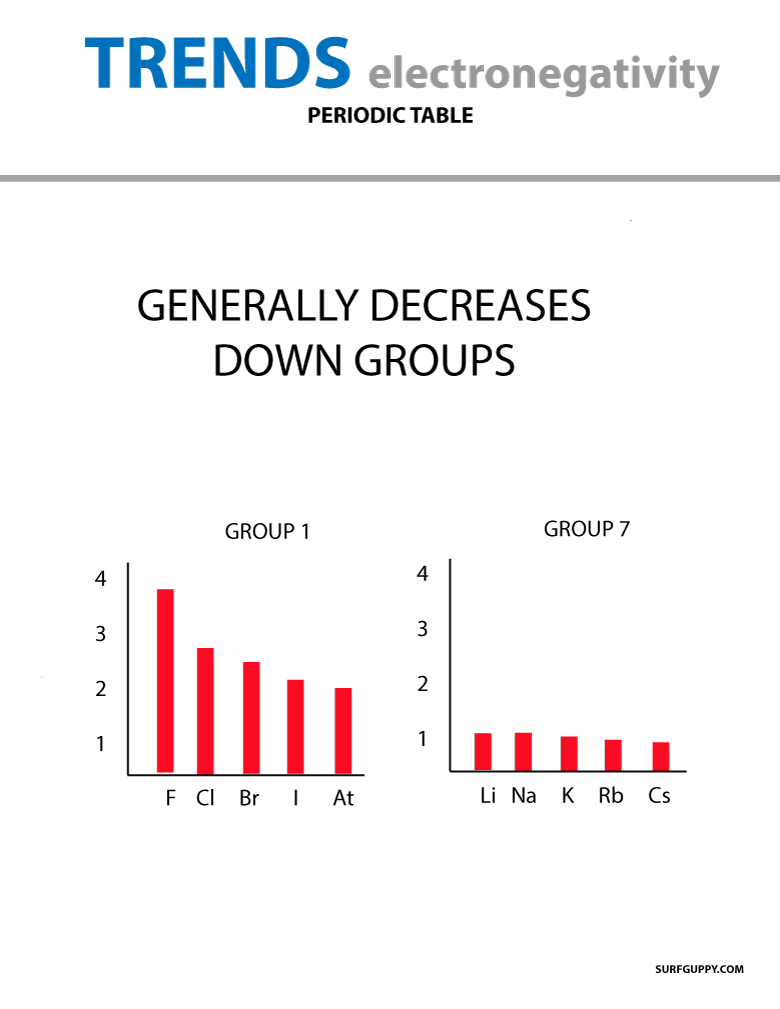
Wenn die Anzahl der Atome in einer Gruppe zunimmt, steigen auch die Energieniveaus. Der Atomradius ist größer, daher nimmt die Elektronegativität ab.
PERIODISCHE TABELLE DER ELEKTRONEGATIVITÄT
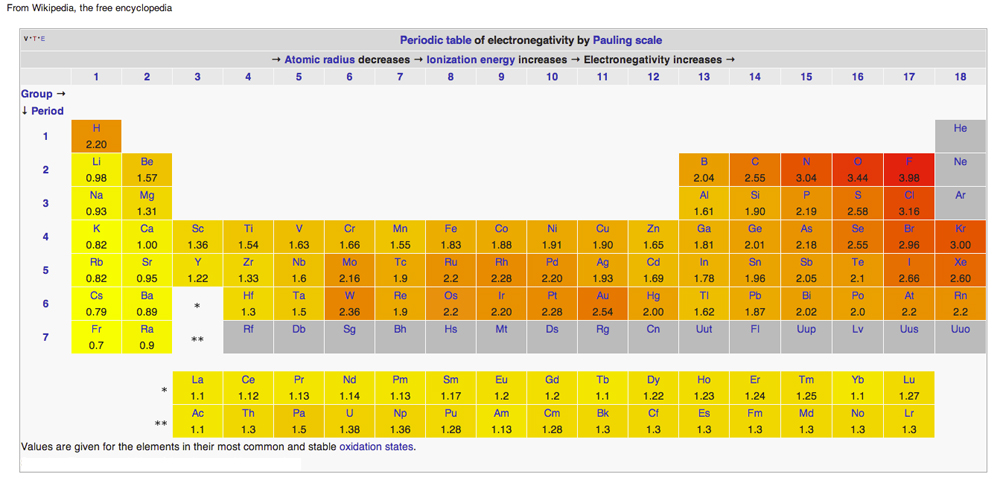 Diagramm aus Wikipedia, veröffentlicht unter Creative Common Licenses
Diagramm aus Wikipedia, veröffentlicht unter Creative Common Licenses
Leave a Reply