Warum hat #“HF „# einen niedrigeren Siedepunkt als Wasser, obwohl #“F „# elektronegativer ist als #“O „#?
Es gibt viele komplizierte Faktoren. Das ist, was ich finden konnte:
- Wasser kann ein ausgewogeneres Wasserstoffbindungsnetzwerk bilden (zwei Akzeptoren und zwei Donatoren, statt einem Donator und drei Akzeptoren), wodurch das Gesamtsystem gleichmäßiger wechselwirkt und somit als Ganzes stärker ist.
- Wasser bildet ein umfangreicheres Wasserstoffbindungsnetzwerk (eine dreidimensionale tetraedrische lokale Umgebung, statt einer zweidimensionalen Zickzack-Umgebung), wodurch das Gesamtsystem weniger leicht verdampfbar ist.
- Wasser hat im Allgemeinen einen optimaleren Wechselwirkungswinkel, da es besser mit der Elektronengeometrie des Moleküls übereinstimmt und die Wechselwirkungen entlang des Moleküldipols ausrichtet, während #“HF „# stärkere Wasserstoffbrückenbindungen (in Bezug auf die Rohzahlen) aufweisen würde, wenn die Wechselwirkungen linear wären.
DISCLAIMER: LANGE ANTWORT! Auch sehr anschaulich.
Die Wasserstoffbrückenbindung ist die stärkste zwischenmolekulare Kraft sowohl in #“HF „# als auch in #“H“_2 „O „#. Die Stärke der Wechselwirkung ist abhängig vom Wechselwirkungsabstand, dem Wechselwirkungswinkel und der Dehnbarkeit des Netzwerks.
Wenn wir alle Wasserstoffbrückenbindungen herausziehen und von reinem Wasser und reinem #“HF „# ausgehen, erhalten wir (durch Isolierung einer ausgewählten Gruppe von Molekülen aus einer unendlichen Matrix)#““^()##““^()#:
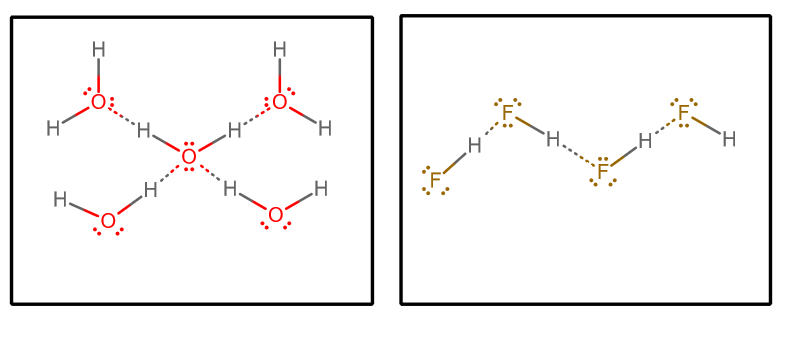
Wir könnten dann einige Faktoren berücksichtigen:
- Anzahl der Wasserstoffbrückenbindungs-Donatoren und -Akzeptoren
Jedes Wassermolekül kann zwei Wasserstoffbrückenbindungs-Wechselwirkungen akzeptieren (über die einsamen Paare) und zwei Wasserstoffbrückenbindungs-Wechselwirkungen spenden (über die Wasserstoffe).
Andererseits akzeptiert jedes #“HF „#-Molekül drei Wasserstoffbrückenbindungen (über die einsamen Paare) und gibt nur eine (über den Wasserstoff) ab.
Man könnte also argumentieren, dass Wasser ein ausgewogeneres Wasserstoffbrückenbindungsnetzwerk hat, wodurch das Gesamtsystem weniger verdampfen kann. Dies würde den höheren Siedepunkt von Wasser im Vergleich zu #“HF „# unterstützen.
- Elektronegativitäten von #bb(„F“)# und #bb(„O“)#
#“F „# ist elektronegativer, so dass es seine Elektronendichte leichter beibehält; daher wird erwartet, dass die einsamen Paare schwächere Spender von Wasserstoffbrückenbindungen sind als die einsamen Paare auf #“O „#.
Dies würde voraussagen, dass jede einzelne Wasserstoffbrückenwechselwirkung schwächer ist, was den höheren Siedepunkt von Wasser gegenüber #“HF „# unterstützen würde, ABER dies wird durch den folgenden Punkt widerlegt.
- Durchschnittliche rohe Wasserstoffbrückenbindungsstärken in #bb(„HF“)# vs. Wasser
#“O“-„H „cdotcdotcdot: „O“-#, #DeltaH_(„H“-„bond“) ~~ „21 kJ/mol „#
#“F“-„H „cdotcdotcdot: „F“-#, #DeltaH_(„H“-„bond“) ~~ „161.5 kJ/mol „#
Diese Daten aus Wikipedia legen nahe, dass #“HF „# zwischen den #“HF „#-Molekülen stärkere Wasserstoffbrückenbindungen aufweist als in Wasser.
Dies würde den experimentellen Beweis, dass #“HF „# einen viel niedrigeren Siedepunkt hat, nicht unterstützen, aber dies ist auch nur eine rohe Zahl und berücksichtigt z.B. nicht die Wechselwirkungswinkel im Massensystem.
- Beobachtete Wasserstoffbrückenbindungswinkel und Dimensionen der Wechselwirkung
#“HF „# hat als lineares Molekül zickzackförmige Wasserstoffbrückenbindungswechselwirkungen in zwei Dimensionen mit Winkeln von #116^@#. Ein optimalerer Winkel wäre #180^@#, da dies zu direkteren Dipolwechselwirkungen führen würde. Dies schränkt die Stärke der Wasserstoffbrückenbindungen von #“HF“
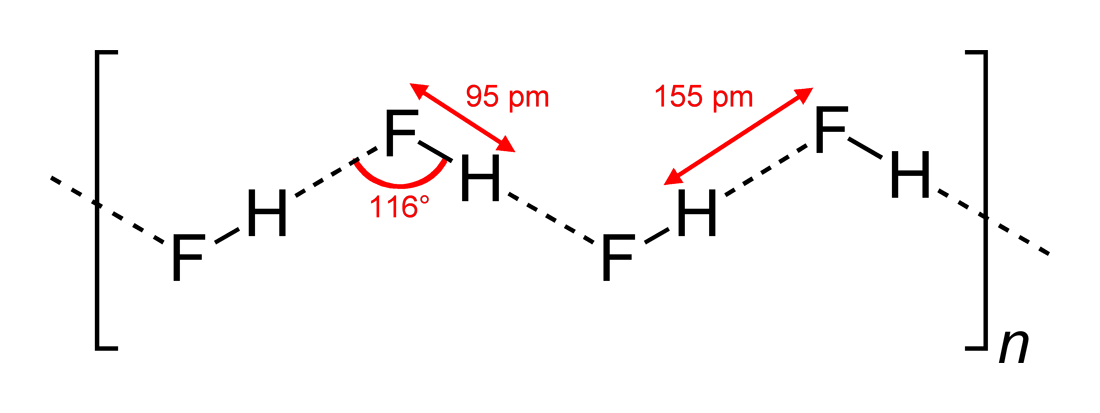
Wasser, das ein gebogenes Molekül mit tetraedrischer Elektronengeometrie ist, kann Wasserstoffbrückenbindungen in drei Dimensionen eingehen.
Hier ist ein Beispiel für den tetraedrischen Cluster, der in der lokalen Umgebung einer Wasserstoffbrückenbindungs-Wechselwirkung in Wasser zu finden ist:
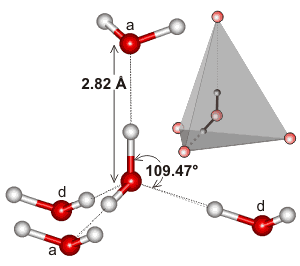
Es könnte sein, dass die Ausdehnung des Wasserstoffbrückenbindungs-Netzwerks und die Art und Weise, wie es dazu neigt, mit der Elektronengeometrie von Wasser übereinzustimmen, den Siedepunkt von Wasser so hoch macht. Dies würde den höheren Siedepunkt von Wasser gegenüber #“HF „# unterstützen.
Insgesamt sind dies die am wenigsten problematischen Faktoren, die mir einfallen:
- Wasser kann ein ausgewogeneres Wasserstoffbindungsnetzwerk bilden (zwei Akzeptoren und zwei Donatoren, statt einem Donator und drei Akzeptoren), wodurch das Gesamtsystem gleichmäßiger interagiert und somit insgesamt stärker ist.
- Wasser bildet ein ausgedehnteres Wasserstoffbrückenbindungsnetzwerk (eine dreidimensionale tetraedrische lokale Umgebung anstelle einer zweidimensionalen Zickzack-Umgebung), wodurch das Gesamtsystem weniger leicht verdampfbar ist.
- Wasser hat im Allgemeinen einen optimaleren Wechselwirkungswinkel, da es besser mit der Elektronengeometrie des Moleküls übereinstimmt und die Wechselwirkungen entlang des Moleküldipols ausrichtet, während #“HF „# stärkere Wasserstoffbrückenbindungen (in Bezug auf die Rohzahlen) aufweisen würde, wenn die Wechselwirkungen linear wären.
Leave a Reply