Varför har #”HF ”# en lägre kokpunkt än vatten trots att #”F ”# är mer elektronegativt än #”O ”#?
Det finns många komplicerade faktorer. Detta är vad jag kunde hitta:
- Vatten kan bilda ett mer balanserat vätebindningsnätverk (två acceptörer och två donatorer, i stället för en donator och tre acceptörer), vilket gör att bulksystemet interagerar mer jämnt och därmed är starkare som helhet.
- Vatten bildar ett mer omfattande vätebindningsnätverk (en tredimensionell tetraedrisk lokal miljö, i stället för en tvådimensionell zick-zack-miljö), vilket gör att bulksystemet blir svårare att förångas.
- Vatten har i allmänhet en mer optimal interaktionsvinkel, eftersom den bättre motsvarar molekylens elektrongeometri och anpassar interaktionerna längs den molekylära dipolen, medan #”HF ”# skulle ha starkare vätebindning (i termer av råa tal) om interaktionerna var linjära.
DISCLAIMER: LÅNGT SVAR! Också mycket visuellt.
Hydrogenbindning är den starkaste intermolekylära kraften i både #”HF ”# och #”H”_2 ”O ”#. Interaktionsstyrkan är beroende av interaktionsavståndet, interaktionsvinkeln och nätverkets extensivitet.
När vi drar ut alla vätebindningsinteraktioner och antar rent vatten och ren #”HF ”# får vi (genom att isolera en utvald uppsättning molekyler från en oändlig matris)#””^()##””^()#:
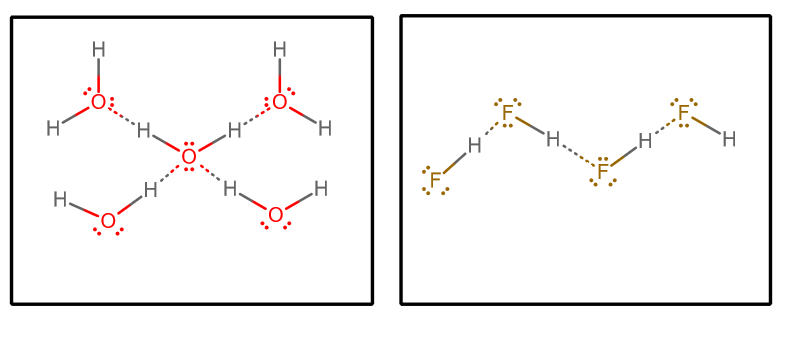
Vi kan då ta hänsyn till några faktorer:
- Antal givare och mottagare av vätebindningar
Varje vattenmolekyl kan ta emot två vätebindningsinteraktioner (via de ensamma paren) och avge två vätebindningsinteraktioner (via vätgaserna).
Å andra sidan kan varje #”HF ”#-molekyl acceptera tre vätebindningsinteraktioner (via de ensamma paren) och donera endast en (via väte).
Man skulle då kunna hävda att vatten har ett mer balanserat vätebindningsnätverk, vilket gör att bulksystemet totalt sett har sämre förmåga att förångas. Detta skulle stödja vattnets högre kokpunkt jämfört med #”HF ”#.
- Elektronegativitet för #bb(”F”)# och #bb(”O”)#
#”F ”# är mer elektronegativ, så den håller fast vid sin elektrontäthet lättare; därför förväntas de ensamma paren vara svagare givare av vätebindande växelverkan än de ensamma paren på #”O ”#.
Detta verkar förutsäga att varje enskild vätebindningsinteraktion är svagare, vilket skulle stödja vattnets högre kokpunkt jämfört med #”HF ”#, MEN detta motsägs av följande punkt.
- Genomsnittlig rå vätebindningsstyrka i #bb(”HF”)# vs. vatten
#”O”-”H ”cdotcdotcdot: ”O”-#, #DeltaH_(”H”-”bindning”) ~~ ”21 kJ/mol ”#
#”F”-”H ”cdotcdotcdot: ”F”-#, #DeltaH_(”H”-”bindning”) ~~ ”161.5 kJ/mol ”#
Denna data från Wikipedia tyder på att #”HF ”# har starkare vätebindningsinteraktioner mellan #”HF ”#-molekyler än i vatten.
Detta skulle inte stödja det experimentella beviset att #”HF ”# har en mycket lägre kokpunkt, men detta är också bara en rå siffra och tar inte hänsyn till t.ex. interaktionsvinklar i bulksystemet.
- Observerade vätebindningsvinklar och interaktionsdimensioner
#”HF ”#, som är en linjär molekyl, har setts ha zigzagformade vätebindningsinteraktioner, i två dimensioner, med vinklar på #116^@#. En mer optimal vinkel skulle vara 180^@##, eftersom det skulle ge mer direkta dipolinteraktioner. Detta begränsar vätebindningsstyrkan hos #”HF ”#.
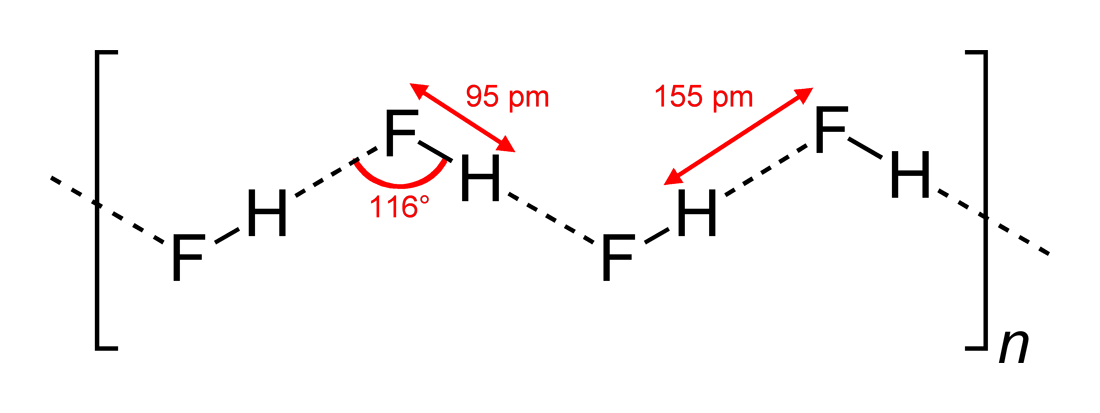
Vatten, som är en böjd molekyl med en tetraedrisk elektrongeometri, kan vätebindas i tre dimensioner.
Här är ett exempel på det tetraedriska kluster som finns i den lokala miljön för en vätebindningsinteraktion i vatten:
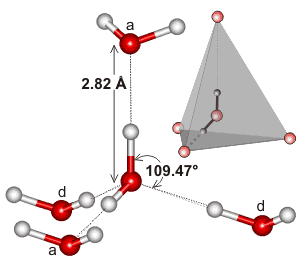
Det kan vara så att utsträckningen av vätebindningsnätverket, och hur det tenderar att matcha vattnets elektrongeometri, är det som gör vattnets kokpunkt så hög. Detta skulle stödja vattnets högre kokpunkt jämfört med #”HF ”#.
Samt sett är detta de minst utmanande faktorer jag kan tänka mig:
- Vatten kan göra ett mer balanserat vätebindningsnätverk (två acceptorer och två donatorer, istället för en donator och tre acceptorer), vilket gör att bulksystemet interagerar mer jämnt och därmed är starkare som helhet.
- Vatten bildar ett mer omfattande vätebindningsnätverk (en tredimensionell tetraedrisk lokal miljö, i stället för en tvådimensionell zigzag-miljö), vilket gör bulksystemet mindre lätt förångningsbart.
- Vatten har i allmänhet en mer optimal interaktionsvinkel, eftersom den bättre matchar molekylens elektrongeometri och anpassar interaktionerna längs den molekylära dipolen, medan #”HF ”# skulle ha starkare vätebindning (i termer av råa tal) om interaktionerna var linjära.
Leave a Reply