Vad är elektronegativitet?
Elektronegativitet
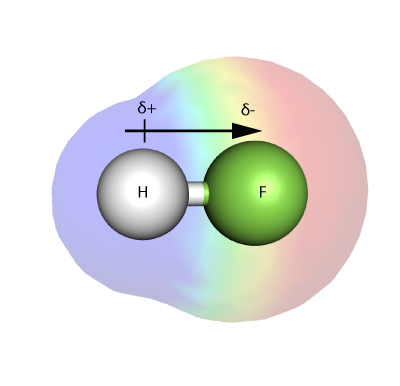
Elektronegativitet är ett mått på hur starkt en atom – i en molekyl – kan dra till sig elektroner i en bindning.
Faktorer som påverkar elektronegativiteten:
1) Atomnumret
Atomnumret är antalet protoner i en atoms kärna.
Det bestämmer de kemiska egenskaperna hos ett grundämne och dess plats i det periodiska systemet.
Desto högre atomnummer, desto starkare elektronegativitet.
2) Atomradien
Atomradien för ett kemiskt grundämne mäts vanligen som avståndet från atomkärnans centrum till gränsen för det yttersta skiktet av elektroner.
Desto större atomradier, desto svagare elektronegativitet.
Exempel på atomradie för en syreatom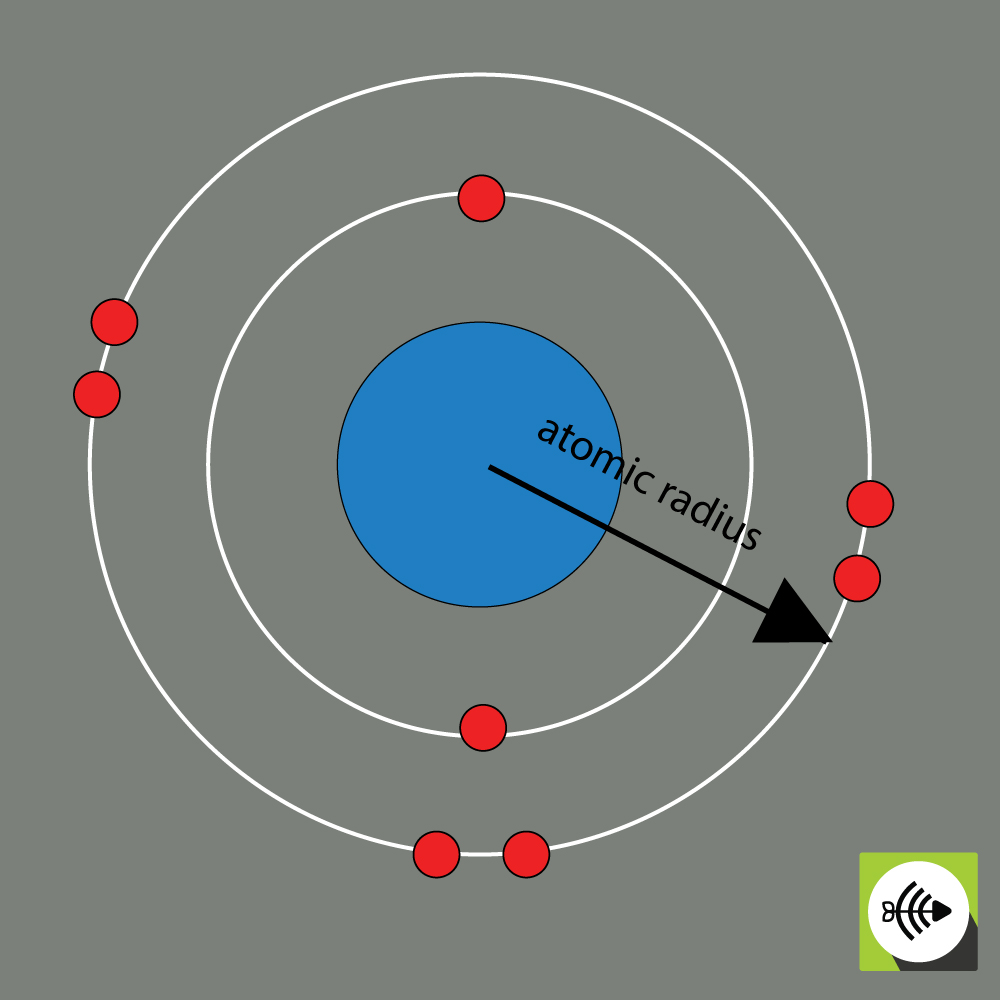
Vad mäts elektronegativitet i?
Det vanligaste måttet för elektronegativitet är Paulingskalan, som utformats av den dubbla Nobelpristagaren Linus Pauling. Elektronegativitetsskalan för grundämnen talar om hur starkt varje grundämne (i förhållande till varandra) kan dra till sig bindningselektroner. Ju högre elektronegativitetstal, desto mer försöker atomen dra till sig elektroner.
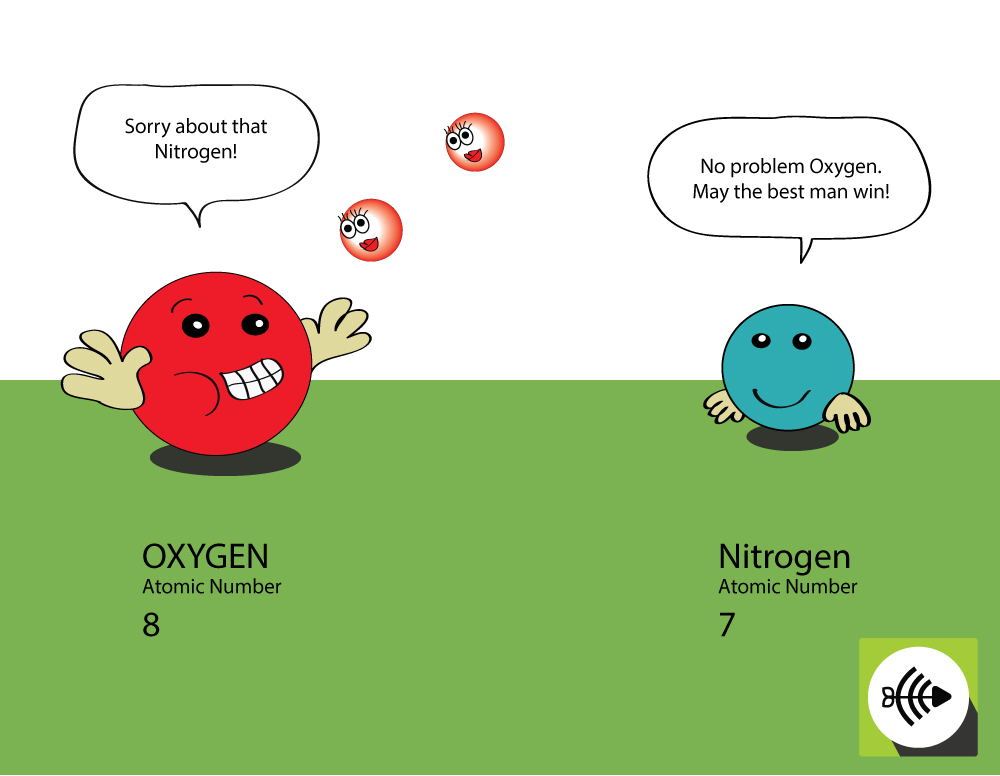
Varför är syre mer elektronegativt än kväve?
Syre är högre i atomnummer
- Syre har 8 protoner i kärnan medan kväve bara har 7.
- Ett bundet elektronpar kommer att uppleva större attraktion från syrets kärna än från kvävets, vilket gör att syrets elektronegativitet är större.
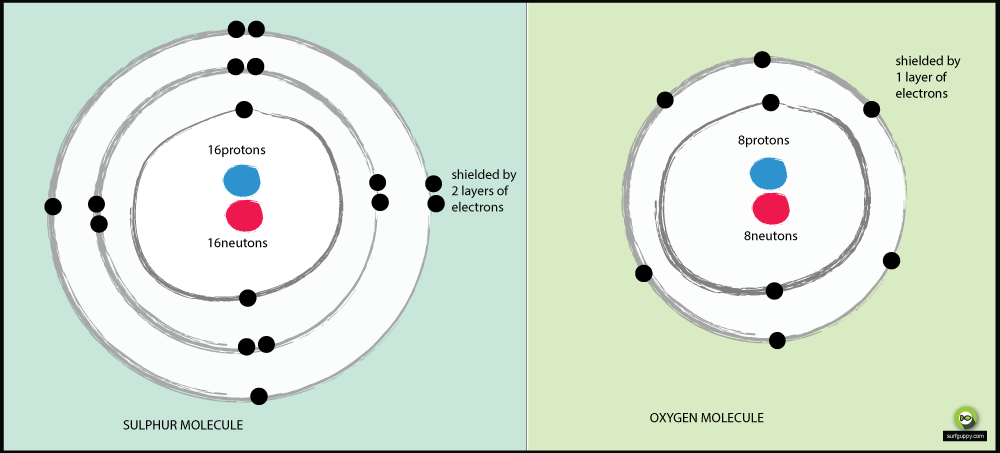
Varför är svavel mindre elektronegativt än syre?
Redogörelser till varför syre är mer elektronegativt än svavel:
- Oxygen har 2 energinivåer, svavel har 3
- Bindningselektronerna i svavel är längre bort från atomkärnan
- När bindningselektronerna är längre bort från atomkärnan, blir attraktionen från atomkärnan mindre
- Bindningselektronparet i syre kommer att uppleva mer attraktion från sin atomkärna än svavelns bindningselektroner
- Därmed är syre en mer elektronegativ atom
Läs gärna på om valenselektroner innan du fortsätter. Valenselektroner

Den mindre atomen har en högre elektronegativitet
Elektronegativitetstrender finns i det periodiska systemet
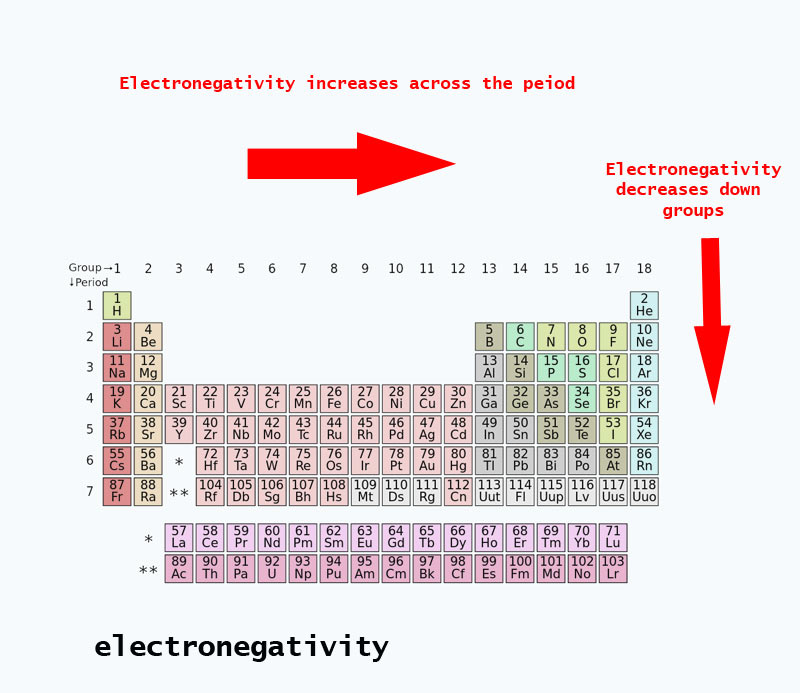
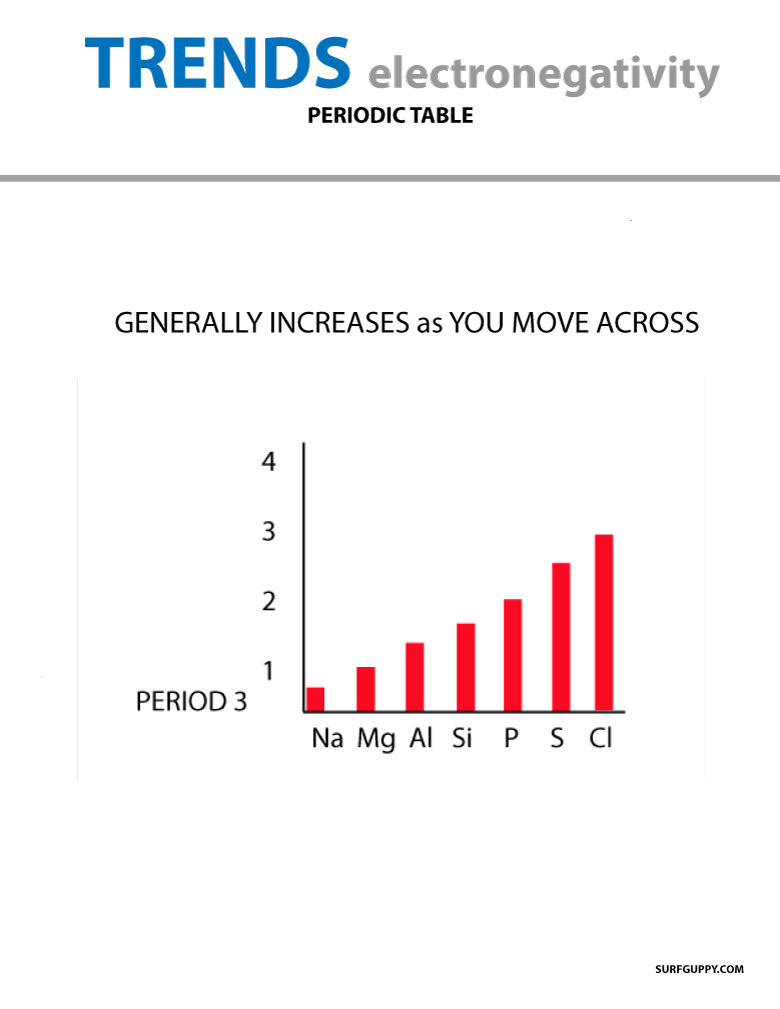
När man förflyttar sig över det periodiska systemet ökar antalet protoner i atomkärnan (utan att energinivån ökar), därför ökar elektronegativiteten.
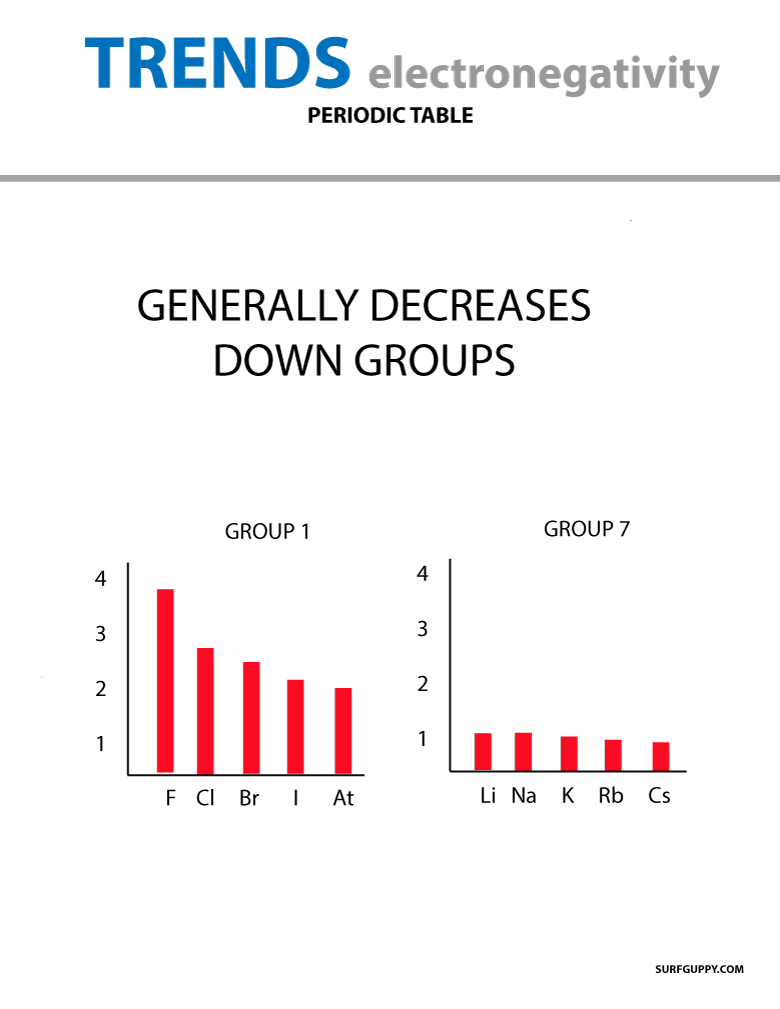
När atomnumret ökar nedåt i en grupp sker också en ökning av energinivåerna. Atomradien är större och därför minskar elektronegativiteten.
Elektronegativitet i det periodiska systemet
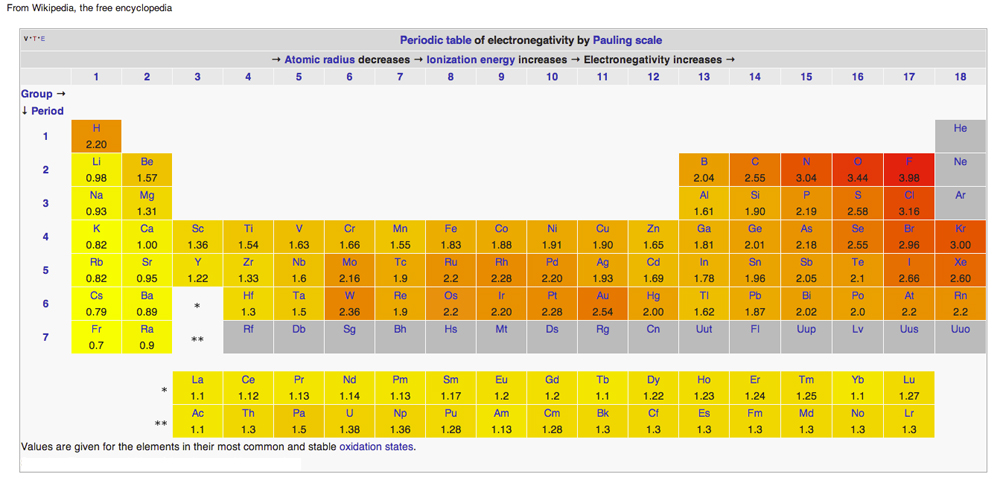 Diagram från Wikipedia utfärdat under Creative Common Licenses
Diagram från Wikipedia utfärdat under Creative Common Licenses
.
Leave a Reply