Frontiers in Pharmacology
Introduktion
Den vanligaste typen av demens, Alzheimers sjukdom (AD), åtföljs av kronisk försämring av den kognitiva funktionen och står för 60-70 % av demensfallen (Fan och Chiu, 2014; Lu et al., 2018). Enligt en översikt från 2014 lider cirka 35,6 miljoner människor av Alzheimers sjukdom för närvarande, och förekomsten av Alzheimers sjukdom ökar successivt med stigande ålder och drabbar cirka 115,4 miljoner människor år 2050 i hela världen (Fan och Chiu, 2014). Det är allmänt accepterat att Alzheimers sjukdom är en komplicerad neurodegenerativ sjukdom med flera olika patologier, som huvudsakligen är förknippade med degeneration av den kolinerga överföringen, oxidativ stress, neuroinflammation och så vidare (Coyle et al., 1983; Aucoin et al., 2005; Lin och Beal, 2006; Verri et al., 2012; Heneka et al., 2015; Bassani et al., 2017). Acetylkolinesterashämmare (AChE), såsom donepezil, rivastigmin och galanthamin, förskrivs företrädesvis för klinisk behandling av Alzheimers sjukdom i de tidiga stadierna (Kwon et al., 2010; Rijpma et al., 2014; Kumar och Singh, 2015). Dessutom används antioxidanter och antiinflammatoriska medel också proverbiskt i den adjuvanta behandlingen av AD (Zhou et al., 2016; Demirci et al., 2017). Alla dessa medel utövar dock begränsad effektivitet på grund av att de förlorar sin effekt gradvis när sjukdomen fortskrider, och medicinerna är också förknippade med många toxiska biverkningar (Zhou et al., 2016; Jeon et al., 2017; Lu et al., 2018). Det finns nämligen för närvarande ingen tillgänglig tillfredsställande behandling för att bota AD eller ändra dess progressiva förlopp.
Harmalin (HAL) och harmine (HAR) är de rikligt förekommande farmakologiska β-karbolinalkaloiderna från Peganum harmala L. med liknande kemiska strukturer (Li et al., 2017b). De har en betydande AChE, monoaminoxidas (MAO) och myeloperoxidas (MPO) hämmande aktiviteter, antioxidant, antiinflammatorisk, antitumör och antihypertensionseffekter, och kan också påverka innehållet av olika neurotransmittorer som sedan kan leda till biokemiska, fysiologiska och beteendemässiga förändringar hos djur och människor (Mahmoudian et al, 2002; Frison et al., 2008; Jiménez et al., 2008; Herraiz et al., 2010; Louis et al., 2010; Bensalem et al., 2014; Wang et al., 2015; Li et al., 2017a). Enligt våra tidigare studier visade HAL och HAR liknande AChE-hämning jämfört med galanthamin in vitro (Zhao et al., 2013). Dessutom uppvisade de totala alkaloiderna (28 mg/kg) från P. harmala som främst innehåller HAL och HAR en förbättrande effekt på de brister i inlärning och minne som inducerades av scopolamin och 30 % etanol (He et al., 2015b). Därefter bekräftade studien av He et al. (2015a) ytterligare att HAR (20 mg/kg) kunde förbättra försämrat minne hos scopolamininducerade möss genom att förbättra de kolinerga funktionerna genom att hämma AChE. Den senaste forskningen visade dock att HAR inte bara var ett substrat för multidrug resistance-associated protein isoform 2 (MRP2), utan också hade en svag metabolisk stabilitet, vilket i slutändan ledde till betydligt lägre biotillgänglighet än HAL hos olika djur (Li et al., 2017b). Således spekuleras det att den effektiva dosen av HAL mot AD kan vara mycket lägre än HAR. Därför bör en systematisk jämförelsestudie om de antiamnestiska effekterna och mekanismerna hos de två analogerna genomföras för att söka efter en föredragen kandidatförening för AD-behandling.
I den aktuella studien jämfördes de modulerande effekterna av HAL och HAR på de scopolamininducerade minnesförsämringarna med hjälp av den beteendemässiga bedömningen i Morris vattenlabyrint (MWM). MWM har använts flitigt vid studier av neurobiologi och neurofarmakologi för rumslig inlärning och minne, och som spelar en viktig roll vid valideringen av gnagarmodeller för neurokognitiva störningar såsom Alzheimers sjukdom (Bromley-Brits et al., 2011). Dessutom utfördes biokemiska analyser, Western Blotting och immunofluorescensanalyser för att klargöra de möjliga effekterna av HAL och HAR på vissa underliggande mekanismer som är involverade i AD-progressioner. Resultaten av denna studie kommer att vara till nytta för att utvärdera de antiamnestiska effekterna av β-karbolinalkaloider i ytterligare forskning och utveckling, och skulle kunna ge värdefull information för klinisk behandling av AD.
Material och metoder
Material
Harmalin, HAR, L-tryptofan (L-Trp), 5-hydroxytryptamin (5-HT), 5-hydroxyindol-3-ättiksyra (5-HIAA), acetylkolinklorid (ACh), kolinklorid (Ch), γ-aminosmörsyra (γ-GABA), L-glutaminsyra mononatriumsalt monohydrat (L-Glu), L-fenylalanin (L-Phe), L-tyrosin (L-Tyr), teofyllin och alla andra kemikalier som användes köptes från Sigma-Aldrich, Co., Ltd. (St. Louis, MO, Förenta staterna). Skopolaminhydrobromid och donepezilhydrokloridmonohydrat köptes från TCI (Shanghai) Development, Co., Ltd. (Shanghai, Kina). Karboximetylcellulosanatrium (CMC-Na) och NaCl erhölls från Meilunbio® Biotech, Co., Ltd. (nedan kallat ”Meilunbio® Biotech”). (Dalian, Kina). Färgämnet titandioxid köptes från Shanghai Dyestuffs Research Institute, Co., Ltd. (Shanghai). (Shanghai, Kina). BCA-proteinkvantifieringskit, RIPA-lysisbuffert, bovint serumalbumin (BSA), PBST (10X), 30 % akrylamid, 10 % SDS, glycin, provladdningsbuffert (4X) och TEMED köptes från YEASEN Biotechnology, Co., Ltd. (Shanghai, Kina). Fosfolipashämmare och proteashämmare köptes från Roche Applied Science (Foster City, CA, USA). PVDF-membran och ImmobilonTM Western kemiluminiscent HRP-substrat köptes från Millipore (Billerica, MA, USA). Kanin anti-AChE, kanin anti-kolinacetyltransferas (ChAT), kanin anti-MPO och anti-glyceraldehyd-3-fosfatdehydrogenas (GAPDH), HRP-konjugerade antikroppar mot kanin-IgG och markör köptes från Abcam Technology (Cambridge, MA, USA). Acetonitril, metanol och myrsyra av HPLC-kvalitet köptes från Fisher Scientific, Co. (Santa Clara, CA, Förenta staterna). Avjoniserat vatten (>18 mΩ) renades med Milli-Q Academic System (Millipore, Corp., Billerica, MA, USA). Alla andra kemikalier var av analytisk kvalitet.
Djur
Etthundraåtta manliga C57BL/6-möss (10 veckor gamla) erhölls från Drug Safety Evaluation and Research Center of Shanghai University of Traditional Chinese Medicine. Mössen föddes upp i ett välbelyst rum med luftkonditionering (25 ± 1 °C) under standardmiljöförhållanden (relativ luftfuktighet: 60-65 %, 12 timmars ljus-mörkercykler: ljuset på från 7:00 till 19:00) och gavs fri tillgång till gnagarfoder och kranvatten. Alla djuranvändningsförfaranden var förenliga med de bestämmelser för djurförsök som utfärdades av Kinas statliga kommitté för vetenskap och teknik den 14 november 1988 och som godkänts av den etiska kommittén för försöksdjur vid Shanghais universitet för traditionell kinesisk medicin (nr. SUTCM-2011-1107; Godkännandedatum: 10 november 2011).
Läkemedelsadministration
Baserat på skillnaden i biotillgänglighet mellan HAL och HAR fastställdes doserna till 2, 5 och 10 mg/kg för HAL och 10, 20 och 30 mg/kg för HAR (Zhang, 2013; Shi et al, 2014). Etthundraåtta möss delades slumpmässigt in i nio grupper (12 möss per grupp), nämligen kontrollgrupp (vehikel, 0,5 % CMC-Na), scopolamingrupp (1 mg/kg), donepezilgrupp (positiv kontroll, 5 mg/kg), HAL-grupper (2, 5 och 10 mg/kg, dvs. låg: L, medel: M, och hög: H-dosering), och HAR-grupper (10, 20 och 30 mg/kg, dvs. L, M och H-dosering). Som framgår av figur 1 administrerades kontrollgruppen och scopolamingruppen före MWM-testet oralt med 0,5 % CMC-Na-lösning, och HAL-grupperna (L, M och H-doseringarna), HAR-grupperna (L, M och H-doseringarna) och donepezilgruppen (5 mg/kg) administrerades genom gavage under sju på varandra följande dagar. Från dag 8 till dag 16 injicerades scopolamin (1 mg/kg) intraperitonealt (i.p.) i alla grupper utom kontrollgruppen som fick normal koksaltlösning 30 minuter efter de olika behandlingarna. Därefter utfördes beteendetesterna dagligen 30 minuter efter i.p.-injektion av skopolamin eller normal saltlösning.
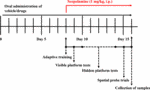
FIGUR 1. Tidsschema för försöks- och behandlingsupplägg för möss.
Behavioral Assessment in Morris Water Maze
MWM-testet tillämpades för att utvärdera effekterna av HAL och HAR på mössens rumsliga inlärning och minne enligt vad som tidigare beskrivits av Richard Morris 1982 med smärre modifieringar (Morris et al, 1982; He et al., 2015a; Singh et al., 2016).
MWM-utrustningen bestod av en vit cirkulär vattentank (diameter: 120 cm och höjd: 50 cm) omgiven av olika visuella ledtrådar (stjärna, fyrkant, rektangel och cirkel etc.) på pelarna i fasta positioner under hela försöket. Tanken blektes genom tillsats av giftfritt färgämne, sammansatt titandioxid, vid 22 ± 2 °C så att plattformen var osynlig under vattenytan. Tanken var praktiskt taget uppdelad i fyra lika stora kvadranter, däribland sydost, nordost, sydväst och nordväst. En vit plattform (diameter: 10 cm och höjd: 25 cm) var centrerad i den sydvästra kvadranten (Jeon et al., 2017; Kouémou et al., 2017; Lu et al., 2018). Hela försöksförfarandet bestod av adaptiv träning (1 dag, en gång om dagen), test med synlig plattform (1 dag, fyra försök om dagen), test med dold plattform (5 dagar, fyra försök om dagen) och försök med rumslig sond (24 timmar efter det sista testet med dold plattform, en gång om dagen).
För den adaptiva träningen (1 dag, en gång om dagen), den första dagen av MWM-testet (dag 8 av läkemedelsbehandlingarna), placerades varje mus inne i vattentanken för att simma i 60 s för att få en acklimatiseringssession. Nästa dag (dag 9 av läkemedelsbehandlingarna), för att undersöka mössens visuella, sensoriska och motoriska förmåga, placerades den synliga plattformen 1 cm ovanför vattenytan och varje mus fick hitta plattformen på 60 s. Testet (1 dag, fyra försök per dag) utfördes före försöket med den dolda plattformen för att sortera ut de kvalificerade mössen. Därefter sänktes plattformen ned 1 cm under vattenytan vid försök med dold plattform (5 dagar, fyra försök per dag, dag 10-14 av läkemedelsbehandlingarna). Simaktiviteten registrerades av en videokamera över huvudet och analyserades via ett datoriserat spårnings- och bildanalyssystem (RD1101-MWM-G, Shanghai Mobile Datum Information Technology Company, Shanghai, Kina). Mössen släpptes in i bassängen med huvudet vänd mot bassängväggen från en av fyra kvadranter successivt (nordost, nord, öst och sydost) och fick hitta plattformen på 60 s. Om musen inte lyckades hitta plattformen skulle den försiktigt ledas av den särskilda experimenten och få stanna kvar i 15 s på plattformen. Efter varje försök togs varje mus till sin bur och fick torka under en värmare. Flyktlatency och flykthastighet registrerades för varje försök. I försök med rymdsondering (dag 15 av läkemedelsbehandlingarna) avlägsnades plattformen från bassängen. Varje mus placerades i vattentanken från den kvadrant (till exempel nordväst) som var motsatt den tidigare plattformens placering (målkvadranten) för att få 60 s minnesbevaringstest (Lee et al., 2016; Liu et al., 2017; Malik et al., 2017). Tiden i målkvadranten och antalet korsningar registrerades.
Insamling av hjärnvävnader
Den 16:e dagen efter läkemedelsbehandlingarna sövdes alla möss och plasma samlades in genom oftalmectomi, och sedan samlades hjärnvävnader in efter halshuggning. I varje grupp användes hjärnorna från en delmängd djur för immunofluorescensanalys och de övriga för biokemisk analys och western blotting-analys. Efter avlivning skildes hjärnvävnaderna omedelbart, sköljdes med normal koksaltlösning, fläckades av ytvattenfukt med filterpapper och vägdes. Cortex och hippocampus i varje hjärna delades upp i två delar (vänster respektive höger) på is. Några av dem fixerades med 4 % paraformaldehyd för immunofluorescensanalys, och de andra frystes omedelbart med flytande kväve och förvarades sedan vid -80 °C fram till analysen.
Biokemisk analys
Cortex och hippocampus homogeniserades i iskall 0.1 M fosfatbuffert (pH 7,4), och de 10 % (w/v) homogenaten centrifugerades vid 4°C vid 12 000 rpm i 10 minuter, och supernatanterna separerades och förvarades sedan vid -80°C för biokemisk uppskattning (Malik et al, 2017). Nivåerna av AChE, ChAT, superoxiddismutas (SOD), glutationsperoxidas (GSH-px), maleinsyradiadehyd (MDA), MPO, tumörnekrosfaktor α (TNF-α), interleukin 1β (IL-1β), interleukin 6 (IL-6), interleukin 10 (IL-10), och kväveoxid (NO) i hjärnbarken och/eller hippocampushomogenaten bestämdes genom ELISA med hjälp av kommersiellt tillgängliga testkit (Jiancheng, Nanjing, Kina) enligt tillverkarens protokoll. Nivåerna av ovanstående biokemiska faktorer i hjärnbarken och hippocampus normaliserades särskilt med hjälp av proteinkoncentrationen i varje prov. Analyserna utfördes i två exemplar.
Western Blotting-analys
Cortex och hippocampus homogeniserades i iskall 50 mM Tris-HCl-buffert (pH 7,4) som innehöll fosfatashämmare och proteashämmare. Efter centrifugering (12 000 rpm) i 10 minuter vid 4 °C bestämdes det totala proteininnehållet med hjälp av BCA protein assay kit. Proteinproverna blandades med en fjärdedels volym laddningsbuffert och värmdes sedan i 5 minuter vid 100 °C. 20 μg protein av varje prov elektroforeserades genom ett 8 % SDS-PAGE och överfördes till PVDF-membran. Därefter blockerades membranet i 1 timme med 5 % fettfri mjölk i rumstemperatur och inkuberades med anti-GAPDH (1:5000), anti-AChE (1:1000), anti-ChAT (1:1000) och anti-MPO (1:1000) vid 4 °C över natten. Därefter sköljdes membranen noggrant med PBST och inkuberades sedan med HRP-konjugerad sekundär antikropp mot kanin (1:5000) i 2 timmar i rumstemperatur. Efter fullständig tvättning med PBST visualiserades proteinbanden med ECL prime kit.
Immunofluorescensanalys
Myeloperoxidasgenerering visualiserades genom immunofluorescensmikroskopi som tidigare beskrivits med smärre ändringar (Gray et al., 2008). Efter fixering i 4 % paraformaldehyd skars kortikalerna i 5 μm tjocka sagittala sektioner och deparaffiniserades och bearbetades för immunofluorescensanalys. Hjärnsektionerna placerades i en lösning av citronsyra (pH 6,0) för antigenreparation i en mikrovågsugn. Därefter utfördes autofluorescensdämpningen i 5 minuter. Efter blockering i 2 % BSA provades sektionerna med anti-MPO (1:100) över natten vid 4 °C. Därefter tvättades sektionerna med PBS (pH 7,4) tre gånger och inkuberades med HRP-konjugerad sekundär antikropp mot rabbit (1:300) i 30 minuter i rumstemperatur. Därefter användes 4′,6-diamidino-2-phenylindol (DAPI) för DNA-motfärgning och hjärnsektionerna observerades i ett fluorescensmikroskop (Nikon ECLIPSE C1, Japan), och bilderna togs i enlighet med detta. Här mättes fluorescensen av DAPI eller MPO vid en excitationsvåglängd på 330-380 eller 510-560 nm och en emissionsvåglängd på 420 respektive 590 nm.
Effekter av HAL och HAR på neurotransmittorerna
Extraktionsförfarande
En snabb, pålitlig och bekväm utfällningsmetod tillämpades för att bereda hjärnbarkens homogenat och plasmaprover. Ett 100 μL prov tillsattes med 200 μL iskall acetonitril innehållande 60 ng/mL IS i ett 1,5 mL centrifugeringsrör och vortexblandades i 1 min. Blandningen centrifugerades sedan vid 12 000 rpm i 10 minuter (4 °C). En alikvot på 5 μL av supernatanten från varje prov injicerades i ultrapresterande vätskekromatografi i kombination med elektrosprayjonisering (ESI) quadrupol-tandem-masspektrometri (UPLC-ESI-MS/MS) för kvantitativ analys.
UPLC-ESI-MS/MS-analys
Koncentrationerna av olika neurotransmittorer kvantifierades samtidigt med SHIMADZU LC-30AD UPLC-systemet (Shimadzu, Kyoto, Japan) som var anslutet till en AB Sciex QTRAP® 6500 trippelkvadrupol-masspektrometer (SCIEX, Förenta staterna) som var utrustad med en ESI-källa som använde positivt jondetekteringsläge för övervakning av flera reaktioner. Den kromatografiska separationen utfördes med hjälp av en ZIC-cHILIC-kolonn (150 mm × 2,1 mm, 3 μm, Merck-Sequant, Tyskland) med en SeQuant ZIC-cHILIC-vakkolonn (20 mm × 2,1 mm, 5 μm, Merck-Sequant, Tyskland). Den rörliga fasen, acetonitril – vatten (65:35, v/v) innehållande 0,1 % myrsyra, levererades med en flödeshastighet på 0,2 mL/min. För att skydda masspektrometern från föroreningar avleddes flödet till spill under den första minuten efter injektionen. Alla andra instrumentella parametrar ställdes in enligt vår tidigare studie (Jiang, 2016). UPLC-ESI-MS/MS-metoden var välvaliderad och tillämpades framgångsrikt för att bestämma koncentrationerna av neurotransmittorer i hjärnbarkens homogenat och plasma (Jiang, 2016).
Statistisk analys
Den statistiska utvärderingen utfördes med programvaran SPSS version 18.0, och data uttrycktes som medelvärde ± SD. De presenterade uppgifterna om flyktlatens och banlängd i MWM-testet analyserades med upprepade åtgärder tvåvägs ANOVA. De andra beteendedata och biomarkörförändringarna in vitro testades med envägs ANOVA för multipla jämförelser. Signifikanta resultat markerades enligt konventionella kritiska P-värden: #P < 0,05; ##P < 0,01; ###P < 0,001, jämfört med kontrollgruppen. ∗P < 0,05; ∗∗P < 0,01; ∗∗∗∗P < 0,001, jämfört med den scopolamininducerade gruppen.
Resultat
HAL och HAR dämpade kognitiv dysfunktion hos skopolaminbehandlade möss i MWM
För att bestämma effekterna av HAL (L, M och H-doser) och HAR (L, M och H-doser) på rumslig inlärning och minne utfördes MWM-uppgiften på de skopolamininducerade minnesnedsatta mössen. Tvåvägsanalys av upprepade åtgärder med blandad modell visade att latensen för att nå plattformen var signifikant annorlunda mellan försöksgrupperna av möss (F(8,396) = 26,011, P < 0,001) och dagar av förvärvsträning (F(4,396) = 15,274, P < 0,001). Det fanns ingen signifikant interaktion mellan grupper och dagar (F(32,396) = 1,132, P > 0,05), vilket tyder på att skillnaderna mellan grupperna var beroende av behandlingen. Som presenteras i figur 2, i testet med dold plattform, var flyktlatens och banlängden i den scopolamininducerade gruppen signifikant längre än i kontrollgruppen den fjärde (figur 2A, F(8,99) = 3,135, P < 0.01; Figur 2B, F(8,99) = 4,074, P < 0,01) och femte dagen (Figur 2A, F(8,99) = 4,164, P < 0,01; Figur 2B, F(8,99) = 4,548, P < 0,01), vilket indikerar att den lyckade musmodellen för minnesförlust har konstruerats. De scopolamininducerade kognitiva underskotten reverserades dock av både HAL och HAR. Jämfört med den scopolamininducerade gruppen reducerades flyktlatensiteten och banlängden effektivt i HAL (L, M och H-doser) och HAR (M och H-doser) behandlade grupper på den fjärde (figur 2A, F(8,99) = 4,975, P < 0,01; F(8,99) = 2.816, P < 0,05; F(8,99) = 2,795, P < 0,05; Figur 2B, F(8,99) = 3,836, P < 0,01; F(8,99) = 3.231, P < 0,01; F(8,99) = 2,658, P < 0,05; Figur 2C, F(8,99) = 4,673, P < 0,01; F(8,99) = 4,881, P < 0,05.01; figur 2D, F(8,99) = 3,817, P < 0,01; F(8,99) = 3,129, P < 0,01) och femte dagen (figur 2A, F(8,99) = 12,637, P < 0,001; F(8,99) = 2,802, P < 0,05; F(8,99) = 2,772, P < 0,05; figur 2B, F(8,99) = 4.014, P < 0,01; F(8,99) = 2,722, P < 0,05; F(8,99) = 2,531, P < 0,05; Figur 2C, F(8,99) = 4,574, P < 0,05.01; F(8,99) = 4,632, P < 0,01; figur 2D, F(8,99) = 2,547, P < 0,05; F(8,99) = 3,905, P < 0,01). När de behandlades med den låga dosen HAR på 10 mg/kg (L-doseringsgruppen), minskade dock ingen signifikant minskning av flyktlatens och banlängden under hela träningsperioden på den fjärde (figur 2C, F(8,99) = 1.182, P > 0,05; figur 2D, F(8,99) = 0,494, P > 0,05) och femte dagen (figur 2C, F(8,99) = 0,873, P > 0,05; figur 2D, F(8,99) = 0,201, P > 0,05). Det framgår också av figur 2 att flyktlatens och banlängden hos donepezil-behandlade (5 mg/kg) förkortades markant jämfört med dem hos den scopolamininducerade gruppen vid den fjärde (figur 2A, F(8,99) = 2,668, P < 0.05; Figur 2B, F(8,99) = 2,643, P < 0,05) och femte dagen (Figur 2A, F(8,99) = 2,780, P < 0,05; Figur 2B, F(8,99) = 2,897, P < 0,05) under träningsförsöksomgång tre.
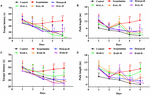
FIGUR 2. Effekterna av HAL (2, 5 och 10 mg/kg, dvs. låg: L, medel: M och hög: H dosering) och HAR (10, 20 och 30 mg/kg, dvs. L, M och H dosering) på scopolamininducerade minnesstörningar möss. HAL (doser L, M och H), HAR (doser L, M och H) och donepezil (5 mg/kg) administrerades genom gavage i 7 dagar före träningen för Morris water maze-test (MWM) och fortsatte under testet. Minnesstörningar framkallades med scopolamin (1 mg/kg, i.p.). Flyktlatens (A) och banlängden (B) hos de grupper som behandlats med HAL (doser L, M och H) i dolda plattformstester under fem på varandra följande dagar, och flyktlatens (C) och banlängden (D) hos de grupper som behandlats med HAR (doser L, M och H) i dolda plattformstester under fem på varandra följande dagar. Felmarginalen (SD) för datapunkterna i denna figur angavs inte för att tydligt särskilja skillnaden mellan behandlingarna. N = 12/grupp. ##P < 0,01, jämfört med kontrollgruppen. ∗P < 0,05; ∗∗P < 0,01; ∗∗∗∗P < 0,001, jämfört med den scopolamininducerade gruppen.
Dagen efter testet av den dolda plattformen genomfördes ett rumsligt sonderingsförsök genom att ta bort plattformen för att utvärdera det rumsliga minnet hos alla möss. Som visas i figur 3 minskade passningsfrekvensen anmärkningsvärt i den skopolamininducerade gruppen (F(8,81) = 5,498, P < 0,05), vilket illustrerar att 1 mg/kg skopolamin skadade bildandet av rumsligt minne hos möss. Särskilt, bortsett från behandlingsgruppen HAR (dosering L) (F(8,81) = 0,494, P > 0,05), höjde de andra behandlingsgrupperna HAL (doseringar L, M och H) och HAR (doseringar M och H) dramatiskt passningsfrekvensen (F(8,81) = 11,667, P < 0.01; F(8,81) = 9,072, P < 0,01; F(8,81) = 4,507, P < 0,05; F(8,81) = 7,063, P < 0,05; F(8,81) = 8,583, P < 0,01, respektive), och ökningen i gruppen med HAL-L-dosering var mer anmärkningsvärd jämfört med de andra grupperna (figur 3). Dessutom ökade donepezil-behandlad (5 mg/kg) grupp också signifikant passningsfrekvensen i jämförelse med de scopolamininducerade mössen (figur 3, F(8,81) = 5,345, P < 0,05). Alla dessa resultat tyder på att HAL (L, M och H doser) och HAR (M och H doser) kunde förbättra förmågan till rumsligt minne hos möss med scopolamininducerad kognitiv dysfunktion, och HAL uppvisade starkare effekter än HAR på den rumsliga inlärningen och minnet i MWM.
FIGUR 3. Effekterna av HAL (2, 5 och 10 mg/kg, det vill säga låg: L, medel: M och hög: H dosering) och HAR (10, 20 och 30 mg/kg, det vill säga L, M och H dosering) på scopolamininducerade minnesstörningar hos möss. Frekvensen av möss som passerar genom plattformsplatsen (A) och musens simspår i vattentanken (B). Den gröna cirkeln anger platsen för den dolda plattformen, medan de röda kurvorna representerar spåren av mössens rörelse. N = 10/grupp. #P < 0,05, jämfört med kontrollgruppen. ∗P < 0,05; ∗∗∗P < 0,01; jämfört med den scopolamininducerade gruppen.
Effekter av HAL och HAR på kolinergt system, oxidativ stress och inflammation inducerade av skopolamin
För att ytterligare belysa de potentiella mekanismerna hos HAL och HAR för att förbättra det minne som inducerats av skopolamin undersöktes nivåerna av mångfacetterade biokemiska faktorer och proteinexpressioner som är associerade med det kolinerga systemet, oxidativ stress och inflammation. I figurerna 4 och 5 visas förändringarna av olika biokemiska faktorer i cortex eller hippocampus, och i figurerna 6-8 visas effekterna av HAL och HAR på proteinuttrycken i cortex hos möss.
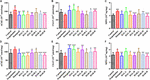
FIGUR 4. Effekterna av HAL (2, 5 och 10 mg/kg, nämligen låg: L, medel: M och hög: H) och HAR (10, 20 och 30 mg/kg, dvs. L, M och H) på aktiviteterna hos acetylkolinesteras (AChE), kolinacetyltransferas (ChAT) och myeloperoxidas (MPO) i hjärnbarken (A-C) och hipocampus (D-F) hos möss med kognitiv nedsättning orsakad av scopolamin. Data uttrycktes som medelvärde ± SD (n = 10). #P < 0,05; ##P < 0,01; ###P < 0,001, jämfört med kontrollgruppen. ∗P < 0,05; ∗∗∗P < 0,01; ∗∗∗∗P < 0,001, jämfört med den scopolamininducerade gruppen.
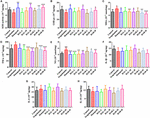
FIGUR 5. Effekterna av HAL (2, 5 och 10 mg/kg, nämligen låg: L, medel: M och hög: H) och HAR (10, 20 och 30 mg/kg, dvs. L, M och H) på aktiviteten eller produktionen av superoxiddismutas (SOD) (A), glutationperoxidas (GSH-px) (B), maleisk diadehyd (MDA) (C), tumörnekrosfaktor α (TNF-α) (D) och kväveoxid (NO) (E) i hjärnbarken hos möss med scopolamininducerad kognitiv nedsättning. Data uttrycktes som medelvärde ± SD (n = 10). #P < 0,05; ##P < 0,01; ###P < 0,001, jämfört med kontrollgruppen. Interleukin 1β (IL-1β) (F), interleukin 6 (IL-6) (G) och interleukin 10 (IL-10) (H). ∗P < 0,05; ∗∗P < 0,01; ∗∗∗∗P < 0,001, jämfört med den scopolamininducerade gruppen.
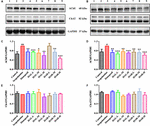
FIGUR 6. Effekterna av HAL (2, 5 och 10 mg/kg, dvs. låg: L, medel: M och hög: H dosering) och HAR (10, 20 och 30 mg/kg, dvs. L, M och H dosering) på proteinuttrycksnivåerna av acetylkolinesteras (AChE) och kolinacetyltransferas (ChAT) i cerebral cortex (A, C, E) och hipocampus (B, D, F) hos möss med kognitiv svikt orsakad av scopolamin. Data uttrycktes som medelvärde ± SD (n = 3). #P < 0,05; ##P < 0,01, jämfört med kontrollgruppen. ∗P < 0,05; ∗∗P < 0,01; ∗∗∗∗P < 0,001, jämfört med den scopolamininducerade gruppen.

FIGUR 7. Effekterna av HAL (2, 5 och 10 mg/kg, dvs. låg: L, medel: M och hög: H dosering) och HAR (10, 20 och 30 mg/kg, dvs. L, M och H dosering) på proteinuttrycksnivåerna av myeloperoxidas (MPO) i hjärnbarken (A, C) och hipocampus (B, D) hos möss med kognitiv nedsättning orsakad av skopolamin. Data uttrycktes som medelvärde ± SD (n = 3). #P < 0,05; ##P < 0,01, jämfört med kontrollgruppen. ∗P < 0,05; ∗∗P < 0,01; ∗∗∗∗P < 0,001, jämfört med den scopolamininducerade gruppen.

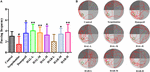
FIGUR 8. Effekterna av HAL (2, 5 och 10 mg/kg, dvs. låg: L, medel: M och hög: H dosering) och HAR (10, 20 och 30 mg/kg, dvs. L, M och H dosering) på generering av myeloperoxidas (MPO) i hjärnbarken hos möss med scopolamininducerad kognitiv nedsättning visualiserade med immunofluorescensmikroskopi.
Effekter av HAL och HAR på kolinerga brister
För att klargöra effekterna av HAL och HAR på den kolinerga funktionen i hjärnan bedömdes förändringarna i aktiviteterna och proteinnivåerna av AChE och ChAT i kortikala och hippocampala vävnader hos alla möss. Som visas i figurerna 4A,D ökade behandling med scopolamin på 1 mg/kg signifikant aktiviteten av AChE i cortex och hippocampus (F(8,81) = 10,553, P < 0,01; F(8,81) = 6,177, P < 0,05). Förutom HAR-L-doseringsgruppen i cortex minskade de andra HAL- (L, M och H-doseringar) och HAR- (M och H-doseringar) behandlingsgrupperna avsevärt AChE-aktiviteten (figur 4A, F(8,81) = 10,837, P < 0,01; F(8,81) = 8,621, P < 0,05; F(8,81) = 15,177, P < 0.01; F(8,81) = 8,615, P < 0,05; F(8,81) = 16,330, P < 0,001; Figur 4D, F(8,81) = 46,593, P < 0,001; F(8,81) = 34,179, P < 0,001.001; F(8,81) = 7,968, P < 0,05; F(8,81) = 4,769, P < 0,05; F(8,81) = 49,802, P < 0,001; F(8,81) = 46,665, P < 0,001). Likaså minskade den donepezil-behandlade gruppen tydligt AChE-aktiviteterna jämfört med nivåerna i den scopolamininducerade gruppen (figur 4A, F(8,81) = 13,138, P < 0,01; figur 4D, F(8,81) = 7,400, P < 0,05). Dessutom uppvisade den scopolamininducerade gruppen en signifikant minskning av ChAT-aktiviteten i både cortex och hippocampus (figur 4B, F(8,81) = 5,481, P < 0,05; figur 4E, F(8,81) = 4,874, P < 0,05). Trots detta ökade administrering av HAL (L och M doser) och HAR (M och H doser) märkbart ChAT-aktiviteten i cortex (figur 4B, F(8,81) = 7,956, P < 0,05; F(8,81) = 8,390, P < 0,05; F(8,81) = 7.835, P < 0,05; F(8,81) = 51,927, P < 0,001), och ChAT-nivåerna i alla HAL- och HAR-behandlingsgrupper i hippocampus var betydligt högre än i den scopolamininducerade gruppen (figur 4E, F(8,81) = 18.139, P < 0,001; F(8,81) = 9,665, P < 0,01; F(8,81) = 14,113, P < 0,01; F(8,81) = 5,178, P < 0,05; F(8,81) = 7,599, P < 0.05; F(8,81) = 11,953, P < 0,01), och effekten av HAL-L-doseringsgruppen på ChAT-aktiviteten var mer signifikant i jämförelse med HAR-administrationsgrupperna.
Som framgår av figur 6, jämfört med kontrollgruppen, var proteinuttrycksnivåerna av AChE i hjärnbarken och hippocampus i den scopolamininducerade gruppen kraftigt förhöjda (figur 6C, F(8,18) = 36,632, P < 0,01; figur 6D, F(8,18) = 14,823, P < 0,05), medan proteinnivåerna av ChAT var nästan oförändrade (figurerna 6E,F). Efter behandling med HAL (doser L, M och H), HAR (doser M och H) och donepezil, med undantag för HAR (dosering L), minskade proteinnivåerna av AChE i cortex markant jämfört med den scopolamininducerade gruppen (figur 6C, F(8,18) = 50.590, P < 0,001; F(8,18) = 16,950, P < 0,05; F(8,18) = 30,993, P < 0,01; F(8,18) = 23,821, P < 0.01; F(8,18) = 52,196, P < 0,001; F(8,18) = 29,284, P < 0,01), medan nivåerna av ChAT inte ändrades (figur 6E). Och liknande effekter på nivåerna av AChE och ChAT sågs med HAL- och HAR-administrationer (doser L, M och H) i hippocampus (figur 6D, F(8,18) = 41,195, P < 0.001; F(8,18) = 28,111, P < 0,01; F(8,18) = 47,611, P < 0,001; F(8,18) = 30,539, P < 0,01; F(8,18) = 33,225, P < 0,01; F(8,18) = 40,032, P < 0,001; Figur 6F). Dessutom var de hämmande effekterna av HAR på AChE-proteinuttrycket dosberoende, medan HAL hade en anmärkningsvärd hämmande effekt vid en låg dos på 2 mg/kg (figur 6). Således förhindrade HAL- och HAR-behandlingar mot scopolamininducerad förhöjning av AChE-aktiviteten och proteinuttrycket och minskning av ChAT-aktiviteten, vilket visade att HAL och HAR kunde förbättra det kolinerga systemets funktion och lindra den beteendemässiga dysfunktionen. I synnerhet HAL manifesterade en signifikant förbättring under låg dosering.
Effekter av HAL och HAR på markörer för oxidativ stress
Effekterna av HAL och HAR på aktiviteterna av antioxidativa enzymer SOD, GSH-px och nivån av MDA i cortex mättes. Som framgår av figur 5 minskade den scopolamininducerade gruppen synligt SOD- och GSH-px-aktiviteterna jämfört med kontrollgruppen (figur 5A, F(8,81) = 12,254, P < 0,01; figur 5B, F(8,81) = 4,577, P < 0,05). Medan HAL (H-dosering), HAR (M- och H-doseringar) och donepeziladministrationer signifikant ökade SOD-aktiviteten (figur 5A, F(8,81) = 13,287, P < 0,01; F(8,81) = 13,424, P < 0,01; F(8,81) = 34,510, P < 0,01.001; F(8,81) = 8,670, P < 0,01), och HAL-, HAR- (båda H-doserna) och donepezilbehandlingar ökade tydligt aktiviteten hos GSH-px (figur 5B, F(8,81) = 6,010, P < 0,05; F(8,81) = 6,008, P < 0,05; F(8,81) = 6,860, P < 0,05). Med HAL-, HAR- (både M- och H-doseringarna) och donepezil (5 mg/kg) behandlingar observerades dessutom en signifikant dämpning av ökningen av MDA-nivån jämfört med de scopolamininducerade mössen (figur 5C, F(8,81) = 9.302, P < 0,01; F(8,81) = 6,565, P < 0,05; F(8,81) = 12,690, P < 0,01; F(8,81) = 33,627, P < 0,001; F(8,81) = 5,874, P < 0,05). Dessa resultat tyder på att HAL och HAR kan förebygga mot scopolamininducerad oxidativ skada genom att skydda hjärnbarken från oxidativ stress. Noterbart är att den oxidativa skadan kunde förbättras endast vid höga doser för både HAL och HAR, och förbättringarna av HAL och HAR var generellt sett jämförbara.
Effekter av HAL och HAR på inflammationsnivåer
Effekterna av HAL och HAR på aktiviteterna av inflammationsfaktorerna MPO, TNF-α, IL-1β, IL-6, IL-10 och NO-nivån i cortex eller hippocampus analyserades. Aktiviteterna av MPO (cortex och hippocampus) och TNF-α (cortex) var förhöjda hos de scopolamininducerade mössen jämfört med kontrollmössen (figur 4C, F(8,81) = 34.740, P < 0,001; figur 4F, F(8,81) = 6,729, P < 0,05; figur 5D, F(8,81) = 6,316, P < 0,05), men nivåerna av IL-1β, IL-6 och IL-10 ändrades inte (figurerna 5F-H). HAL-, HAR- (både M- och H-doser) och donepeziladministrationer resulterade dock i en signifikant minskning av MPO-aktiviteten i cortex och hippocampus på ett dosberoende sätt (figur 4C, F(8,81) = 10.435, P < 0,01; F(8,81) = 32,309, P < 0,001; F(8,81) = 16,397, P < 0,01; F(8,81) = 31,291, P < 0.001; F(8,81) = 7,129, P < 0,05; Figur 4F, F(8,81) = 7,212, P < 0,05; F(8,81) = 10,533, P < 0.01; F(8,81) = 9,150, P < 0,01; F(8,81) = 18,903, P < 0,001; F(8,81) = 11,641, P < 0,01), och HAL- (L, M och H-doseringarna), HAR- (M och H-doseringarna) och donepezilbehandlingar försvagar också TNF-α-aktiviteten i cortex (figur 5D, F(8,81) = 10.377, P < 0,01; F(8,81) = 28,257, P < 0,001; F(8,81) = 31,088, P < 0,001; F(8,81) = 15,966, P < 0,001; F(8,81) = 23,530, P < 0,001; F(8,81) = 5,909, P < 0,05). Dessutom, bortsett från HAR-L-doseringsgruppen, hittades en märkbar dämpning av NO-nivåökningen i de andra HAL-, HAR- och donepezilbehandlade mössen jämfört med de scopolamininducerade minnesförlustmössen (figur 5E, F(8,81) = 21.319, P < 0,001; F(8,81) = 12,996, P < 0,01; F(8,81) = 11,911, P < 0,01; F(8,81) = 5,227, P < 0,05; F(8,81) = 8,799, P < 0.01; F(8,81) = 17,349, P < 0,001), och de hämmande effekterna av HAL på TNF-α och NO var mer uttalade än de av HAR.
Som framgår av figur 7 var proteinuttrycksnivåerna för kortikalt och hippocampalt MPO hos scopolamininducerade möss förhöjda jämfört med kontrollmöss (figur 7C, F(8,18) = 29,975, P < 0,01; figur 7D, F(8,18) = 32,014, P < 0,01). Efter administrering av donepezil, HAL och HAR (doser L, M och H) sjönk proteinuttrycken av MPO uppenbarligen i cortex och hippocampus jämfört med den scopolamininducerade gruppen. Dessutom visade resultaten av immunofluorescensbestämning också att HAL- och HAR-behandlingar på ett slående sätt kunde minska MPO-uttrycket i cortex med ett dosberoende sätt, och inhiberingarna av HAL och HAR var jämförbara (figur 8). Alla dessa resultat antydde att HAL och HAR kunde minska den scopolamininducerade inflammatoriska skadan genom att hämma cortex och hippocampus från inflammation.
Modulerande effekter av HAL och HAR på neurotransmittorerna hos scopolaminbehandlade möss
Varier olika plasmatiska och kortikala neurotransmittorerna uppskattades med hjälp av UPLC-ESI-MS/MS och förändringarna presenteras i figurerna 9, 10 respektive. Baserat på den tidigare fastställda metoden för bestämning av neurotransmittorer låg innehållet av ACh, Ch, L-Trp, 5-HT, L-Glu, L-Phe, L-Tyr i plasman och ACh, Ch, L-Trp, γ-GABA, L-Glu, L-Phe, L-Tyr i cortexen över den nedre kvantifieringsgränsen, och därefter kvantifierades alla framgångsrikt.
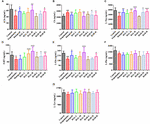
FIGUR 9. Effekterna av HAL (2, 5 och 10 mg/kg, dvs. låg: L, medel: M och hög: H dosering) och HAR (10, 20 och 30 mg/kg, dvs. L, M och H dosering) på innehållet av neurotransmittorer i plasman hos möss med scopolamininducerad kognitiv nedsättning. N = 10/grupp. ACh (A), Ch (B), L-Trp (C), 5-HT (D), L-Glu (E), L-Phe (F), L-Tyr (G). #P < 0,05; ##P < 0,01; ###P < 0,001, jämfört med kontrollgruppen. ∗P < 0,05; ∗∗P < 0,01; ∗∗∗∗P < 0,001, jämfört med den scopolamininducerade gruppen.
FIGUR 10. Effekterna av HAL (2, 5 och 10 mg/kg, dvs. låg: L, medel: M och hög: H dosering) och HAR (10, 20 och 30 mg/kg, dvs. L, M och H dosering) på innehållet av neurotransmittorer i hjärnbarken hos möss med scopolamininducerad kognitiv nedsättning. N = 10/grupp. ACh (A), Ch (B), L-Trp (C), γ-GABA (D), L-Glu (E), L-Phe (F), L-Tyr (G). #P < 0,05; ##P < 0,01, jämfört med kontrollgruppen. ∗P < 0,05; ∗∗P < 0,01; ∗∗∗∗P < 0,001, jämfört med den scopolamininducerade gruppen.
Efter induktion av scopolamin i dosen 1 mg/kg minskade koncentrationerna av ACh, L-Trp, 5-HT, L-Glu och L-Phe i plasma (figur 9A, F(8,81) = 11.453, P < 0,01; figur 9C, F(8,81) = 23,137, P < 0,001; figur 9D, F(8,81) = 7,359, P < 0,05; figur 9E, F(8,81) = 55.531, P < 0,001; figur 9F, F(8,81) = 6,330, P < 0,05), medan det inte hade någon inverkan på L-Tyr (figur 9G, F(8,81) = 2,091, P > 0,05). Vid behandling med HAL och HAR i hög dosering förhöjdes dock innehållet av ACh och L-Glu (figur 9A, E), och innehållet av L-Trp förhöjdes uppenbarligen med HAL (L, M och H-doseringar) och HAR (M och H-doseringar) administreringar på ett dosberoende sätt (figur 9C). Dessutom uppvisade de HAL- och HAR-behandlade (M- och H-doser) mössen en signifikant förhöjning av 5-HT-nivån jämfört med de scopolamininducerade mössen (figur 9D). Men HAL- och HAR-administrationerna modulerade inte innehållet av L-Phe och L-Tyr (figurerna 9F och G). Dessutom gav HAL (H-dosering) samt HAR (M- och H-doseringar) en effekt på att minska innehållet av Ch i plasma (figur 9B).
Figur 10 visar dessutom variationerna av neurotransmittorerna i hjärnbarken. Efter induktion av scopolamin minskade uppenbarligen innehållet av ACh, L-Trp, L-Glu, L-Phe och L-Tyr (figur 10A, F(8,81) = 11,296, P < 0,01; figur 10C, F(8,81) = 10,979, P < 0,01; figur 10E, F(8,81) = 7,216, P < 0,05; figur 10F, F(8,81) = 10.340, P < 0,01; figur 10G, F(8,81) = 6,834, P < 0,05), medan innehållet av Ch och γ-GABA var signifikant förhöjt i cortex jämfört med kontrollgruppen (figur 10B, F(8,81) = 7,377, P < 0,05; figur 10D, F(8,81) = 5,580, P < 0,05). Icke desto mindre var innehållet av ACh observerbart förhöjt i HAL-grupperna (L, M och H-doser) och HAR-grupperna (M och H-doser), och innehållet av L-Trp var anmärkningsvärt förhöjt i HAL-grupperna (L, M och H-doser) och HAR-grupperna (H-dosering), och mängderna L-Glu var också förhöjda vid den höga dosen i HAL- och HAR-grupperna (figurerna 10A, C, E). Dessutom resulterade behandlingarna med HAL (L, M och H-doser) och HAR (H-dosering) i en tydlig minskning av Ch- och γ-GABA-nivåerna jämfört med den scopolamininducerade gruppen (figurerna 10B, D). Olika doser av HAL och HAR visade dock försumbar effekt på den minskning av L-Phe och L-Tyr som inducerades av scopolamin (figurerna 10F,G). Generellt sett var effekterna av HAL på de viktiga plasmatiska och kortikala neurotransmittorerna mer framträdande än effekterna av HAR (figur 9, 10).
Diskussion
Alzheimers sjukdom är en dödlig progressiv neurodegenerativ sjukdom med ökande åldrande befolkning och förväntad livslängd, och det är brådskande att hitta nya läkemedel som effektivt kan behandla Alzheimers sjukdom (Kouémou et al., 2017). Det är allmänt känt att kolinerga hypofunktioner, oxidativ stress och neuroinflammation är ett av de viktigaste kännetecknen för Alzheimers sjukdom (Abd-El-Fattah et al., 2014; Demirci et al., 2017). Skopolamin är en icke-selektiv antagonist av den muskariniska kolinerga receptorn (Jang et al., 2013; Kaur et al., 2017). Många studier har visat att scopolamin kan försämra förmågan till inlärning och minne hos människor och djurmodeller, och den scopolamininducerade AD-modellen används i stor utsträckning för att studera kognitiva brister och screena för anti-AD-läkemedel (Goverdhan et al., 2012). Skopolamin leder till kognitiva brister i samband med en minskning av kolinerga neurotransmissioner, ökad oxidativ stress samt förhöjd inflammation i hjärnan (Lin och Beal, 2006). Följaktligen kan läkemedel effektivt förbättra den kolinerga funktionen och/eller dämpa oxidativ stress och inflammation, och kan vända inlärnings- och minnesförsämringarna hos scopolamininducerade AD-möss, och kommer i slutändan att vara värdefulla för behandling av AD.
Tidigare bevisade He et al. (2015a) att HAR kunde hämma AChE-aktiviteten och signifikant förbättra rumsinlärning och minne hos kognitivt nedsatta möss, inklusive APP/PS1-transgena och scopolamininducerade AD-möss. I denna studie jämfördes de minnesförbättrande effekterna av HAL (2, 5 och 10 mg/kg) och HAR (10, 20 och 30 mg/kg) på scopolamininducerade möss med hjälp av MWM beteendeutvärdering. Scopolamin (1 mg/kg) verifierades skada mössens spatiala inlärnings- och minnesförmåga i MWM-uppgiften, vilket överensstämde med våra tidigare studier (He et al., 2015a; Liu et al., 2017). Efter behandlingar med HAL (L, M och H doser) och HAR (M och H doser) minskades flyktlatensiteten och banlängden och passeringsfrekvensen ökade effektivt (figur 2, 3), vilket visar att HAL- och HAR-administreringarna märkbart förbättrade inlärningen och det rumsliga minnet hos de scopolamininducerade mössen, och förbättringarna av HAL var mer signifikanta än de av HAR.
För att ytterligare klargöra den underliggande mekanismen för förbättring av inlärning och minne av HAL och HAR hos scopolamininducerade möss bedömdes förändringarna av det kolinerga systemet, oxidativ stress och inflammation. Som rapporterats i tidigare litteratur (Abd-El-Fattah et al., 2014; Lin et al., 2016; Demirci et al., 2017) ledde injektion av scopolamin i.p. till en försvagning av den kolinerga funktionen, förhöjd oxidativ stress och inflammation i aktuell studie. Donepezil är en representativ symtomatisk behandling för mild och måttlig AD som en AChE-hämmare (Bohnen et al., 2005), och nyare forskning har visat att det också kan undertrycka inflammation och oxidativ stress (Saxena et al., 2008; Yoshiyama et al., 2010). I den här studien kunde donepezil (positiv kontroll) effektivt förbättra dessa förändringar hos scopolamininducerade möss och förbättra deras inlärning och minne. I likhet med deras aktiviteter in vitro (Zhao et al., 2013; Liu et al., 2014), vände HAL och HAR i olika doser inte bara den scopolamininducerade höjningen av AChE-aktiviteten, utan resulterade också i en förhöjning av neurotransmittorn ACh och en minskning av Ch i hjärnbarken, hippocampus eller plasma (figurerna 4, 9 och 10). Dessutom hämmades proteinnivåerna av kortikalt AChE tydligt av HAL och HAR (figurerna 6C, D). Som rapporterats av Oh et al. (2009) reducerades ChAT-positiva neuroner signifikant genom behandling med skopolamin. De nuvarande resultaten visade att HAL och HAR kunde vända den minskning av ChAT-aktiviteten som inducerades av scopolamin (figurerna 4B,E), samtidigt som de inte hade någon inverkan på proteinuttrycken av ChAT (figurerna 6E,F), och det behöver bevisas ytterligare. Därför bekräftade dessa att anti-amnesiska effekter av HAL och HAR på kognitionsdysfunktion inducerad av scopolamin troligen är förknippade med modifiering av det kolinerga systemet (särskilt AChE), och HAL visade en uppenbar kolinerg förbättring vid låg dosering (2 mg/kg).
Också många studier har visat att ökad oxidativ stress i stor utsträckning anses vara en framträdande bidragande riskfaktor i utvecklingen av AD (Ghumatkar et al., 2015; Lu et al., 2018). HAL och HAR kan fungera som endogena antioxidanter och visade sig ha en antioxidantkapacitet genom att fånga upp fria radikaler (Tse-Susanna et al., 1991; Berrougui et al., 2006a,b). I den här studien observerades överproduktion av ROS (en produkt av lipidperoxidation, MDA) och minskning av antioxidativa enzymer (SOD och GSH-px) hos de scopolamininducerade mössen (figur 5). Administrering av HAL och HAR aktiverade dock observerbart de antioxidativa enzymerna SOD och GSH-px och undertryckte bildandet av MDA i cortex hos de scopolamininducerade demensmössen (figur 5), och förbättrade sedan förmågan till antioxidativt försvar, vilket indikerar de neuroprotektiva effekterna av HAL och HAR. Framför allt var de antioxidativa effekterna av HAL och HAR generellt sett jämförbara.
Det finns dessutom allt fler bevis som tyder på att minnesförsämring är förknippad med ökad neuroinflammation (Abd-El-Fattah et al., 2014). Enligt studien av Bensalem et al. (2014) visade HAL och HAR en signifikant hämning på MPO med IC50 på 0,08 respektive 0,26 μM. Antiinflammatorisk aktivitet av HAR uppnåddes genom att hämma TNF-α och NO i lipopolysackaridstimulerade RAW264-celler från mus och THP-1-celler från människa (Patel et al., 2012). Noterbart är att de höga nivåerna av proinflammatoriska cytokiner (TNF-α och MPO) och inflammatoriska mediatorer (NO) upptäcktes i hjärnan hos amnesimöss som inducerats av scopolamin (figur 4, 5). Den aktuella studien bekräftade att HAL- och HAR-behandlingar samtidigt kunde hämma genereringen av NO och uppregleringen av TNF-α och MPO, och de hämmande effekterna av HAL på TNF-α och NO var tydligare än de av HAR (figurerna 4 och 5). Dessutom visar resultaten av western blotting och immunofluorescensanalyser ytterligare att proteinuttrycksnivåerna av MPO undertrycktes kraftigt av HAL och HAR (figurerna 7 och 8), vilket tyder på att HAL:s och HAR:s förmåga att motverka minnesbrister kan förmedlas genom att undertrycka de inflammatoriska markörerna TNF-α, MPO och NO.
Som bekant är AD förknippat med otillräckliga nivåer av olika neurotransmittorer (Kumar och Singh, 2015; Svob Strac et al, 2015). Tidigare studier har rapporterat att möss som fick enbart scopolamin visade en avsevärt minskad reaktivitet i det kolinerga systemet, vilket indikeras av en minskad ACh-nivå och en ökad AChE-aktivitet tillsammans med en minskad ChAT-aktivitet (Lee et al., 2014). En transgen djurmodell av AD visade en sjunkande Glu-nivå (Nilsen et al., 2012), och serum- och plasmametabolomiken visade också på en minskning av Trp, 5-HT, Glu, Phe, Tyr i AD-modellmöss eller patienter (Vermeiren et al., 2014; González-Domínguez et al., 2015; Weng et al., 2015; Corso et al., 2017; Li et al., 2018). På motsvarande sätt visade våra resultat att den scopolamininducerade demensen åtföljdes av en minskning av ACh, L-Trp, 5-HT, L-Glu, L-Phe, L-Tyr och en ökning av Ch och γ-GABA, vilket stämmer överens med tidigare studier (Scali et al, 1999; Nilsen et al., 2012; Lee et al., 2014; Vermeiren et al., 2014; González-Domínguez et al., 2015; Kumar och Singh, 2015; Weng et al., 2015; Zhou et al., 2016; Corso et al., 2017; Liu et al., 2017). Neurotransmittorer spelar en viktig roll i den hjärnkrets som är involverad i många aspekter av inlärning och minne, särskilt de kolinerga, serotonerga, glutametargiska och GABAergiska neurotransmittorerna (Vermeiren et al., 2014; Kumar och Singh, 2015; Zhou et al., 2016). Det är anmärkningsvärt att, med undantag för L-Phe och L-Tyr, kunde de andra förändringarna effektivt reverseras av både HAL- och HAR-administrationer i plasma och cortex, och moduleringarna av HAL var mer slående än de av HAR (figurerna 9 och 10). Följaktligen kan HAL:s och HAR:s regleringar av dessa neurotransmittorer vara fördelaktiga för att förbättra inlärnings- och minnesförmågan hos dementa möss.
Generellt sett visade HAL (2, 5 och 10 mg/kg) och HAR (20 och 30 mg/kg) en förstärkning av den kolinerga neurotransmissionen genom att undertrycka AChE och inducera ChAT, Förbättrat antioxidantförsvar genom att öka SOD- och GSH-px-aktiviteterna och minska MDA-produktionen, förbättrade antiinflammatoriska effekter genom att sänka TNF-α, MPO och NO samt modulering av nivåerna av kritiska neurotransmittorer (ACh, Ch, L-Trp, 5-HT, γ-GABA och L-Glu). HAL och HAR kan således verka på flera mål som terapeutiska medel mot Alzheimers sjukdom. Dessutom var HAL:s regleringar av den kolinerga funktionen, inflammation och neurotransmittorer mer anmärkningsvärda än HAR:s, och HAL uppvisade en liknande antioxidantkapacitet som HAR. Särskilt den effektiva dosen av HAL (2 mg/kg) var mycket lägre än den av HAR (20 mg/kg), vilket huvudsakligen kan bero på skillnaderna i biotillgänglighet och metabolisk stabilitet hos de två läkemedlen (Li et al., 2017b). Sammantaget visade alla dessa resultat att jämfört med HAR kan HAL vara en bättre kandidatförening med överlägsna antiamnesiska och farmakokinetiska egenskaper för AD-behandling.
Slutsats
Sammanfattningsvis kunde HAL och HAR effektivt förbättra minnesförsämringar i en scopolamininducerad musmodell via förbättring av det kolinerga systemets funktion, undertryckande av oxidativ stress och inflammationsskador samt modulering av vitala neurotransmittorer hos dementa möss. Särskilt för HAL var regleringarna av den kolinerga funktionen, inflammationen och neurotransmittorerna mer betydande än för HAR, och uppvisade en jämförbar antioxidanteffekt med HAR. Noterbart är att den effektiva dosen av HAL (2 mg/kg) var mycket lägre än den av HAR (20 mg/kg). De övergripande resultaten tyder på att HAL kan vara en överlägsen läkemedelskandidat för behandling av inlärnings- och minnesstörningar såsom Alzheimers sjukdom. Ytterligare utvärderingar måste göras av HAL:s antiamnestiska effekter och molekylära mekanismer, vilket kommer att ge betydande första bevis för förebyggande och behandling av AD.
Författarbidrag
S-PL och C-HW: deltog i forskningens utformning, utförde dataanalyser, skrev eller bidrog till skrivandet av manuskriptet. S-PL, Y-WW, S-LQ, Y-PZ, GD, W-ZD, CM, Q-YL, H-DG, WL och X-MC: utförde experiment.
Finansiering
Detta arbete stöddes av Kinas nationella naturvetenskapliga stiftelse och Kinas autonoma region Xinjiang Uygur (Grant No. U1130303), Kinas nationella naturvetenskapliga stiftelse (bidrag nr 81173119), nyckelprojektet från Kinas ministerium för vetenskap och teknik (bidrag nr 81173119), Kinas nationella naturvetenskapliga stiftelse (bidrag nr 81173119) och Kinas ministerium för vetenskap och teknik (bidrag nr 81173119). 2012ZX09103201-051), och Technology Cooperation Projects of Science i Shanghai, Kina (Grant No. 14495800200) som tilldelats C-HW för finansiellt stöd till den här studien.
Intressekonfliktförklaring
Författarna förklarar att forskningen har utförts i avsaknad av kommersiella eller finansiella relationer som skulle kunna uppfattas som en potentiell intressekonflikt.
Abd-El-Fattah, M. A., Abdelakader, N. F., and Zaki, H. F. (2014). Pyrrolidindithiokarbamat skyddar mot scopolamininducerad kognitiv försämring hos råttor. Eur. J. Pharmacol. 723, 330-338. doi: 10.1016/j.ejphar.2013.11.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Aucoin, J. S., Jiang, P., Aznavour, N., Tong, X. K., Buttini, M., Descarries, L., et al. (2005). Selektiv kolinerg denervering, oberoende av oxidativ stress, i en musmodell av Alzheimers sjukdom. Neuroscience 132, 73-86. doi: 10.1016/j.neuroscience.2004.11.047
PubMed Abstract | CrossRef Full Text | Google Scholar
Bassani, T. B., Turnes, J. M., Moura, E. L., Bonato, J. M., Cóppola-Segovia, V., Zanata, S. M., et al. (2017). Effekter av curcumin på korttidsrymds- och igenkänningsminne, vuxen neurogenes och neuroinflammation i en streptozotocininducerad råttmodell av demens av Alzheimertyp. Beteende. Brain Res. 335, 41-54. doi: 10.1016/j.bbr.2017.08.014
PubMed Abstract | CrossRef Full Text | Google Scholar
Bensalem, S., Soubhye, J., Aldib, I., Bournine, L., Nguyen, A. T., Vanhaeverbeek, M., et al. (2014). Hämning av myeloperoxidasaktivitet av alkaloider från Peganum harmala L. (Zygophyllaceae). J. Ethnopharmacol. 154, 361-369. doi: 10.1016/j.jep.2014.03.070
PubMed Abstract | CrossRef Full Text | Google Scholar
Berrougui, H., Isabelle, M., Cloutier, M., Hmamouchi, M. och Khalil, A. (2006a). Skyddande effekter av Peganum harmala L. extrakt, harmine och harmalin mot oxidation av lipoprotein med låg densitet hos människor. J. Pharm. Pharmacol. 58, 967-974. doi: 10.1211/jpp.58.7.0012
PubMed Abstract | CrossRef Full Text | Google Scholar
Berrougui, H., Martín-Cordero, C., Khalil, A., Hmamouchi, M., Ettaib, A., Marhuenda, E., et al. (2006b). Vasorelaxerande effekter av harmin och harmalin extraherade från Peganum harmala L. frön i isolerad aorta hos råtta. Pharmacol. Res. 54, 150-157. doi: 10.1016/j.phrs.2006.04.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Bohnen, N. I., Kaufer, D. I., Hendrickson, R., Ivanco, L. S., Lopresti, B. J., Koeppe, R. A., et al. (2005). Graden av hämning av kortikal acetylkolinesterasaktivitet och kognitiva effekter av donepezilbehandling vid Alzheimers sjukdom. J. Neurol. Neurosurg. Psychiatry 76, 315-319. doi: 10.1136/jnnp.2004.038729
PubMed Abstract | CrossRef Full Text | Google Scholar
Bromley-Brits, K., Deng, Y. och Song, W. H. (2011). Morris vattenlabyrintest för inlärning och minnesunderskott hos möss med Alzheimers sjukdomsmodell. J. Vis. Exp. 53, 1-5. doi: 10.3791/2920
PubMed Abstract | CrossRef Full Text | Google Scholar
Corso, G., Cristofano, A., Sapere, N., La Marca, G., Angiolillo, A., Vitale, M., et al. (2017). Serumaminosyreprofiler hos normala personer och hos patienter med eller i riskzonen för Alzheimers demens. Dement. Geriatr. Cogn. Dis. Extra 7, 143-159. doi: 10.1159/000466688
PubMed Abstract | CrossRef Full Text | Google Scholar
Coyle, J. T., Price, D. L., and Delong, M. R. (1983). Alzheimers sjukdom: en störning av den kortikala kolinerga innervationen. Science 219, 1184-1190. doi: 10.1126/science.6338589
CrossRef Full Text | Google Scholar
Demirci, K., Nazıroğlu, M., Övey,İ. S., and Balaban, H. (2017). Selen dämpar apoptos, inflammation och oxidativ stress i blodet och hjärnan hos åldrade råttor med scopolamininducerad demens. Metab. Brain Dis. 32, 321-329. doi: 10.1007/s11011-016-9903-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Fan, L. Y. och Chiu, M. J. (2014). Kombiterapi och aktuella koncept samt framtida strategier för behandling av Alzheimers sjukdom. Neuropsychiatr. Dis. Behandla. 10, 439-451. doi: 10.2147/NDT.S45143
PubMed Abstract | CrossRef Full Text | Google Scholar
Frison, G., Favretto, D., Zancanaro, F., Fazzin, G., and Ferrara, S. D. (2008). Ett fall av betakarbolinalkaloidförgiftning efter intag av Peganum harmala fröextrakt. Forensic Sci. Int. 179, 37-43. doi: 10.1016/j.forsciint.2008.05.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Ghumatkar, P. J., Patil, S. P., Jain, P. D., Tambe, R. M. och Sathaye, S. (2015). Nootropiska, neuroprotektiva och neurotrofa effekter av phloretin vid scopolamininducerad amnesi hos möss. Pharmacol. Biochem. Behav. 135, 182-191. doi: 10.1016/j.pbb.2015.06.005
PubMed Abstract | CrossRef Full Text | Google Scholar
González-Domínguez, R., García-Barrera, T. och Gómez-Ariza, J. L. (2015). Metabolitprofilering för identifiering av förändrade metaboliska vägar vid Alzheimers sjukdom. J. Pharm. Biomed. Anal. 107, 75-81. doi: 10.1016/j.jpba.2014.10.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Goverdhan, P., Sravanthi, A. och Mamatha, T. (2012). Neuroprotektiva effekter av meloxicam och selegilin vid scopolamininducerad kognitiv försämring och oxidativ stress. Int. J. Alzheimers Dis. 2012, 1-8. doi: 10.1155/2012/974013
PubMed Abstract | CrossRef Full Text | Google Scholar
Gray, E., Thomas, T. L., Betmouni, S., Betmouni, S., Scolding, N. och Love, S. (2008). Förhöjd aktivitet och mikroglialt uttryck av myeloperoxidas i demyeliniserad hjärnbark vid multipel skleros. Brain Pathol. 18, 86-95. doi: 10.1111/j.1750-3639.2007.00110.x
PubMed Abstract | CrossRef Full Text | Google Scholar
He, D. D., Wu, H., Wei, Y., Liu, W., Huang, F., Shi, H. L., et al. (2015a). Effekter av harmine, en acetylkolinesterashämmare, på rumslig inlärning och minne hos APP/PS1-transgena möss och scopolamininducerad minnesnedsättning hos möss. Eur. J. Pharmacol. 768, 96-107. doi: 10.1016/j.ejphar.2015.10.037
PubMed Abstract | CrossRef Full Text | Google Scholar
He, D. D., Zhang, L., Liu, L., Wu, X. J., Cheng, X. M. och Wang, C. H. (2015b). Totala alkaloider från fröna av Peganum harmala förbättrar mössens inlärningsförmåga och minne. Chin. Tradit. Pat. Med. 37, 478-482.
Heneka, M. T., Carson, M. J., El Khoury, J., Landreth, G. E., Brosseron, F., Feinstein, D. L., et al. (2015). Neuroinflammation vid Alzheimers sjukdom. Lancet Neurol. 14, 388-405. doi: 10.1016/S1474-4422(15)70016-5
CrossRef Full Text | Google Scholar
Herraiz, T., Gonzalez, D., Ancin-Azpilicueta, C., Arán, V. J., and Guillén, H. (2010). Betakarbolinalkaloider i Peganum harmala och hämning av humant monoaminoxidas (MAO). Food Chem. Toxicol. 48, 839-845. doi: 10.1016/j.fct.2009.12.019
PubMed Abstract | CrossRef Full Text | Google Scholar
Jang, Y. J., Kim, J., Shim, J., Kim, C. Y., Jang, J. H., Lee, K. W., et al. (2013). Koffeinfritt kaffe förhindrar scopolamininducerad minnesförsämring hos råttor. Behav. Brain Res. 245, 113-119. doi: 10.1016/j.bbr.2013.02.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Jeon, S. J., Kim, B., Park, H. J., Zhang, J. B., Kwon, Y., Kim, D. H., et al. (2017). Den förbättrande effekten av 1-palmitoyl-2-linoleoyl-3-acetylglycerol på scopolamininducerad minnesnedsättning via acetylkolinesterashämning och LTP-aktivering. Behav. Brain Res. 324, 58-65. doi: 10.1016/j.bbr.2017.01.040
PubMed Abstract | CrossRef Full Text | Google Scholar
Jiang, B. (2016). Studie om transporten av alkaloider från Peganum harmala genom blod-hjärnbarriären och mekanismen för deras effekt på neurotransmittorer i råttors hjärna. Doktorsavhandling, Shanghai University of Traditional Chinese Medicine, Shanghai.
Jiménez, J., Riveron-Negrete, L., Abdullaev, F., Espinosa-Aguirrec, J. och Rodríguez-Arnaiza, R. (2008). Cytotoxicitet hos β-karbolinalkaloiderna harmin och harmalin i humana cellanalyser in vitro. Exp. Toxicol. Pathol. 60, 381-389. doi: 10.1016/j.etp.2007.12.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Kaur, R., Singh, V. och Shri, R. (2017). Anti-amnesiska effekter av Ganoderma-arter: en möjlig kolinergisk och antioxidantmekanism. Biomed. Pharmacother. 92, 1055-1061. doi: 10.1016/j.biopha.2017.06.029
PubMed Abstract | CrossRef Full Text | Google Scholar
Kouémou, N. E., Taiwe, G. S., Moto, F. C. O., Pale, S., Gwladys, N. T., Njapdounke, J. S. K., et al. (2017). Nootropiska och neuroprotektiva effekter av dichrocephala integrifolia på scopolamin musmodell av Alzheimers sjukdom. Front. Pharmacol. 8:847. doi: 10.3389/fphar.2017.00847
CrossRef Full Text | Google Scholar
Kumar, A., and Singh, A. (2015). En genomgång av Alzheimers sjukdoms patofysiologi och dess hantering: en uppdatering. Pharmacol. Rep. 67, 195-203. doi: 10.1016/j.pharep.2014.09.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Kwon, S. H., Lee, H. K., Kim, J. A., Hong, S. I., Kim, H. C., Jo, T. H., et al. (2010). Neuroprotektiva effekter av klorogensyra på scopolamininducerad amnesi via antiacetylkolinesteras och antioxidativa aktiviteter hos möss. Eur. J. Pharmacol. 649, 210-217. doi: 10.1016/j.ejphar.2010.09.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Lee, H. E., Jeon, S. J., Ryu, B., Park, S. J., Ko, S. Y., Lee, Y., et al. (2016). Swertisin, en C-glukosylflavon, förbättrar scopolamininducerad minnesförsämring hos möss med sin adenosin A1-receptorantagonistiska egenskap. Beteende. Brain Res. 306, 137-145. doi: 10.1016/j.bbr.2016.03.030
PubMed Abstract | CrossRef Full Text | Google Scholar
Lee, S., Kim, J., Seo, S. G., Choi, B. R., Han, J. S., Lee, K. W., et al. (2014). Sulforafan lindrar scopolamininducerad minnesförsämring hos möss. Pharmacol. Res. 85, 23-32. doi: 10.1016/j.phrs.2014.05.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, J., Liu, Y., Li, W., Wang, Z., Guo, P., Li, L., et al. (2018). Metabolisk profilering av effekterna av ginsenosid Re i en musmodell för Alzheimers sjukdom. Behav. Brain Res. 337, 160-172. doi: 10.1016/j.bbr.2017.09.027
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, S. P., Cheng, X. M. och Wang, C. H. (2017a). En genomgång av traditionella användningsområden, fytokemi, farmakologi, farmakokinetik och toxikologi för släktet Peganum. J. Ethnopharmacol. 203, 127-162. doi: 10.1016/j.jep.2017.03.049
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, S. P., Zhang, Y. P., Deng, G., Wang, Y. W., Qi, S. L., Cheng, X. M., et al. (2017b). Exponeringsegenskaper hos de analoga β-karbolinalkaloiderna harmalin och harmine baserat på effluxtransportören multidrug resistance protein 2. Front. Pharmacol. 8:541. doi: 10.3389/fphar.2017.00541
CrossRef Full Text | Google Scholar
Lin, J. J., Huang, L., Yu, J., Xiang, S. Y., Wang, J. L., Zhang, J. R., et al. (2016). Fucoxanthin, en marin karotenoid, reverserar scopolamininducerade kognitiva försämringar hos möss och hämmar acetylkolinesteras in vitro. Mar. Drugs 14:67. doi: 10.3390/md14040067
PubMed Abstract | CrossRef Full Text | Google Scholar
Lin, M. T., and Beal, M. F. (2006). Mitokondriell dysfunktion och oxidativ stress vid neurodegenerativa sjukdomar. Nature 443, 787-795. doi: 10.1038/nature05292
PubMed Abstract | CrossRef Full Text | Google Scholar
Liu, W., Yang, Y. D., Cheng, X. M., Gong, C., Li, S. P., He, D. D., et al. (2014). Snabb och känslig detektion av de hämmande aktiviteterna hos acetyl- och butyrylkolinesterashämmare med UPLC-ESIMS/MS. J. Pharm. Biomed. Anal. 94, 215-220. doi: 10.1016/j.jpba.2014.02.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Liu, W., Zhu, Y. D., Wang, Y. L., Qi, S. L., Wang, Y. W., Ma, C., et al. (2017). Anti-amnesisk effekt av extrakt och alkaloidfraktion från luftdelar av Peganum harmala på scopolamininducerade minnesunderskott hos möss. J. Ethnopharmacol. 204, 95-106. doi: 10.1016/j.jep.2017.04.019
PubMed Abstract | CrossRef Full Text | Google Scholar
Louis, E. D., Jiang, W., Gerbin, M., Mullaney, M. M. och Zheng, W. (2010). Förhållandet mellan blodkoncentrationer av harmane och harmin hos familjär essentiell tremor, sporadisk essentiell tremor och kontroller. Neurotoxicology 31, 674-679. doi: 10.1016/j.neuro.2010.08.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Lu, C., Dong, L. M., Lv, J. W., Wang, Y., Fan, B., Wang, F., et al. (2018). 20(S)-protopanaxadiol (PPD) lindrar scopolamininducerad minnesförsämring via reglering av kolinerga och antioxidantsystem och uttryck av Egr-1, c-Fos och c-Jun hos möss. Kem. Biol. Interact. 279, 64-72. doi: 10.1016/j.cbi.2017.11.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Mahmoudian, M., Jalipour, H. och Dardashti, P. S. (2002). Toxicitet hos Peganum harmala: genomgång och en fallrapport. Iran. J. Pharmacol. Ther. 1, 1-4.
Google Scholar
Malik, J., Kaur, J. och Choudhary, S. (2017). Standardiserat extrakt av Lactuca sativa Linn. och dess fraktioner upphäver scopolamininducerad amnesi hos möss: en möjlig kolinerga och antioxidantmekanism. Nutr. Neurosci. 1-12. doi: 10.1080/1028415X.2017.1291166 .
PubMed Abstract | CrossRef Full Text | Google Scholar
Morris, R. G., Garrud, P., Rawlins, J. A., and O’Keefe, J. (1982). Platsnavigering försämrad hos råttor med skador på hippocampus. Nature 297, 681-683. doi: 10.1038/297681a0
CrossRef Full Text | Google Scholar
Nilsen, L. H., Melø, T. M., Sæther, O., Witter, M. P., and Sonnewald, U. (2012). Förändrad neurokemisk profil i McGill-R-Thy1-APP-råttmodellen för Alzheimers sjukdom: en longitudinell in vivo 1H MRS-studie. J. Neurochem. 123, 532-541. doi: 10.1111/jnc.12003
PubMed Abstract | CrossRef Full Text | Google Scholar
Oh, J. H., Choi, B. J., Chang, M. S. och Park, S. K. (2009). Nelumbo nucifera semenextrakt förbättrar minnet hos råttor med scopolamininducerad amnesi genom induktion av kolinacetyltransferasuttryck. Neurosci. Lett. 461, 41-44. doi: 10.1016/j.neulet.2009.05.045
PubMed Abstract | CrossRef Full Text | Google Scholar
Patel, K., Gadewar, M., Tripathi, R., Prasad, S. K. och Patel, D. K. (2012). En genomgång av medicinsk betydelse, farmakologisk aktivitet och bioanalytiska aspekter av betakarbolinalkaloiden ”Harmine”. Asian Pac. J. Trop. Biomed. 2, 660-664. doi: 10.1016/S2221-1691(12)60116-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Rijpma, A., Meulenbroek, O. och Rikkert, M. O. (2014). Kolinesterashämmare och tilläggstillskott i form av näringstillskott vid Alzheimers sjukdom: en systematisk genomgång av randomiserade kontrollerade prövningar. Ageing Res. Rev. 16, 105-112. doi: 10.1016/j.arr.2014.06.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Saxena, G., Singh, S. P., Agrawal, R. och Nath, C. (2008). Effekt av donepezil och tacrin på oxidativ stress i intracerebral streptozotocin-inducerad modell av demens hos möss. Eur. J. Pharmacol. 581, 283-289. doi: 10.1016/j.ejphar.2007.12.009
PubMed Abstract | CrossRef Full Text | Google Scholar
Scali, C., Prosperi, C., Giovannelli, L., Bianchi, L., Pepeu, G. och Casamenti, F. (1999). β (1-40) amyloidpeptidinjektion i nucleus basalis hos råttor inducerar mikrogliareaktioner och ökar frisättningen av kortikal γ-aminosmörsyra in vivo. Brain Res. 831, 319-321. doi: 10.1016/S0006-8993(99)01492-4
CrossRef Full Text | Google Scholar
Shi, X. Y., Liu, W., Zhang, L., Li, S. P., Cheng, X. M., Xi, Y., et al. (2014). Farmakokinetik för harmalin, harmin och deras metaboliter hos råttor som administrerats med totala alkaloidutdrag från Peganum harmala L. Chin. Tradit. Pat. Med. 36, 1169-1175. doi: 10.3969/j.issn.1001-1528.2014.06.013
CrossRef Full Text | Google Scholar
Singh, S., Kaur, H. och Sandhir, R. (2016). Fraktala dimensioner: ett nytt paradigm för att bedöma rumsligt minne och inlärning med hjälp av Morris vattenlabyrint. Behav. Brain Res. 299, 141-146. doi: 10.1016/j.bbr.2015.11.023
PubMed Abstract | CrossRef Full Text | Google Scholar
Svob Strac, D., Muck-Seler, D. och Pivac, N. (2015). Neurotransmittormätningar i cerebrospinalvätskan hos patienter med Alzheimers sjukdom: en översikt. Psychiatr. Danub. 27, 14-24.
Google Scholar
Tse-Susanna, Y. H., Mak, I. T. och Dickens, B. F. (1991). Antioxidativa egenskaper hos harmane och β-karbolinalkaloider. Biochem. Pharmacol. 42, 459-464. doi: 10.1016/0006-2952(91)90305-O
CrossRef Full Text | Google Scholar
Vermeiren, Y., Van Dam, D., Aerts, T., Engelborghs, S. och De Deyn, P. P. (2014). Monoaminerga neurotransmittorförändringar i postmortala hjärnregioner hos deprimerade och aggressiva patienter med Alzheimers sjukdom. Neurobiol. Aging 35, 2691-2700. doi: 10.1016/j.neurobiolaging.2014.05.031
PubMed Abstract | CrossRef Full Text | Google Scholar
Verri, M., Pastoris, O., Dossena, M., Aquilani, R., Guerriero, F., Cuzzoni, G., et al. (2012). Mitokondriella förändringar, oxidativ stress och neuroinflammation vid Alzheimers sjukdom. Int. J. Immunopathol. Pharmacol. 25, 345-353. doi: 10.1177/039463201202500204
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, C. H., Zhang, Z. X., Wang, Y. H. och He, X. J. (2015). Cytotoxiska indolalkaloider mot mänskliga leukemicellinjer från den giftiga växten Peganum harmala. Toxins 7, 4507-4518. doi: 10.3390/toxins7114507
PubMed Abstract | CrossRef Full Text | Google Scholar
Weng, R., Shen, S. S., Tian, Y. L., Burton, C., Xu, X. Y., Liu, Y., et al. (2015). Metabolomics approach avslöjar integrerat metaboliskt nätverk associerat med serotoninbrist. Sci. Rep. 5:11864. doi: 10.1038/srep11864
PubMed Abstract | CrossRef Full Text | Google Scholar
Yoshiyama, Y., Kojima, A., Ishikawa, C. och Arai, K. (2010). Antiinflammatorisk verkan av donepezil förbättrar tau-patologi, synaptisk förlust och neurodegeneration i ett tauopati-musläge. J. Alzheimers Dis. 22, 295-306. doi: 10.3233/JAD-2010-100681
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhang, L. (2013). Studie om filmtäckande tabletter av totala alkaloider från Peganum harmala. Master Dissertation, Shanghai University of Traditional Chinese Medicine, Shanghai.
Zhao, T., Ding, K. M., Zhang, L., Cheng, X. M., Wang, C. H. och Wang, Z. T. (2013). Acetylkolinesteras- och butyrylkolinesteras-hämmande aktiviteter hos β-karbolin- och kinolinalkaloidderivat från växter av släktet Peganum. J. Chem. 2013:717232. doi: 10.1155/2013/717232
CrossRef Full Text | Google Scholar
Zhou, X. L., Li, Y. F., Shi, X. Z. och Ma, C. (2016). En översikt över terapier som dämpar amyloid β-nivån vid Alzheimers sjukdom: inriktning på neurotransmission, inflammation, oxidativ stress och ökade kolesterolnivåer. Am. J. Transl. Res. 8, 246-269.
PubMed Abstract | Google Scholar
Leave a Reply