8.3: Gaser och tryck
Lärandemål
- Att beskriva gasfasen.
Gasfasen är unik bland de tre materiatillstånden eftersom det finns enkla modeller som vi kan använda för att förutsäga det fysikaliska beteendet hos alla gaser, oberoende av deras identitet. Vi kan inte göra detta för de fasta och flytande tillstånden. Faktum är att utvecklingen av denna förståelse av gasers beteende utgör den historiska skiljelinjen mellan alkemi och modern kemi. De första framstegen i förståelsen av gasers beteende gjordes i mitten av 1600-talet av Robert Boyle, en engelsk vetenskapsman som grundade Royal Society (en av världens äldsta vetenskapliga organisationer).
Hur kommer det sig att vi kan modellera alla gaser oberoende av deras kemiska identitet? Svaret finns i en grupp påståenden som kallas den kinetiska teorin för gaser:
- Gaser består av små partiklar som är åtskilda av stora avstånd.
- Gaspartiklar är ständigt i rörelse och upplever kollisioner med andra gaspartiklar och väggarna i sin behållare.
- Gaspartiklarnas hastighet är relaterad till gasens temperatur.
- Gaspartiklar upplever ingen attraktions- eller repulsionskraft med varandra.
Bemärkte du att inget av dessa påståenden har med gasens identitet att göra? Det betyder att alla gaser borde bete sig på samma sätt. En gas som följer dessa påståenden perfekt kallas en idealgas. De flesta gaser uppvisar små avvikelser från dessa påståenden och kallas verkliga gaser. Existensen av verkliga gaser minskar dock inte betydelsen av den kinetiska teorin om gaser.
Ett av påståendena i den kinetiska teorin nämner kollisioner. Eftersom gaspartiklar ständigt är i rörelse kolliderar de också ständigt med varandra och med väggarna i sin behållare. Det finns krafter inblandade när gaspartiklarna studsar mot behållarens väggar (figur \(\PageIndex{1}\)). Den kraft som genereras av gaspartiklarna dividerad med arean av behållarens väggar ger trycket. Tryck är en egenskap som vi kan mäta för en gas, men vi tar vanligtvis inte hänsyn till tryck för fasta ämnen eller vätskor.
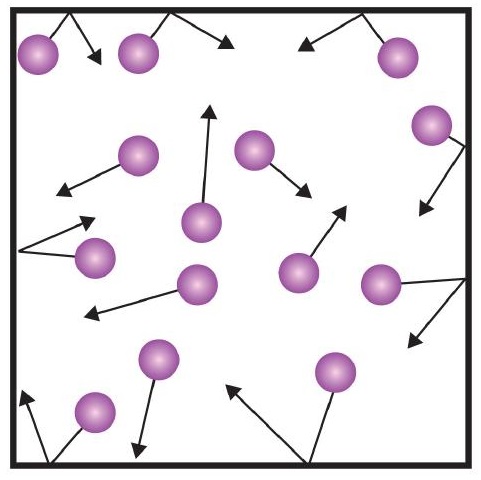
Den grundläggande enheten för tryck är newton per kvadratmeter (N/m2). Denna kombinerade enhet omdefinieras till pascal (Pa). En pascal är inte ett särskilt stort tryck. En mer användbar enhet för tryck är bar, som är 100 000 Pa (1 bar = 100 000 Pa). Andra vanliga tryckenheter är atmosfären (atm), som ursprungligen definierades som det genomsnittliga trycket i jordens atmosfär vid havsnivå, och mmHg (millimeter kvicksilver), som är det tryck som genereras av en 1 mm hög kvicksilverkolonn. Enheten millimeter kvicksilver kallas också torr, uppkallad efter den italienske vetenskapsmannen Evangelista Torricelli, som uppfann barometern i mitten av 1500-talet. En mer exakt definition av atmosfär, i termer av torr, är att det finns exakt 760 torr i 1 atm. En bar motsvarar 1,01325 atm. Med tanke på alla relationer mellan dessa tryckenheter är förmågan att konvertera från en tryckenhet till en annan en användbar färdighet.
Exempel \(\PageIndex{1}\): Konvertering av tryck
Skriv en konverteringsfaktor för att bestämma hur många atmosfärer som ingår i 1 547 mmHg.
Lösning
Eftersom 1 mmHg är lika med 1 torr, är det givna trycket också lika med 1 547 torr. Eftersom det finns 760 torr i 1 atm kan vi använda denna omvandlingsfaktor för att göra den matematiska omvandlingen:
\(\mathrm{1,547\: torr\times \dfrac{1\: atm}{760\: torr}=2.04\: atm}\)
Notera hur torr-enheterna upphävs algebraiskt.
Övningsuppgift \(\PageIndex{1}\):
Skriv en omräkningsfaktor för att bestämma hur många millimeter kvicksilver som finns i 9,65 atm.
Svar
\(\mathrm{9,65\: atm\times \dfrac{760\: mm Hg}{1\: atm}=7 334 \: mm Hg}\).
Den kinetiska teorin säger också att det inte finns någon växelverkan mellan enskilda gaspartiklar. Även om vi vet att det faktiskt finns intermolekylära interaktioner i verkliga gaser, antar den kinetiska teorin att gaspartiklarna är så långt ifrån varandra att de enskilda partiklarna inte ”känner” varandra. Därför kan vi behandla gaspartiklar som små bitar av materia vars identitet inte är viktig för vissa fysikaliska egenskaper.
Konceptgenomgångsövning
-
Vad är tryck, och vilka enheter använder vi för att uttrycka det?
Svar
-
Tryck är kraften per ytenhet; dess enheter kan vara pascal, torr, millimeter kvicksilver eller atmosfär.
Nyckeluppfattning
- Gasfasen har vissa allmänna egenskaper som är karakteristiska för den fasen.
Övningar
-
Vad är den kinetiska teorin för gaser?
-
Enligt den kinetiska teorin för gaser rör sig de enskilda gaspartiklarna (alltid, ofta, aldrig).
-
Varför utövar en gas ett tryck?
-
Varför kan vi enligt den kinetiska teorin för gaser anta att alla gaser kommer att uppvisa ett likartat beteende?
-
Sortera följande tryckmängder i ordning från minsta till största:
-
Vilken enhet för tryck är större – torr eller atmosfär?
-
Hur många torr finns det i 1.56 atm?
-
Konvertera 760 torr till pascal.
-
Blodtryck uttrycks i millimeter kvicksilver. Vad skulle blodtrycket i atmosfärer vara om en patients systoliska blodtryck är 120 mmHg och det diastoliska blodtrycket är 82 mmHg? (Inom medicinen skulle ett sådant blodtryck rapporteras som ”120/82”, vilket talas som ”etthundratjugo över åttiotvå”.)
-
I väderprognoser uttrycks det barometriska trycket i tum kvicksilver (tum Hg), där det finns exakt 25,4 mmHg i varje 1 tum Hg. Vad är det barometriska trycket i millimeter kvicksilver om det barometriska trycket rapporteras som 30,21 tum Hg?
Svar
-
Gaser består av små partiklar som är åtskilda av stora avstånd. Gaspartiklar är ständigt i rörelse och upplever kollisioner med andra gaspartiklar och väggarna i sin behållare. Gaspartiklarnas hastighet är relaterad till gasens temperatur. Gaspartiklar upplever ingen attraktions- eller repulsionskraft med varandra.
-
En gas utövar ett tryck när dess partiklar studsar mot behållarens väggar.
-
1 Pa, 1 mmHg och 1 atm
-
1 190 torr
9. 0,158 atm; 0,108 atm
10. 767,3 mm Hg
Leave a Reply