Selbstzerstörende Moskitos und sterilisierte Nagetiere: das Versprechen von Gene Drives
Austin Burt und Andrea Crisanti hatten acht Jahre lang versucht, das Moskito-Genom zu entführen. Sie wollten die natürliche Selektion umgehen und ein Gen einschleusen, das sich schneller in der Population ausbreiten würde als eine Mutation, die auf dem üblichen Weg der Vererbung weitergegeben wird. Im Hinterkopf hatten sie eine Möglichkeit, Malaria zu verhindern, indem sie ein Gen verbreiteten, das die Mückenpopulationen ausschaltet, so dass sie die Krankheit nicht übertragen können.
Crisanti erinnert sich, dass sie immer wieder scheiterten. Doch 2011 erhielten die beiden Genetiker vom Imperial College London endlich die erhofften DNA-Ergebnisse: Ein Gen, das sie in das Moskito-Genom eingefügt hatten, hatte sich in der Population ausgebreitet und mehr als 85 % der Nachkommen der Insekten erreicht1.
Es war der erste künstlich herbeigeführte „Gene Drive“: eine genetische Veränderung, die sich in einer Population mit überdurchschnittlich hoher Vererbungsrate ausbreitet. Gene Drives sind in einigen Labors schnell zur Routine geworden; Wissenschaftler können heute innerhalb weniger Monate einen Drive entwickeln. Die Technik stützt sich auf das Gen-Editing-Tool CRISPR und einige RNA-Bits, um ein bestimmtes Gen zu verändern oder auszuschalten oder ein neues einzufügen. In der nächsten Generation kopiert sich der gesamte Antrieb auf das Partnerchromosom, so dass das Genom nicht mehr die natürliche Version des gewählten Gens enthält, sondern zwei Kopien des Genantriebs. Auf diese Weise wird die Veränderung an bis zu 100 % der Nachkommen weitergegeben, anstatt an etwa 50 % (siehe „Wie Gene Drives funktionieren“).
Seit 2014 haben Wissenschaftler CRISPR-basierte Gene-Drive-Systeme in Moskitos, Fruchtfliegen und Pilzen entwickelt und sind derzeit dabei, sie in Mäusen einzusetzen. Aber das ist erst der Anfang der Geschichte. Die Frage, ob ein Gene Drive möglich ist, wurde von anderen Unbekannten verdrängt: wie gut sie funktionieren werden, wie man sie testen kann und wer die Technologie regulieren sollte. Gentriebe wurden als Möglichkeit vorgeschlagen, durch Insekten übertragene Krankheiten zu reduzieren oder zu beseitigen, invasive Arten zu kontrollieren und sogar die Insektizidresistenz von Schädlingen umzukehren. Bisher wurde noch kein Gentrieb in die freie Wildbahn entlassen, aber die Technologie könnte im Prinzip schon in drei Jahren einsatzbereit sein, sagt Crisanti. Er arbeitet mit Target Malaria zusammen, einem internationalen Forschungskonsortium ohne Erwerbszweck, das sich um den Einsatz von gentechnisch veränderten Stechmücken zur Malariabekämpfung in Afrika bemüht. Am 1. Juli setzte die Gruppe in einem Dorf in Burkina Faso eine Testcharge von Moskitos frei, die zwar gentechnisch verändert, aber noch nicht mit Gentreibern ausgestattet waren.
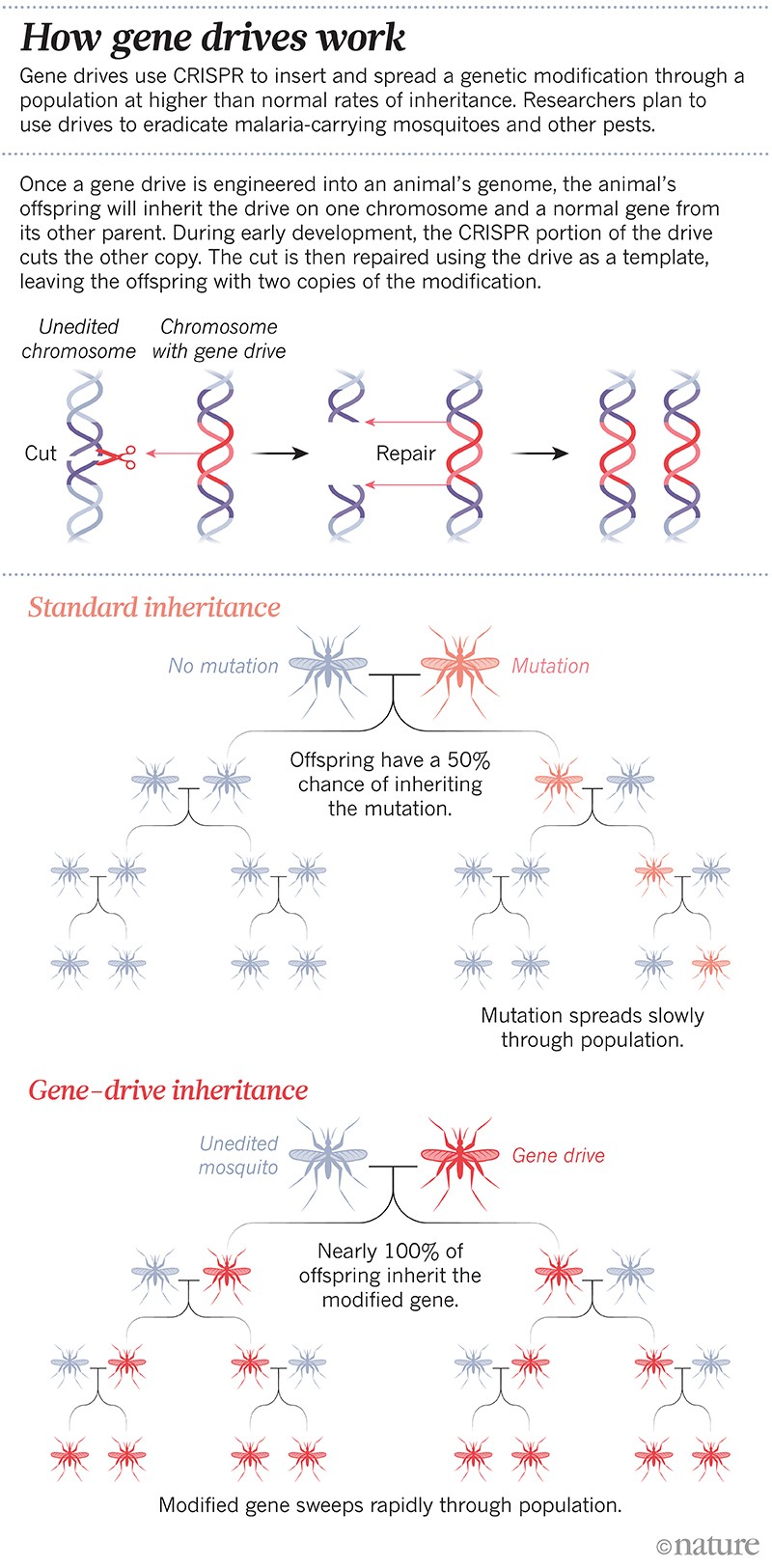
Gentreiber sind anders als alle anderen ökologischen Maßnahmen, die bisher getestet wurden, sagt Fredros Okumu, wissenschaftlicher Leiter des Ifakara Health Institute in Dar es Salaam, Tansania. „Gentriebe werden sich von selbst verbreiten“, sagt er. „
Die technischen Herausforderungen sind weniger beängstigend als die sozialen und diplomatischen, sagt der Bioingenieur Kevin Esvelt vom Massachusetts Institute of Technology (MIT) Media Lab in Cambridge, der zu den ersten gehörte, die einen CRISPR-basierten Gene Drive gebaut haben. „
Angesichts der potenziellen Bedenken gegenüber Gene Drives untersucht Nature fünf Schlüsselfragen zu dieser Technologie und ihren Anwendungen.
Werden Gene Drives überhaupt funktionieren?
Die Entwicklung eines Gene Drives zur Manipulation oder Ausrottung einer Population ist wie ein Kampf mit der natürlichen Auslese, und dieser Kampf ist möglicherweise nicht leicht zu gewinnen.
Sobald Forscher begannen, regelmäßig Gene Drives in Labors herzustellen, entwickelten Tiere eine Resistenz dagegen – sie häuften Mutationen an, die die Ausbreitung der Drives verhinderten. Bei Tests mit zwei Drives, die in Fruchtfliegen eingesetzt wurden, bildeten sich beispielsweise häufig genetische Varianten, die Resistenz verleihen2. Meistens verändern die Mutationen eine Sequenz, die CRISPR erkennen soll, so dass das Gen nicht bearbeitet werden kann. In Experimenten mit eingesperrten Moskitos beobachteten Crisanti und der Target Malaria-Forscher Tony Nolan, wie die Häufigkeit eines Gene Drives über mehrere Generationen hinweg allmählich abnahm, weil resistente Mutationen am Zielgen entstanden3. Die Ergebnisse erschütterten das Feld. Würden Resistenzen Gene Drives unwirksam machen?
Nicht unbedingt – wenn die Forscher das richtige Ziel auswählen. Einige Gene sind hoch konserviert, was bedeutet, dass jede Veränderung wahrscheinlich zum Tod ihrer Besitzer führt. Die Auswahl dieser Gene als Ziel des Antriebs bedeutet weniger Mutationen und weniger Resistenz. Im September 2018 haben Crisanti und sein Team eine Population von Anopheles gambiae-Mücken in Käfigen mit 100-prozentiger Effizienz vernichtet4, indem sie einen Antrieb herstellten, der ein Fruchtbarkeitsgen namens doublesex unterbricht. Mit diesem Antrieb können die weiblichen Mücken nicht stechen und keine Eier legen; innerhalb von 8-12 Generationen produzierten die eingesperrten Populationen überhaupt keine Eier. Und weil es für die Fortpflanzung entscheidend ist, ist Doublesex resistent gegen Mutationen, auch gegen solche, die eine Resistenz gegen ein Drive-Konstrukt bewirken würden.
Das Team hat neun Käfigexperimente mit mehr als einer Million Drive-Insertionen durchgeführt, die auf Doublesex abzielen, und konnte keine Resistenz feststellen, sagt Crisanti. Jetzt passt das Team den Drive so an, dass er nicht nur einen, sondern zwei Loci auf dem Doublesex-Gen schneidet, wie bei der Behandlung einer Krankheit mit einer Kombination von Medikamenten. „Ich möchte sicherstellen, dass die Wahrscheinlichkeit einer Resistenzentwicklung sehr, sehr gering ist, bevor ich sage, dass die Technologie einsatzbereit ist“, sagt Crisanti.
Bei Säugetieren müssen sich die Wissenschaftler mit viel grundlegenderen Herausforderungen als der Resistenz auseinandersetzen. Letztes Jahr haben Kim Cooper und ihre Kollegen von der University of California, San Diego (UCSD), die Anfänge eines Genantriebs in einem Säugetier entwickelt – ein Antrieb, der ein Mausgen, Tyr, unterbricht und das Fell der Tiere weiß macht5. Der Antrieb war nur zu 72 % effizient beim Kopieren im Genom und funktionierte nicht gut in der männlichen Keimbahn, sagt Cooper. Sie vermutet, dass dies daran liegt, dass die Zellteilung bei der Bildung von Eiern und Spermien zu unterschiedlichen Zeitpunkten stattfindet, was die Fähigkeit des Antriebs, sich erfolgreich von einem Chromosom auf ein anderes zu kopieren, zu beeinträchtigen scheint.
In diesem Experiment hat sich der Antrieb nicht selbst vermehrt und Cooper hat das Merkmal nicht über mehrere Generationen hinweg verfolgt, so dass sie betont, dass es technisch gesehen nicht als Genantrieb betrachtet werden kann. „Es gibt noch so viel zu tun, um zu zeigen, dass so etwas überhaupt machbar ist“, fügt sie hinzu.
Wofür sind Gene Drives sonst noch gut?
Obwohl Anwendungen für Moskitos das Feld dominieren, wird vorgeschlagen, Gene Drives auch zum Schutz empfindlicher Ökosysteme und zur Beschleunigung von Laborarbeiten einzusetzen.
Einige Organismen haben Genome, die schwierig zu manipulieren sind, aber dies könnte Forschern helfen, sie zu untersuchen. Ein Beispiel ist Candida albicans, ein häufig arzneimittelresistenter menschlicher Pilzerreger. Als Postdoktorandin am Broad Institute und am MIT in Cambridge, Massachusetts, hat Rebecca Shapiro ein System6 entwickelt, mit dem sich Mutationen mit nahezu 100 %iger Effizienz in den Pilz einschleusen lassen. Sie kann den Pilz nun so züchten, dass er zwei unabhängige Gene ausschaltet und diese Mutationen an seine Nachkommen vererbt. „Es funktioniert wahnsinnig effizient“, sagt Shapiro, die jetzt an der Universität von Guelph in Kanada arbeitet. An der UCSD setzt Cooper Gene-Drives für einen ähnlichen Zweck ein, um komplexe Eigenschaften bei Mäusen zu erzeugen und zu untersuchen.
Das Programm Genetic Biocontrol of Invasive Rodents (GBIRd) will mit Gene-Drive-Mäusen mehr tun, als sie im Labor zu untersuchen. GBIRd, eine Partnerschaft von Universitäten, Regierungen und Nichtregierungsorganisationen, die von der gemeinnützigen Gruppe Island Conservation geleitet wird, will die Technologie nutzen, um invasive Nagetiere auf Inseln zu beseitigen, wo sie der einheimischen Tierwelt Schaden zufügen. Derzeit werden zu diesem Zweck Pestizide eingesetzt, die jedoch teuer und auf größeren Inseln mit menschlicher Bevölkerung nur schwer zu verwenden sind. Sie sind nur auf etwa 15 % der Inseln durchführbar, sagt Royden Saah, GBIRd-Programmleiter. „
Die GBIRd-Mitglieder David Threadgill von der Texas A&M University in College Station und Paul Thomas von der University of Adelaide in Australien arbeiten an der Entwicklung von Gendrive-Technologien bei Mäusen, doch Saah schätzt, dass es noch einige Jahre dauern wird, bis diese Antriebe erfolgreich arbeiten werden.
In der Zwischenzeit hoffen einige Mückenforscher, etwas Subtileres als die vollständige Ausrottung von Insektenpopulationen als Mittel zur Krankheitsvorbeugung zu versuchen. In einer Vorabveröffentlichung vom Mai7 haben Omar Akbari und seine Kollegen an der UCSD Aedes aegypti-Mücken so manipuliert, dass sie einen Antikörper exprimieren, der die Insekten gegen alle vier Hauptstämme von Dengue schützt. Sie bringen diesen Antikörper nun an einem Antrieb an, um zu sehen, ob er sich ausbreiten wird. Akbari baut auch einen Allzweck-Genantrieb, der ein Toxin aktiviert, wenn irgendein Virus, nicht nur Dengue, A. aegypti infiziert. „Wir wollen ein trojanisches Pferd in den Moskito einbauen“, sagt Akbari. „Wenn eine Mücke mit einem Virus infiziert wird – sei es Dengue, Zika, Chikungunya, Gelbfieber oder was auch immer – wird unser System aktiviert, das die Mücke tötet.“
Können Gene Drives kontrolliert werden?
Bevor Kevin Esvelt jemals einen einzigen CRISPR-basierten Gene Drive gebaut hat, wachte er schweißgebadet auf und dachte über die Auswirkungen nach. „Mir wurde klar, dass es hier nicht nur um Malaria geht, sondern dass jeder, der eine transgene Fruchtfliege herstellen kann, damit alle Fruchtfliegen verändern könnte.“
Es überrascht daher nicht, dass Esvelt und der Genetiker George Church 2014, als sie an der Harvard Medical School in Boston, Massachusetts, ihren ersten Genantrieb bauten, gleichzeitig einen Umkehrantrieb bauten, um den ursprünglichen Antrieb auf Kommando zu überschreiben8.
Der Rest des Feldes hat nachgezogen und Genantriebe mit eingebauten Kontrollen, externen Umkehrungen oder beidem entwickelt. Der größte Teil dieser Bemühungen wird von der US Defense Advanced Research Projects Agency (DARPA), der Forschungsabteilung des US-Verteidigungsministeriums, finanziert. Im Jahr 2017 gab das DARPA-Programm „Safe Genes“ bekannt, dass es 65 Millionen US-Dollar für sieben US-Forschungsteams ausgibt, die untersuchen, wie Genantriebe kontrolliert, bekämpft und rückgängig gemacht werden können. „Wir entschärfen das Missbrauchspotenzial, ob versehentlich oder schändlich“, sagt Renee Wegrzyn, die Programmleiterin für Safe Genes.
Esvelt, der in der ersten Phase des Programms gefördert wurde, entwickelte einen sich selbst erschöpfenden Antrieb, den sogenannten Daisy Drive. Der Antrieb ist so konstruiert, dass er ein Glied nach dem anderen verliert, so als würde man eine Blume von einer Kette pflücken, die vom Kopf bis zum Stiel verbunden ist, bis er sich über mehrere Generationen erschöpft.
Am UCSD entwickelt Akbaris von der DARPA finanziertes Team Genantriebe, die sich nicht über eine Zielpopulation von Moskitos oder Fliegen hinaus ausbreiten sollen. Ein solcher Antrieb erfordert eine kontinuierliche Freisetzung über viele Generationen hinweg. Wenn diese Freisetzungen aufhören, wird das Gen mit Wildtyp-Versionen des Gens verdünnt und löscht sich innerhalb von vier Jahren selbst aus. Das könnte lange genug sein, um ein Virus wie Zika oder Dengue aus einer Mückenpopulation zu eliminieren, sagt Akbari. „Meiner Meinung nach ist diese Methode ein wenig sicherer und dennoch ziemlich effektiv. Das Team hat bereits mehrere Versionen dieser Antriebe für A. aegypti, den Hauptüberträger des Dengue-Virus, hergestellt10.
Das Target Malaria-Team entwickelt außerdem eine von der DARPA finanzierte Gegenmaßnahme, um die Ausbreitung des Double-Sex-Antriebs in einer Population zu stoppen.
Wie können Genantriebe getestet werden?
Anstelle eines Feldversuchs – den der DARPA-Vertrag über sichere Gene ausdrücklich verbietet und für den die Technologie nach Ansicht der Forscher noch nicht ausgereift ist – vergrößern die Teams Käfigexperimente und bauen ökologische Modelle, um die Vorteile und Risiken einer Freisetzung in freier Wildbahn sicher zu erforschen.
In der Stadt Terni in Mittelitalien haben Crisanti und Nolan ihre Mückenkäfige mit wechselnden Umweltbedingungen angereichert. „Wir wollen das Projekt ausweiten, um es mit verschiedenen genetischen Hintergründen und unter realistischeren Bedingungen zu testen“, sagt Nolan, der jetzt ein Labor an der Liverpool School of Tropical Medicine in Großbritannien leitet. Er und Crisanti wollen das natürliche Paarungsverhalten nachbilden – z. B. Männchen, die Schwärme bilden, um Weibchen anzulocken -, um zu sehen, wie sich dies auf die Ausbreitung eines Gentriebs auswirkt.
Die Dynamik der Ausbreitung des Gentriebs in diesen Käfigen ist bisher „vielversprechend“, sagt Crisanti – der Antrieb wird effizient und ohne Anzeichen von Widerstand weitergegeben. Wenn in den größeren Käfigexperimenten keine Bedenken auftauchen, wird das Team die Technologie an unabhängige Gruppen zur Erprobung weitergeben, um in etwa drei Jahren die behördliche Zulassung zu erhalten, sagt er.
Das Target-Malaria-Team erstellt auch ökologische Modelle für künftige Freisetzungsorte, um die Dynamik vor Ort zu ermitteln. Die jüngste Studie11 modelliert Mückenpopulationen in mehr als 40.000 Siedlungen in Burkina Faso und den umliegenden Ländern. Dabei werden Flüsse, Seen und Niederschläge sowie Felddaten über die Mückenbewegungen berücksichtigt. Die Ergebnisse11 zeigen, dass eine wiederholte Einführung modifizierter Moskitos über einige Jahre hinweg in verschiedenen Dörfern erforderlich ist, um die Gesamtzahl der Insekten zu verringern.
„Die Theorie besagt, dass sich die Moskitos bei einmaliger Freisetzung im Prinzip über den ganzen Kontinent ausbreiten würden. In der Realität würde das nur sehr langsam geschehen“, sagt der Populationsbiologe Charles Godfray von der Universität Oxford (Großbritannien), ein Mitarbeiter von Target Malaria und leitender Forscher der Studie.
Eine weitere Sorge ist, dass Gene Drives das Potenzial haben, ganze Populationen und damit ganze Ökosysteme zu verändern. Theoretisch könnten sie sich auch negativ auf die menschliche Gesundheit auswirken, indem sie dazu führen, dass der Malariaparasit ansteckender wird oder von einem anderen Wirt getragen wird, sagt die Molekularbiologin und Bioethikerin Natalie Kofler. Sie ist die Gründungsdirektorin der Gruppe Editing Nature an der Yale University in New Haven, Connecticut, die sich weltweit mit der Umweltgentechnik befasst. „Diese Technologie hat das Potenzial, ungeheuer mächtig zu sein und den Lauf der Dinge zu verändern, den wir vielleicht nicht vorhersagen können“, sagt Kofler.
Wer entscheidet, wann ein Gene Drive eingesetzt wird?
Bei Medikamentenversuchen kann ein Unternehmen bereits ein oder zwei Jahre im Voraus mit den Vorbereitungen für einen Feldversuch beginnen. Gentriebe brauchen mehr Zeit, sagt Okumu. Letztes Jahr gehörte er einer 15-köpfigen wissenschaftlichen Arbeitsgruppe an, die von der Foundation for the National Institutes of Health organisiert wurde und eine Reihe von Empfehlungen12 für den Einsatz von gentechnisch gesteuerten Moskitos in Afrika südlich der Sahara vorlegte.
In dem Bericht wird betont, dass Regierungen, Gemeinden und lokale Wissenschaftler Zeit brauchen, um die wissenschaftlichen Erkenntnisse zu verarbeiten und in die Lage versetzt zu werden, die Technologie zu regulieren. „Ich sage das aus voller Überzeugung – letztendlich sind es die Länder selbst, die diese Entscheidungen am besten treffen können“, sagt Okumu.
2017 versammelte Kofler eine Gruppe von Wissenschaftlern und Ethikern, um sich mit den gesellschaftlichen Fragen rund um Gene Drives13 auseinanderzusetzen. „Die wichtigsten Fragen drehen sich um Gerechtigkeit“, sagt Kofler. Bei Diskussionen über die Freisetzung eines gentechnisch veränderten Organismus in einer afrikanischen Umgebung haben Gruppen, die historisch gesehen an den Rand gedrängt wurden, ein Recht darauf, Teil des Entscheidungsprozesses zu sein, sagt sie.
Okumu möchte, dass afrikanische Wissenschaftler die Gene-Drive-Technologie vor Ort entwickeln und testen, was Respekt und die Bereitschaft von Geldgebern erfordert, solche Bemühungen zu unterstützen. „Die Menschen fürchten das Unbekannte, und das Unbekannte wird derzeit aus westlicher Sicht präsentiert“, sagt Okumu. „Ich freue mich auf den Tag, an dem wir diese Konstrukte in unseren eigenen Labors bauen und auf diese Weise lokales Vertrauen aufbauen können.“
Im August 2018 erteilte die Nationale Behörde für biologische Sicherheit von Burkina Faso Target Malaria die Genehmigung zur Freisetzung eines Stammes genetisch veränderter steriler männlicher Moskitos, der ersten ihrer Art auf dem afrikanischen Kontinent. In der vergangenen Woche setzte das Team etwa 6.400 Moskitos frei, die gentechnisch verändert wurden, aber keine Gentriebe enthalten. Die Wissenschaftler hoffen, dass die Freisetzung die Wahrnehmung der Forschung verbessern und Daten für künftige Freisetzungen liefern wird.
Und obwohl die Mäuse mit Gentreibern noch lange nicht für die Freisetzung bereit sind, arbeitet GBIRd bereits mit Risikobewertern, Ethikern und Ökologen zusammen, um eine Insel für einen ersten Feldversuch zu finden. „Wir wollen sicherstellen, dass wir es richtig machen“, sagt Saah. „Unabhängig davon, wie schnell sich die Technologien weiterentwickeln, können wir jetzt die Sozialwissenschaften und die Ethik voranbringen“
Leave a Reply