Pot nivelurile FT3 să faciliteze detectarea inflamației sau a catabolismului și a malnutriției la pacienții dializați? | Nefrología
INTRODUCERE
Funcția tiroidiană alterată care afectează pacienții eutiroidieni cu afecțiuni severe a fost asociată cu scăderea supraviețuirii. Ne referim la sindromul T3 scăzut pentru a descrie alterările funcției tiroidiene care afectează un procent ridicat din populație (până la 75% dintre pacienții spitalizați)1 și care implică o scădere a FT3, T4 liberă (FT4) normală sau ușor scăzută și tirotropină (TSH) normală. Aceste modificări sunt interpretate ca fiind un mecanism de adaptare a organismului în fața bolii și apar atunci când există o scădere a conversiei periferice a T4 și FT3, fără a fi prezentă o boală specifică tiroidei. O prevalență ridicată a nivelurilor scăzute de FT3 a fost, de asemenea, descrisă la pacienții cu boală cronică de rinichi (CKD) fără antecedente de boală tiroidiană2 , iar nivelurile de FT3 au fost identificate ca factori predictivi independenți de mortalitate atât la pacienții cu hemodializă (HD)3 , cât și la cei cu dializă peritoneală (PD)4 . Nu se știe dacă cauza acestei reduceri a FT3 este doar mecanismul fiziologic de adaptare care reduce metabolismul de bază atunci când boala este prezentă, sau dacă este o alterare asociată cu IRC sau dializă, iar corectarea ei ar putea contribui la îmbunătățirea supraviețuirii acestor pacienți. Nivelul FT3 poate fi scăzut la pacienții cu IRC din cauza diferitelor mecanisme, cum ar fi: 1) malnutriția: O scădere a aportului alimentar ar putea duce la o reducere a conversiei T4 în FT3 și, în final, la scăderea producției de energie și la oprirea catabolismului proteic; 2) inflamația: În IRC, apare o inflamație cronică care poate fi, de asemenea, asociată cu scăderea FT3 în timpul dializei;4,5 3) insuficiența renală în sine: Aceasta este cauzată de acumularea de toxine uremice care alterează funcția tiroidiană, cum ar fi acidoza metabolică sau scăderea excreției de iod; sau de alterări asociate cu tehnicile de dializă, cum ar fi utilizarea heparinei în timpul HD sau mici pierderi de T4 sau T3 în efluentul peritoneal.2 Prin urmare, funcția tiroidiană redusă la pacienții dializați ar putea fi un marker al malnutriției-inflamației sau ar putea fi secundară insuficienței renale cronice sau tehnicii particulare de dializă utilizate.
Scopul principal al acestui studiu a fost evaluarea incidenței sindromului T3 scăzut care afectează pacienții stabili aflați în dializă (HD și PD) și asocierea sa cu diferiți markeri ai malnutriției și inflamației.
MATERIAL ȘI METODĂ
Este un studiu descriptiv, transversal, la care au participat pacienți cronici dializați (32 în HD și 11 în PD) în Spitalul General din Segovia în luna aprilie 2008. Toți pacienții se aflau în dializă cronică de cel puțin 3 luni și erau stabili din punct de vedere clinic. „Stabil” a fost definit ca fiind fără internări în spital, infecții sau boli intercurente înregistrate în luna anterioară studiului. Unsprezece pacienți au fost excluși ulterior din studiu: Patru din cauza unei afecțiuni tiroidiene identificate anterior și șapte care luau medicamente care ar putea afecta funcția tiroidiană.
TSTH, FT4 și FT3 ale secțiunii transversale au fost măsurate prin imunoanaliză bazată pe electrochimiluminiscență (ECLIA), folosind un analizor E170 (Roche Diagnostics, Mannheim, Germania). Sensibilitatea pentru testele TSH, FT4 și FT3 a fost de 0,005mcU/l, 0,3pmol/l și, respectiv, 0,4pmol/l. Valorile de referință au fost: TSH 0,4-5mcU/l, FT4 11-23pmol/l și FT3 3,9-6,8pmol/l. Am măsurat anticorpii antitiroidieni (anti-TPO și anti-TG) cu ajutorul unui test de imunoabsorbție (Aeskulisa Aesku Diagnostics, Germania) pentru a exclude bolile autoimune (valorile peste 150U/ml pentru anti-TPO sau 50U/ml pentru TG au fost considerate pozitive). În același timp, au fost testați parametrii biochimici și hematologici asociați cu nutriția și inflamația: albumină, prealbumină, transferrină, colesterol, hematocrit, creatinină, pH, bicarbonat și proteina C reactivă (CRP), folosind metode de laborator de rutină în spitalul nostru. Nivelurile hormonului de creștere (GH) și ale factorului de creștere asemănător insulinei (IGF-1) au fost, de asemenea, stabilite prin radioimunodozare într-un laborator de referință. Valorile sunt exprimate în ng/ml. Testele au fost efectuate înainte de prima ședință de dializă a săptămânii; pacienții care urmau să fie supuși la dializă după-amiaza au fost instruiți să postească cu cel puțin patru ore înainte.
Aportul mediu de calorii și de proteine zilnice a fost stabilit cu ajutorul anchetei dietetice pe trei zile (programul software Dietsource 3.0 NovartisÆ) și a fost corectat în funcție de greutatea ideală a pacientului. A fost înregistrat procentul de lipide și carbohidrați, precum și aportul de sodiu, potasiu și fosfor.
Starea nutrițională a pacientului a fost evaluată cu ajutorul măsurătorilor antropometrice care au fost efectuate la mijlocul săptămânii după dializă folosind tehnici standard6 și au inclus: înălțimea, greutatea, indicele de masă corporală (IMC), pliul cutanat triceps (TSF), circumferința brațului (AC) și circumferința musculară a brațului (AMC). Rezultatele au fost standardizate prin calcularea procentului pentru fiecare caz în raport cu percentila 50 a datelor obținute de la o populație de adulți spanioli normali de aceeași vârstă și sex7,8 , considerând deficite moderate-severe acele cazuri care au fost peste 80% din populația normală.
Pentru a obține o evaluare mai precisă a stării nutriționale și a compoziției corporale, s-a efectuat o analiză vectorială de bioimpedanță (BIVA) la mijlocul săptămânii după dializă (BIA vectorială 101; Akern, Florencia, Italia), care a măsurat rezistența (R), reactanța (Xc), unghiul de fază (PA), schimbul sodiu-potasiu (I Na/K), apa corporală totală (TBW), apa extracelulară (ECW), apa intracelulară (ICW), masa celulară, indicele de masă celulară (masă celulară/înălțime2) (BCMI), masa adipoasă (FM), masa liberă de grăsime (FFM) și masa musculară. Aceste date au fost comparate cu valorile subiecților normali de aceeași vârstă și greutate.9
Comorbiditatea a fost estimată cu ajutorul indicelui Charlson, modificat de Beddhu.10 Doza de dializă a fost măsurată prin calcularea KT/V, iar aportul de proteine a fost estimat pe baza ratei catabolice proteice normalizate pentru greutatea curentă (nPCR).
Analiză statistică
Analiza statistică a fost efectuată cu ajutorul pachetului software SPSS, versiunea 11.0 pentru Windows. Valorile au fost exprimate ca procente sau medii ± SD; o valoare de p
REZULTATE
Caracteristicile clinice ale celor 32 de pacienți pot fi găsite în tabelul 1. Media KT/V la HD a fost de 1,6 ± 0,27, iar la PD media KT/V săptămânală a fost de 2,07 ± 0,27.
Valorile medii ale hormonilor tiroidieni au fost următoarele: TSH 2,2 ± 1,5mcU/ml, FT4 14,7 ± 2,3pmol/l și FT3 4,0 ± 0,71pmol/l. Doar doi pacienți (6,3%) au prezentat valori scăzute ale FT4 și alți doi pacienți au prezentat valori crescute ale TSH, în timp ce 17 pacienți (53,1%) au prezentat niveluri scăzute ale FT3. Nu am găsit nicio corelație între nivelurile de FT3, FT4 și TSH. Niciun pacient nu a prezentat anticorpi antitiroidieni. Nu au existat diferențe semnificative între nivelurile de FT3 în funcție de sex (4,2 ± 0,7 pentru bărbați vs. 3,8 ± 0,6 pentru femei; ns); nivelurile de FT3 au fost semnificativ mai mari la PD decât la HD (4,5 ± 0,4 vs. 3,8 ± 0,7; p = 0,016). Nu au existat diferențe în ceea ce privește nivelurile de FT3 în funcție de tipul de dializă. Cu toate acestea, pacienții cu PD au prezentat concentrații mai mari de TSH (3,5 ± 1,3 vs. 1,7 ± 1,3mcU/ml; p = 0,002), iar IMC a fost, de asemenea, mai mare la pacienții cu PD (30,6 ± 3,3 vs. 24,8 ± 4,4; p = 0,002) în comparație cu pacienții cu HD.
Pentru a determina cu ce se asociază scăderea FT3 în dializă, am comparat datele clinice, sociodemografice, analitice, antropometrice și BIVA ale pacienților cu FT3 scăzut cu valorile normale obținute în laboratorul nostru (
DISCUȚII
Recent, la un procent ridicat de pacienți dializați au fost descrise niveluri scăzute de FT32-4 care nu sunt cauzate de boli tiroidiene, ci sunt rezultatul deteriorării conversiei periferice a FT4 în FT3. Acest fenomen poate fi comparabil cu alte incidențe descrise în cazul diverselor boli cronice sau acute,1 și este cunoscut sub numele de sindromul bolnavului eutiroidian sau sindromul T3 scăzut. Cu toate acestea, CKD este diferit de restul cazurilor de sindrom bolnav eutiroidian deoarece nu este însoțit de o creștere a T3 inversă (rT3)11. Acest lucru se datorează faptului că, în ciuda faptului că clearance-ul rT3 la pacienții renali este mai scăzut, pare să existe o redistribuire a rT3 din spațiul vascular în cel extravascular și o creștere a captării celulare a rT3.
Datele noastre confirmă incidența ridicată a pacienților cu niveluri scăzute de FT3 (53%) supuși dializei și fără nicio boală tiroidiană cunoscută, care se datorează probabil unei conversii periferice deficitare a T4 și FT3, având în vedere că nivelurile de FT3 nu au fost corelate cu nivelurile de FT4 sau TSH. S-a sugerat că acumularea de toxine uremice sau acidoza metabolică poate contribui la scăderea FT3.12 Noi nu am găsit nicio legătură între nivelurile de pH și bicarbonat și nivelurile de FT3. De asemenea, nu am găsit nicio corelație cu doza de dializă măsurată cu ajutorul KT/V sau cu timpul pe care pacienții l-au petrecut în dializă. Este demn de luat în considerare faptul că, în general, dozele de dializă pentru pacienții noștri au fost ridicate (media KT/V a pacienților HD a fost de 1,6 ± 0,27, iar media săptămânală KT/V la PD a fost de 2,07 ± 0,27), iar acidoza a fost corectată relativ bine (pH 7,34 ± 0,6 și bicarbonat 22,7 ± 2,8). În ceea ce privește tipul de dializă, am constatat că pacienții dializați în PD au avut niveluri mai ridicate de FT3, ceea ce contrazice ușor rezultatele anticipate, având în vedere că în PD se pot aștepta pierderi mai mari de T4 și T3 în efluent.13 Cu toate acestea, s-a demonstrat, de asemenea, că aceste pierderi sunt minime: Mai puțin de 10μg de T4 și mai puțin de 0,1μg de T3 pe zi, ceea ce reprezintă mai puțin de 10% și, respectiv, 1% în ceea ce privește rata de producție de T4 și T3. În consecință, constatările noastre confirmă faptul că lipsa conversiei periferice ca răspuns la malnutriție este mult mai importantă decât pierderea peritoneală, iar în cazul acestui studiu, pacienții cu PD au înregistrat rezultate nutriționale mai bune, inclusiv un IMC mai mare. Coincidem cu constatările altor autori și considerăm că scăderea FT3 la pacienții dializați este în principal răspunsul adaptativ al organismului la boală, cu scopul de a reduce metabolismul de bază și de a evita catabolismele.2 În cazul bolilor cronice, uneori este dificil de stabilit dacă scăderea FT3 este cauzată de activitatea bolii sau de malnutriția asociată cu activitatea bolii. Funcția tiroidiană nu este alterată doar de post, ci și de compoziția dietei; prin urmare, o scădere a aportului de carbohidrați determină o reducere mai mare a FT3 decât o scădere a aportului de proteine. Un aport caloric insuficient, chiar și cu un aport proteic adecvat, poate provoca „sindromul bolnavului eutiroidian”.14 Nu am găsit nicio corelație între nivelurile de FT3 și aportul caloric total (kcal/zi) sau aportul caloric corectat în funcție de greutatea ideală sau reală. De asemenea, nu am găsit diferențe în compoziția dietei între pacienții cu FT3 normal și cei cu FT3 scăzut și, din acest motiv, suntem reticenți în a susține ipoteza că o scădere a FT3 la pacienții dializați se datorează unui aport insuficient. Cu toate acestea, am găsit o asociere între nivelurile de FT3 și unii parametri biochimici și antropometrici ai malnutriției, cum ar fi prealbumina, transferrina, IMC, AC, AMC sau masa musculară măsurată cu ajutorul bioimpedanței. Prin urmare, se pare că nivelurile de FT3 sunt asociate cu malnutriția, dar nu cu lipsa aportului caloric. În plus, am constatat o corelație inversă cu nivelurile de CRP. În timpul infecțiilor sau sepsisului există o reducere a hormonilor tiroidieni prin diverse mecanisme, însă, în mod fundamental, aceasta se produce din cauza unei scăderi a conversiei periferice a FT4 în T3. Reducerea hormonilor tiroidieni este asociată cu severitatea procesului15 și se pare că, cel puțin în parte, este mediată de citokine.16,17 Inflamația cronică care apare în IRC pare, de asemenea, să fie asociată cu o scădere a FT3 în HD.4,5 În studiile realizate de Zocalli et al. s-a constatat o scădere a nivelurilor de FT3 la ambele tipuri de pacienți dializați în comparație cu subiecții sănătoși; aceștia indică, de asemenea, că nivelurile de FT3 se corelează invers cu nivelurile de interleukină 6 și CRP. Trebuie luată în considerare și posibilitatea ca scăderea FT3 să fie rezultatul bolii sau al vârstei, care este asociată cu o reducere a metabolismului energetic de bază, însă în studiul nostru nu am găsit nicio corelație între FT3 și vârstă sau comorbiditate în general, însă a existat o corelație cu parametrii de inflamație.
Recent, Societatea Internațională de Nutriție și Metabolism Renal (ISRNM)18 a sugerat înlocuirea termenului de „malnutriție” cu cel de „risipă proteino-energetică” (PEW) pentru a defini această situație care afectează pacienții dializați, având în vedere că „malnutriție”, în sensul cel mai strict al cuvântului, înseamnă „aport insuficient”, iar situația care se observă adesea la acești pacienți este un metabolism alterat (metabolism excesiv sau lipsă de anabolism), favorizat de citokine inflamatorii, care duce la pierderea rezervelor de proteine sau de energie. Credem că o scădere a FT3 este un mecanism de adaptare al organismului pentru a se apăra de irosirea proteinelor, care nu este cauzată de o lipsă de aport, ci mai degrabă de inflamație sau de lipsa substanțelor anabolizante care sunt asociate cu CKF. Ținând cont de acest lucru, rezultatele unui studiu realizat de Lim et al.2 sunt interesante, deoarece, deși dozele de FT3 administrate subiecților normali nu au modificat bilanțul proteic, pacienții cu HD cu niveluri scăzute de FT3 au prezentat un catabolism crescut. Aceste date sugerează că pacienții care înregistrează o scădere a conversiei periferice a T4 în FT3 se apără de o situație catabolică și că T3 ar agrava malnutriția proteică prin creșterea catabolismului.
În prezent, nu există încă un marker fiabil pentru masa musculară și catabolismul proteic la pacienții dializați, având în vedere că generarea serică de creatinină sau uree poate fi afectată de doza de dializă. Conform recomandărilor ISRNM18 , pierderea masei musculare ar trebui inclusă în criteriile PEW, având în vedere că aceasta poate fi foarte importantă atât din punct de vedere clinic, cât și prognostic. Având în vedere buna corelație găsită în studiul nostru între nivelurile de FT3 și masa musculară și luând în considerare faptul că FT3 variază probabil rapid în bolile catabolice, sugerăm că nivelurile de FT3 ar trebui să fie utilizate ca indicator precoce al catabolismului și ca marker pentru a măsura răspunsul la anumite terapii care au ca scop tratarea acestuia, de exemplu, pentru a evalua răspunsul la suplimentele nutriționale sau la substanțele anabolizante.
CONCLUZII
Jumătate dintre pacienții noștri dializați au prezentat niveluri scăzute de FT3 în ser, fără alterarea TSH sau FT4 (sindromul FT3 scăzut). Această reducere pare să fie cauzată de alterarea conversiei periferice a FT4 în FT3. Aceste niveluri se corelează în mod fundamental cu parametrii de malnutriție și inflamație și ar putea fi considerate un marker precoce pentru catabolism sau PEW.
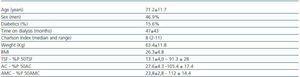
Tabel 1. Caracteristici sociodemografice și antropometrice
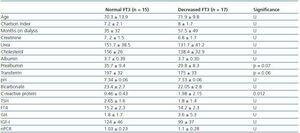
Tabelul 2. Diferențe sociodemografice și analitice între pacienții cu FT3 normal (>3,95) și pacienții cu FT3 scăzut
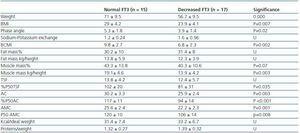
Tabel 3. Diferențe antropometrice și BIVA între pacienții cu FT3 normal (> 3,95) și pacienții cu FT3 scăzut
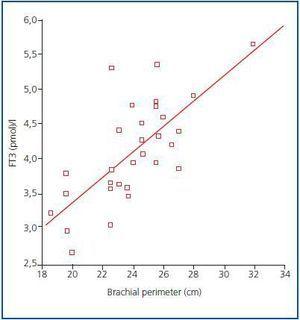
Figura 1.
Leave a Reply