De ce #”HF „# are un punct de fierbere mai mic decât apa chiar dacă #”F „# este mai electronegativ decât #”O „#?
Există mulți factori complicați. Iată ce am putut găsi:
- Apa poate forma o rețea de legături de hidrogen mai echilibrată (doi acceptori și doi donatori, în loc de un donator și trei acceptori), ceea ce face ca sistemul masiv să interacționeze mai uniform și, prin urmare, să fie mai puternic ca întreg.
- Apa formează o rețea de legături de hidrogen mai extinsă (un mediu local tetraedric tridimensional, în loc de un mediu bidimensional în zigzag), ceea ce face ca sistemul masiv să fie mai puțin ușor de vaporizat.
- Apa are, în general, un unghi de interacțiune mai optim, deoarece se potrivește mai bine cu geometria electronică a moleculei și aliniază interacțiunile de-a lungul dipolului molecular, în timp ce #”HF „# ar avea o legătură de hidrogen mai puternică (în termeni de numere brute) dacă interacțiunile ar fi liniare.
DISCUȚIE: RĂSPUNS LUNG! De asemenea, foarte vizual.
Legătura de hidrogen este cea mai puternică forță intermoleculară atât în #”HF „# cât și în #”H”_2 „O „#. Puterea de interacțiune depinde de distanța de interacțiune, de unghiul de interacțiune și de extensivitatea rețelei.
Când extragem toate interacțiunile de legătură de hidrogen și presupunem că apa pură și #”HF „# pur, obținem (izolând un set select de molecule dintr-o matrice infinită)#””^()##””^()#:
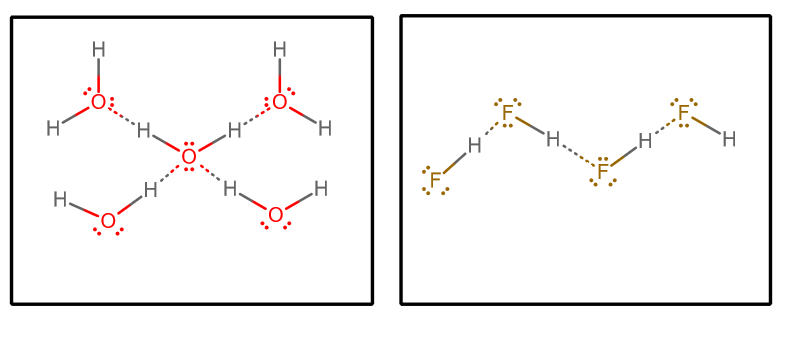
Apoi am putea lua în considerare câțiva factori:
- Numărul de donatori și acceptori de legături de hidrogen
Care moleculă de apă poate accepta două interacțiuni de legături de hidrogen (prin intermediul perechilor lone) și poate dona două interacțiuni de legături de hidrogen (prin intermediul hidrogenilor).
Pe de altă parte, fiecare moleculă de #”HF „# acceptă trei interacțiuni de legătură de hidrogen (prin intermediul perechilor singuratice) și donează doar una (prin intermediul hidrogenului).
Se poate argumenta atunci că apa are o rețea de legături de hidrogen mai echilibrată, ceea ce face ca sistemul în vrac să fie mai puțin capabil să se vaporizeze în general. Acest lucru ar susține punctul de fierbere mai ridicat al apei față de #”HF „#.
- Electronegativitățile #bb(„F”)# și #bb(„O”)#
#”F „# este mai electronegativ, deci își păstrează mai ușor densitatea de electroni; astfel, se așteaptă ca perechile singure să fie donatori mai slabi de interacțiuni de legătură de hidrogen decât perechile singure de pe #”O „#.
Aceasta ar părea să prezică faptul că fiecare interacțiune individuală de legătură de hidrogen este mai slabă, ceea ce ar susține punctul de fierbere mai ridicat al apei față de #”HF „#, DAR acest lucru este contrazis de următorul punct.
- Intensitatea medie brută a legăturilor de hidrogen în #bb(„HF”)# vs. #bb(„HF”)#. apă
#”O”-„H „cdotcdotcdot: „O”-#, #DeltaH_(„H”-„legătură”) ~~ „21 kJ/mol „#
#”F”-„H „cdotcdotcdot: „F”-#, #DeltaH_(„H”-„legătură”) ~~ „161.5 kJ/mol „#
Aceste date din Wikipedia sugerează că #”HF „# are interacțiuni de legătură de hidrogen mai puternice între moleculele de #”HF „# decât în apă.
Aceasta nu ar susține dovada experimentală că #”HF „# are un punct de fierbere mult mai mic, dar și aceasta este doar o cifră brută și nu ia în considerare, să zicem, unghiurile de interacțiune în sistemul masiv.
- Unghiurile de legătură de hidrogen observate și dimensiunile interacțiunii
#”HF „#, fiind o moleculă liniară, s-a văzut că are interacțiuni de legătură de hidrogen în zigzag, în două dimensiuni, cu unghiuri de #116^@#. Un unghi mai optim ar fi la #180^@#, deoarece astfel s-ar obține interacțiuni dipolare mai directe. Acest lucru limitează puterea legăturii de hidrogen a #”HF „#.
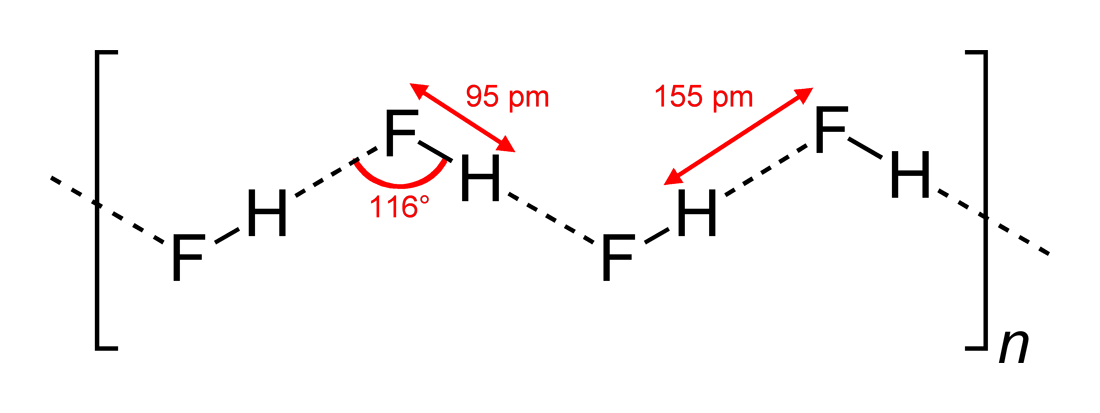
Apa, fiind o moleculă curbată cu o geometrie electronică tetraedrică, poate realiza legături de hidrogen în trei dimensiuni.
Iată un exemplu de cluster tetraedric găsit în mediul local al unei interacțiuni de legătură de hidrogen în apă:
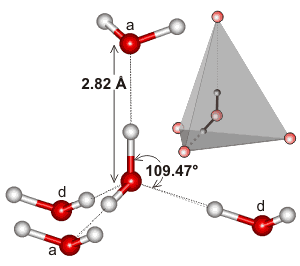
Se poate ca extensivitatea rețelei de legături de hidrogen și modul în care aceasta tinde să se potrivească cu geometria electronică a apei să fie ceea ce face ca punctul de fierbere al apei să fie atât de ridicat. Acest lucru ar susține punctul de fierbere mai ridicat al apei față de #”HF „#.
În general, aceștia sunt factorii cel mai puțin contestați la care m-am putut gândi:
- Apa poate realiza o rețea de legături de hidrogen mai echilibrată (doi acceptori și doi donatori, în loc de un donator și trei acceptori), ceea ce face ca sistemul în ansamblu să interacționeze mai uniform și astfel să fie mai puternic ca întreg.
- Apa formează o rețea de legături de hidrogen mai extinsă (un mediu local tetraedric tridimensional, în loc de un mediu bidimensional în zigzag), făcând ca sistemul masiv să fie mai puțin ușor de vaporizat.
- Apa are, în general, un unghi de interacțiune mai optim, deoarece se potrivește mai bine cu geometria electronică a moleculei și aliniază interacțiunile de-a lungul dipolului molecular, în timp ce #”HF „# ar avea legături de hidrogen mai puternice (în termeni de numere brute) dacă interacțiunile ar fi liniare.
Leave a Reply