Ce este electronegativitatea?
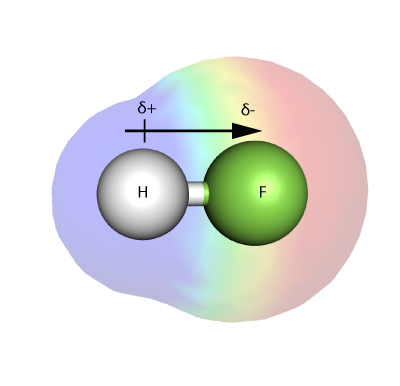
ELECTRONEGATIVITATEA
Electronegativitatea este o măsură a intensității cu care un atom – într-o moleculă – este capabil să atragă electronii într-o legătură către el însuși.
Factori care influențează electronegativitatea:
1) Numărul atomic
Numărul atomic este numărul de protoni din nucleul unui atom.
Determină proprietățile chimice ale unui element și locul său în tabelul periodic.
Cu cât numărul atomic este mai mare, cu atât electronegativitatea este mai puternică.
2) Raza atomică
Raza atomică a unui element chimic se măsoară, de obicei, prin distanța de la centrul nucleului până la limita celui mai exterior strat de electroni.
Cu cât razele atomice sunt mai mari, cu atât electronegativitatea este mai slabă.
Exemplu de rază atomică a unui atom de oxigen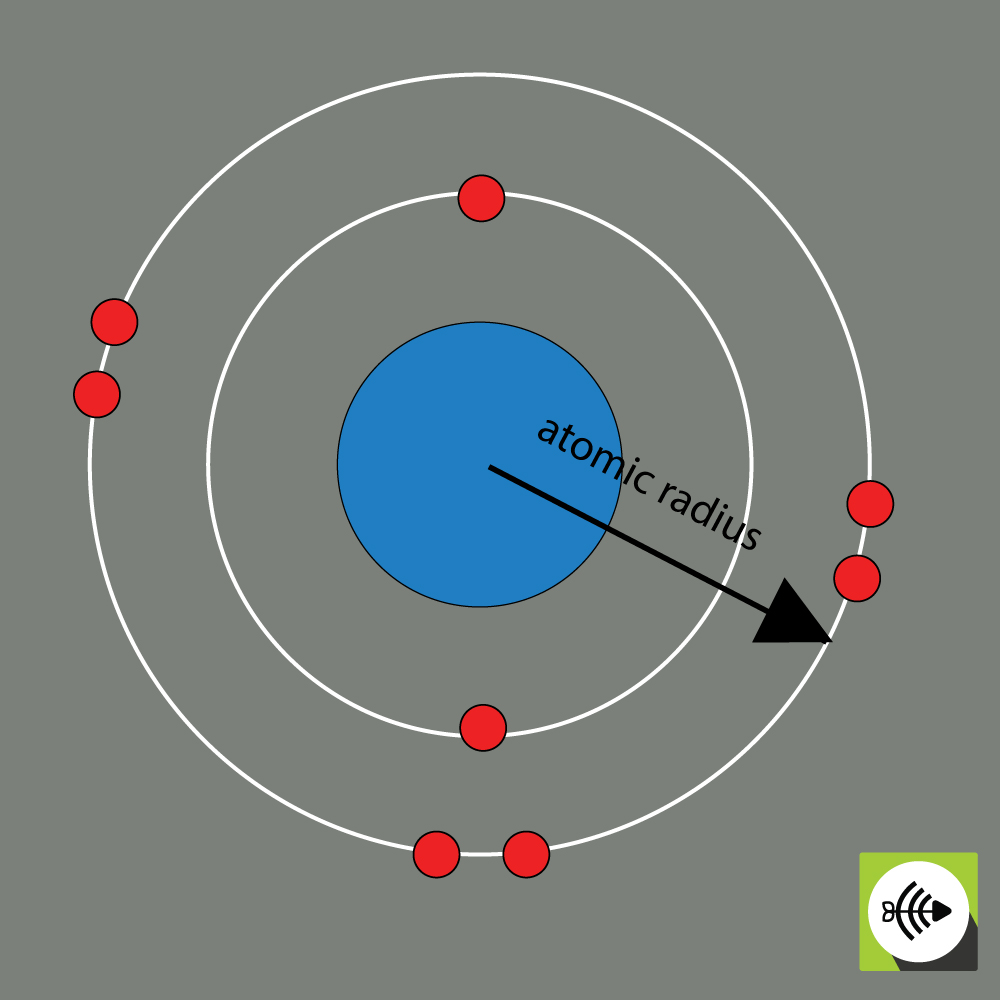
Cum se măsoară electronegativitatea?
Cea mai comună măsurătoare pentru electronegativitate este scara Pauling, concepută de Linus Pauling, dublu laureat al premiului Nobel. Scara de electronegativitate pentru elemente spune cât de puternic poate atrage fiecare element (unul față de celălalt) electronii de legătură către el însuși. Cu cât numărul de electronegativitate este mai mare, cu atât mai mult atomul va încerca să atragă electronii spre el.
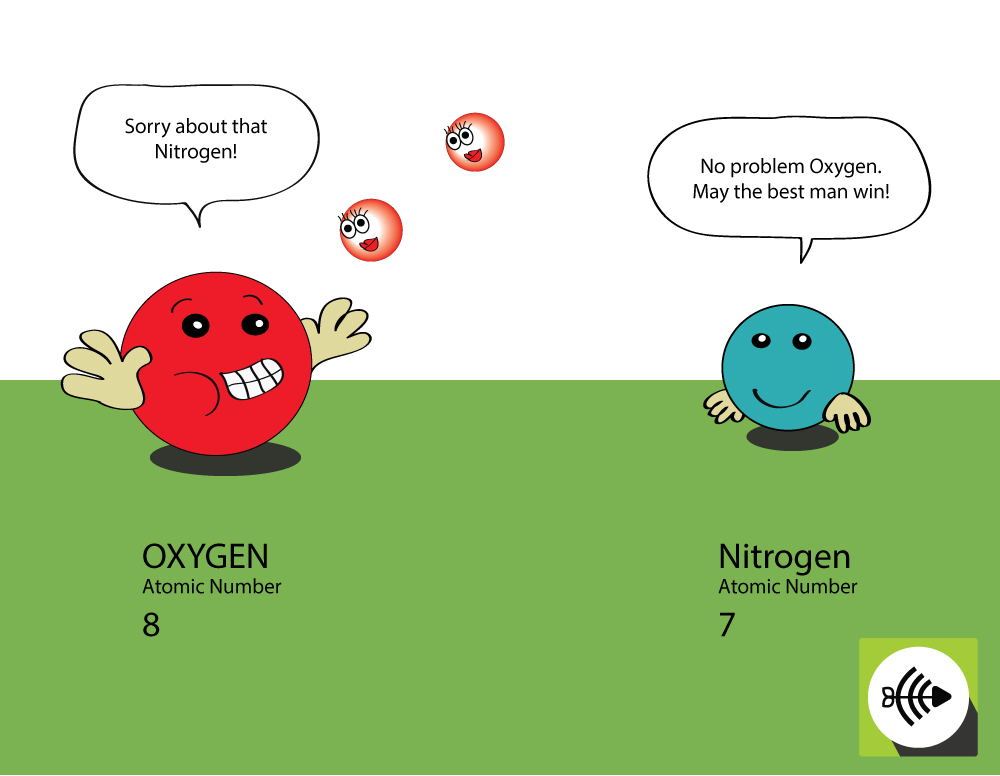
De ce este oxigenul mai electronegativ decât azotul?
Oxigenul are un număr atomic mai mare
- Oxigenul are 8 protoni în nucleu, în timp ce azotul are doar 7.
- O pereche de electroni de legătură va resimți o atracție mai mare din partea nucleului oxigenului decât din partea nucleului azotului, astfel că electronegativitatea oxigenului este mai mare.
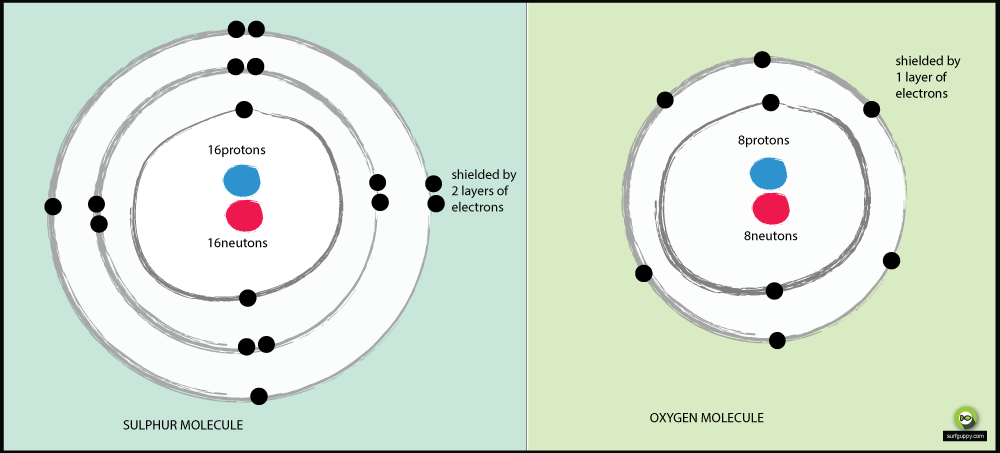
De ce este sulful mai puțin electronegativ decât oxigenul?
Motive pentru care oxigenul este mai electronegativ decât sulful:
- Oxigenul are 2 nivele energetice, sulful are 3
- Electronii de legătură din sulf sunt mai departe de nucleul atomului
- Când electronii de legătură sunt mai departe de nucleul atomului, există mai puțină atracție din partea nucleului
- Parechea de electroni de legătură din oxigen va resimți mai multă atracție din partea nucleului său decât electronii de legătură din sulf
- În consecință, oxigenul este un atom mai electronegativ
Vă rugăm să citiți despre electronii de valență înainte de a continua. Electroni de valență

Astomul mai mic are o electronegativitate mai mare
Tendințe ale electronegativității prezente în tabelul periodic
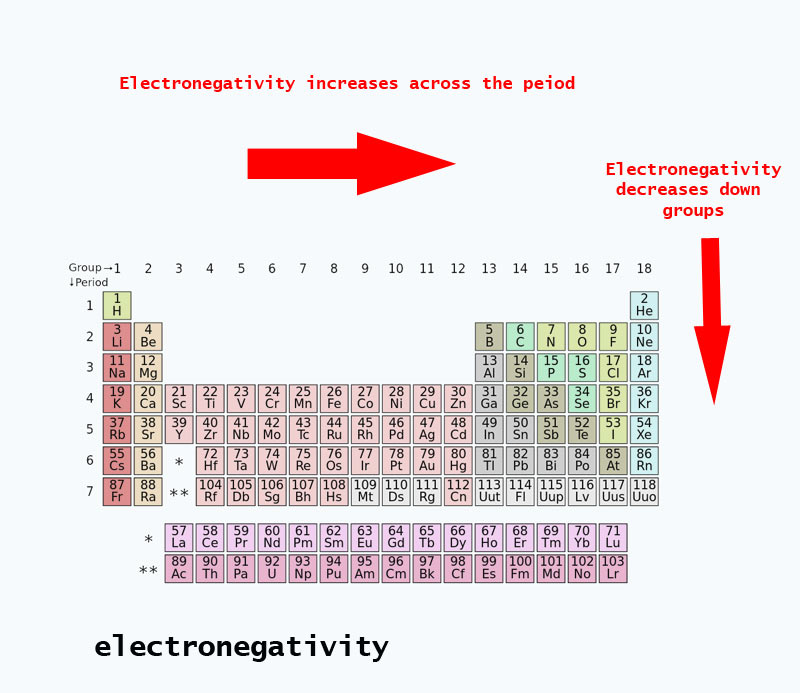
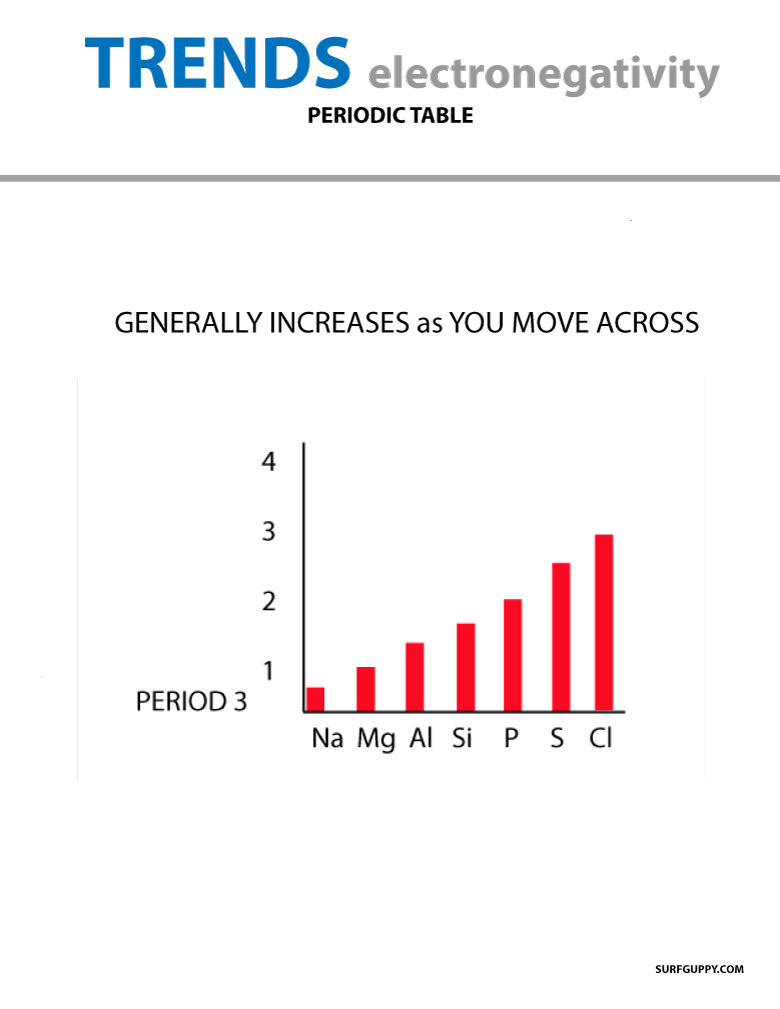
Când vă deplasați în tabelul periodic, numărul de protoni din nucleu crește (fără a crește nivelul energetic), prin urmare electronegativitatea crește.
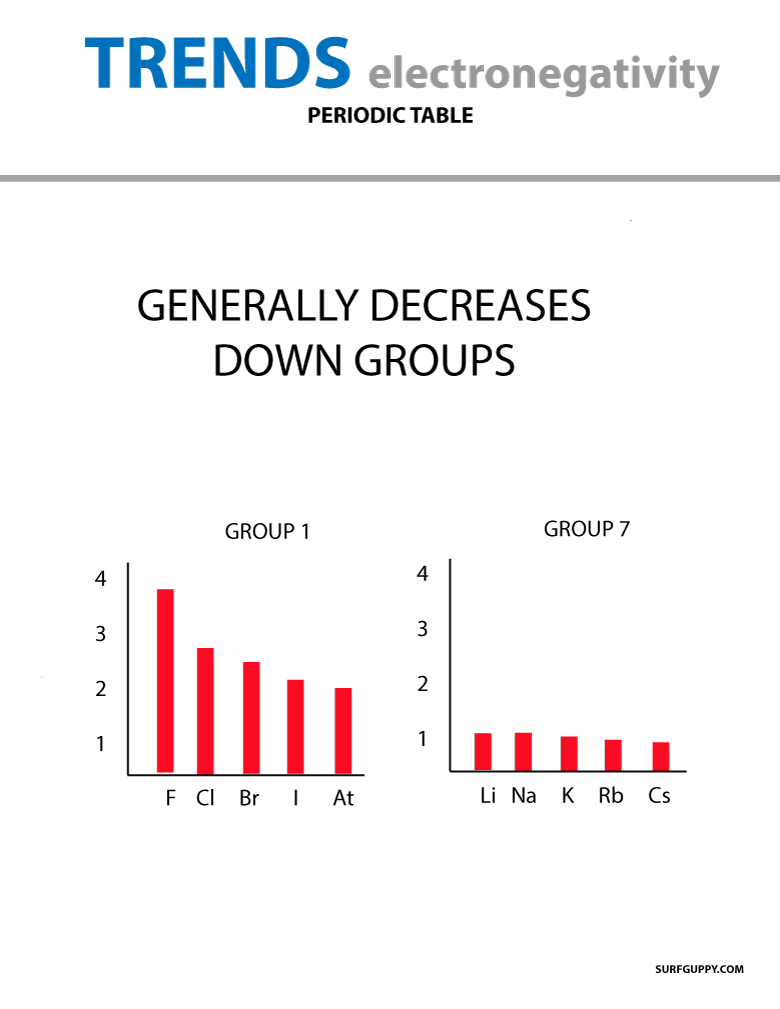
Când numărul atomic crește în josul unei grupe, există, de asemenea, o creștere a nivelurilor energetice. Raza atomică este mai mare, prin urmare, electronegativitatea scade.
TABELUL PERIODIC AL ELECTRONEGATIVITĂȚII
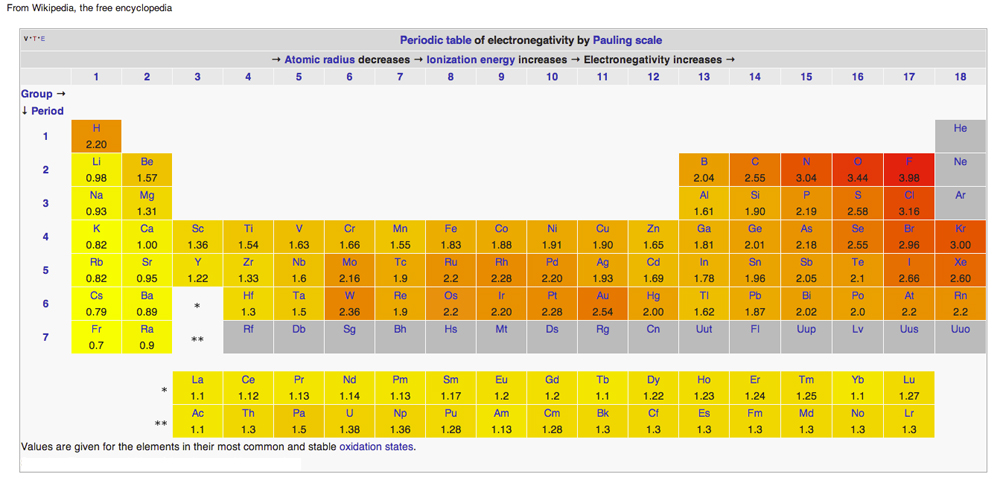 Diagramă de pe Wikipedia emisă sub Licențe Creative Common
Diagramă de pe Wikipedia emisă sub Licențe Creative Common
.
Leave a Reply