8.3: Gaze și presiune
Obiective de învățare
- Descrierea fazei gazoase.
Faza gazoasă este unică printre cele trei stări ale materiei prin faptul că există câteva modele simple pe care le putem folosi pentru a prezice comportamentul fizic al tuturor gazelor – indiferent de identitatea lor. Nu putem face acest lucru pentru stările solide și lichide. De fapt, dezvoltarea acestei înțelegeri a comportamentului gazelor reprezintă punctul de demarcație istoric dintre alchimie și chimia modernă. Primele progrese în înțelegerea comportamentului gazelor au fost făcute la mijlocul anilor 1600 de către Robert Boyle, un om de știință englez care a fondat Royal Society (una dintre cele mai vechi organizații științifice din lume).
Cum se face că putem modela toate gazele independent de identitatea lor chimică? Răspunsul se află într-un grup de afirmații numite teoria cinetică a gazelor:
- Gazele sunt compuse din particule mici care sunt separate de distanțe mari.
- Particulele de gaz sunt în continuă mișcare, suferind coliziuni cu alte particule de gaz și cu pereții recipientului lor.
- Viteza particulelor de gaz este legată de temperatura unui gaz.
- Particulele de gaz nu experimentează nicio forță de atracție sau de respingere între ele.
Ați observat că niciuna dintre aceste afirmații nu are legătură cu identitatea gazului? Acest lucru înseamnă că toate gazele ar trebui să se comporte în mod similar. Un gaz care respectă perfect aceste afirmații se numește gaz ideal. Majoritatea gazelor prezintă mici abateri de la aceste afirmații și se numesc gaze reale. Cu toate acestea, existența gazelor reale nu diminuează importanța teoriei cinetice a gazelor.
Unul dintre enunțurile teoriei cinetice menționează coliziunile. Deoarece particulele de gaz sunt în continuă mișcare, ele se ciocnesc, de asemenea, în mod constant între ele și cu pereții recipientului lor. Există forțe implicate pe măsură ce particulele de gaz ricoșează în pereții recipientului (Figura \(\PageIndex{1}\)). Forța generată de particulele de gaz împărțită la suprafața pereților recipientului dă presiunea. Presiunea este o proprietate pe care o putem măsura pentru un gaz, dar de obicei nu luăm în considerare presiunea pentru solide sau lichide.
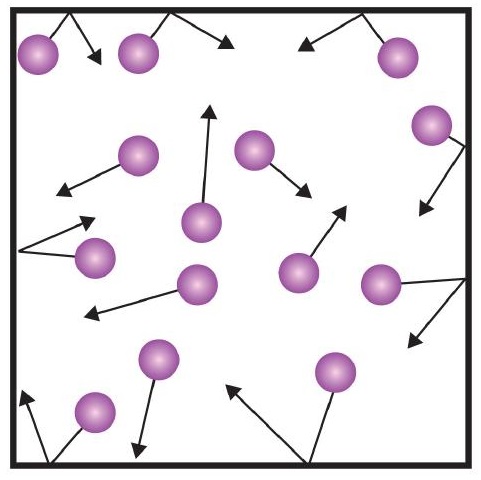
Unitatea de bază a presiunii este newtonul pe metru pătrat (N/m2). Această unitate combinată este redefinită ca pascal (Pa). Un pascal nu este o cantitate foarte mare de presiune. O unitate de presiune mai utilă este barul, care reprezintă 100.000 Pa (1 bar = 100.000 Pa). Alte unități comune de presiune sunt atmosfera (atm), care a fost definită inițial ca fiind presiunea medie a atmosferei terestre la nivelul mării; și mmHg (milimetri de mercur), care reprezintă presiunea generată de o coloană de mercur de 1 mm înălțime. Unitatea milimetri de mercur se mai numește și torr, după numele savantului italian Evangelista Torricelli, care a inventat barometrul la mijlocul anilor 1600. O definiție mai precisă a atmosferei, în termeni de torr, este că există exact 760 torr în 1 atm. Un bar este egal cu 1,01325 atm. Având în vedere toate relațiile dintre aceste unități de presiune, abilitatea de a converti de la o unitate de presiune la alta este o abilitate utilă.
Exemplu \(\PageIndex{1}\): Conversia presiunilor
Scrieți un factor de conversie pentru a determina câte atmosfere sunt în 1,547 mmHg.
Soluție
Pentru că 1 mmHg este egal cu 1 torr, presiunea dată este, de asemenea, egală cu 1,547 torr. Deoarece există 760 torr în 1 atm, putem folosi acest factor de conversie pentru a face conversia matematică:
\(\mathrm{1,547\: torr\times \dfrac{1\: atm}{760\: torr}=2.04\: atm}\)
Notați cum unitățile de torr se anulează algebric.
Exercițiu \(\PageIndex{1}\): Conversia presiunilor
Scrieți un factor de conversie pentru a determina câți milimetri de mercur sunt în 9,65 atm.
Răspuns
\(\mathrm{9,65\: atm\times \dfrac{760\: mm Hg}{1\: atm}=7,334 \: mm Hg}\).
Teoria cinetică afirmă, de asemenea, că nu există nici o interacțiune între particulele individuale de gaz. Deși știm că există, de fapt, interacțiuni intermoleculare în gazele reale, teoria cinetică presupune că particulele de gaz sunt atât de îndepărtate încât particulele individuale nu se „simt” între ele. Astfel, putem trata particulele de gaz ca pe niște mici bucăți de materie a căror identitate nu este importantă pentru anumite proprietăți fizice.
Exercițiu de revizuire a conceptelor
-
Ce este presiunea și ce unități de măsură folosim pentru a o exprima?
Răspuns
-
Presiunea este forța pe unitatea de suprafață; unitățile sale de măsură pot fi pascals, torr, milimetri de mercur sau atmosfere.
Înțelesul cheie
- Faza gazoasă are anumite proprietăți generale caracteristice acestei faze.
Exerciții
-
Ce este teoria cinetică a gazelor?
-
Potrivit teoriei cinetice a gazelor, particulele individuale de gaz sunt (întotdeauna, frecvent, niciodată) în mișcare.
-
De ce un gaz exercită presiune?
-
De ce teoria cinetică a gazelor ne permite să presupunem că toate gazele vor avea un comportament similar?
-
Aranjați următoarele mărimi de presiune în ordine de la cea mai mică la cea mai mare: 1 mmHg, 1 Pa și 1 atm.
-
Ce unitate de presiune este mai mare – torrul sau atmosfera?
-
Câți torri sunt în 1.56 atm?
-
Convertiți 760 torr în pascali.
-
Presiunea sângelui se exprimă în milimetri de mercur. Care ar fi tensiunea arterială în atmosfere dacă tensiunea arterială sistolică a unui pacient este de 120 mmHg, iar tensiunea arterială diastolică este de 82 mmHg? (În medicină, o astfel de tensiune arterială ar fi raportată ca „120/82”, vorbit ca „o sută douăzeci peste optzeci și doi”.)
-
În prognoza meteo, presiunea barometrică este exprimată în inci de mercur (in. Hg), unde sunt exact 25,4 mmHg la fiecare 1 in. Hg. Care este presiunea barometrică în milimetri de mercur dacă presiunea barometrică este raportată ca fiind de 30,21 in. Hg?
Răspunsuri
-
Gazele sunt compuse din particule mici care sunt separate de distanțe mari. Particulele de gaz sunt în continuă mișcare, suferind ciocniri cu alte particule de gaz și cu pereții recipientului lor. Viteza particulelor de gaz este legată de temperatura unui gaz. Particulele de gaz nu experimentează nicio forță de atracție sau de respingere între ele.
-
Un gaz exercită presiune pe măsură ce particulele sale ricoșează pe pereții recipientului său.
-
1 Pa, 1 mmHg și 1 atm
-
1.190 torr
9. 0,158 atm; 0,108 atm
10. 767,3 mm Hg
.
Leave a Reply