Țânțari care se autodistrug și rozătoare sterilizate: promisiunea motoarelor genetice
Austin Burt și Andrea Crisanti au încercat timp de opt ani să deturneze genomul țânțarilor. Ei doreau să ocolească selecția naturală și să introducă o genă care să se răspândească în populație mai repede decât o mutație transmisă prin procesul obișnuit de moștenire. În mintea lor era o modalitate de a preveni malaria prin răspândirea unei gene care să elimine populațiile de țânțari, astfel încât aceștia să nu poată transmite boala.
Crisanti își amintește că a eșuat de nenumărate ori. Dar, în cele din urmă, în 2011, cei doi geneticieni de la Imperial College din Londra au primit rezultatele ADN la care sperau: o genă pe care o inseraseră în genomul țânțarilor a iradiat în întreaga populație, ajungând la peste 85% din descendenții insectelor1.
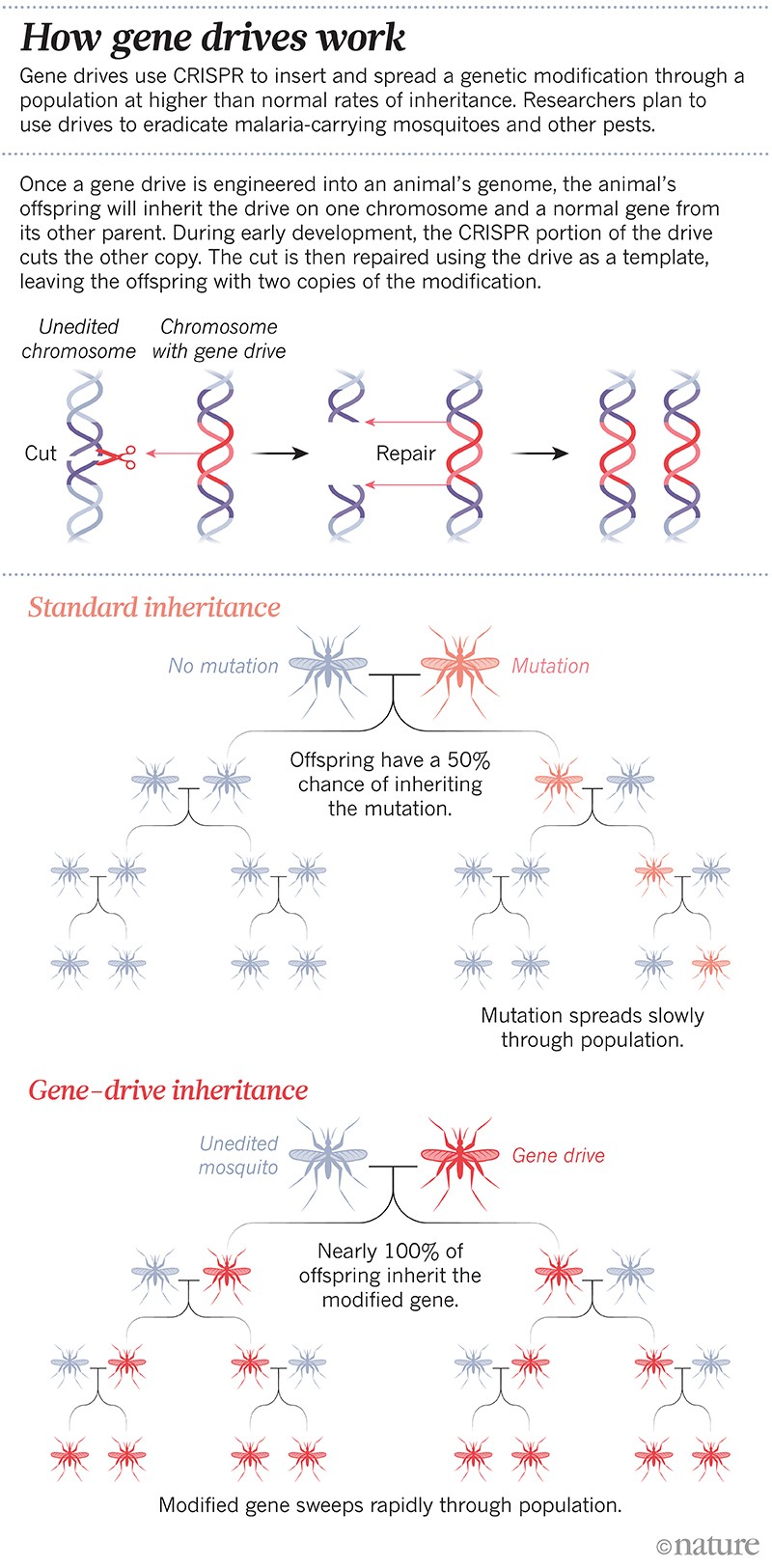
A fost primul „gene drive” proiectat: o modificare genetică concepută pentru a se răspândi într-o populație cu rate de moștenire mai mari decât cele normale. Gene drive-urile au devenit rapid o tehnologie de rutină în unele laboratoare; oamenii de știință pot acum să pregătească un drive în câteva luni. Tehnica se bazează pe instrumentul de editare genetică CRISPR și pe câteva bucăți de ARN pentru a modifica sau a reduce la tăcere o anumită genă sau pentru a introduce una nouă. În generația următoare, întreaga unitate se copiază pe cromozomul său partener, astfel încât genomul nu mai are versiunea naturală a genei alese, ci două copii ale unității genetice. În acest fel, modificarea este transmisă până la 100% din descendenți, în loc de aproximativ 50% (a se vedea „How gene drives work”).
Din 2014, oamenii de știință au proiectat sisteme de antrenare a genelor bazate pe CRISPR la țânțari, muște de fructe și ciuperci, iar în prezent le dezvoltă la șoareci. Dar acesta este doar începutul poveștii. Întrebările cu privire la posibilitatea unui sistem de antrenare a genelor au fost suplinite de alte necunoscute: cât de bine vor funcționa, cum să le testăm și cine ar trebui să reglementeze această tehnologie. Gene drive-urile au fost propuse ca o modalitate de a reduce sau de a elimina bolile transmise de insecte, de a controla speciile invazive și chiar de a inversa rezistența la insecticide în cazul dăunătorilor. Până în prezent, nicio unitate genetică modificată nu a fost eliberată în sălbăticie, dar, în principiu, tehnologia ar putea fi gata în termen de trei ani, spune Crisanti. El colaborează cu Target Malaria, un consorțiu internațional de cercetare non-profit care încearcă să utilizeze țânțarii cu gene pentru controlul malariei în Africa. La 1 iulie, grupul a eliberat un lot de testare de țânțari – modificați genetic, dar care nu sunt încă dotați cu motoare genetice – într-un sat din Burkina Faso.
Motorizările genetice nu seamănă cu nicio altă soluție ecologică testată până acum, spune Fredros Okumu, director științific la Institutul de Sănătate Ifakara din Dar es Salaam, Tanzania. „Gene drives se vor răspândi de la sine”, spune el. „Trebuie să pregătim oamenii și să împărtășim informații în mod deschis cu toate țările implicate.”
Provocările tehnice nu sunt la fel de înspăimântătoare ca cele sociale și diplomatice, spune bioinginerul Kevin Esvelt de la Massachusetts Institute of Technology (MIT) Media Lab din Cambridge, care a fost printre primii care au construit o unitate genetică bazată pe CRISPR. „Tehnologiile de acest tip au consecințe în lumea reală pentru viețile oamenilor care pot fi aproape imediate.”
Datorită potențialelor îngrijorări legate de mecanismele de antrenare a genelor, Nature explorează cinci întrebări cheie despre această tehnologie și aplicațiile sale.
Vor funcționa chiar și mecanismele de antrenare a genelor?
Construirea unui gene drive pentru a manipula sau eradica o populație este ca și cum ai alege o luptă cu selecția naturală, iar această luptă s-ar putea să nu fie ușor de câștigat.
De îndată ce cercetătorii au început să facă gene drives în mod regulat în laboratoare, animalele au dezvoltat rezistență împotriva lor – acumulând mutații care au împiedicat răspândirea gene drives. În testele a două drive-uri inserate în muște de fructe, de exemplu, s-au format frecvent variante genetice care confereau rezistență2. Cel mai frecvent, mutațiile modifică o secvență pe care CRISPR este setat să o recunoască, împiedicând editarea genei. În cadrul unor experimente cu țânțari în colivie, Crisanti și cercetătorul Tony Nolan de la Target Malaria au observat cum frecvența unui gene drive a scăzut treptat de-a lungul mai multor generații din cauza mutațiilor rezistente la gena țintă3. Rezultatele au zguduit domeniul. Rezistența ar face ca antrenamentele genetice să devină impotente?
Nu neapărat – dacă cercetătorii selectează ținta potrivită. Unele gene sunt extrem de conservate, ceea ce înseamnă că orice modificare este posibil să le ucidă proprietarii. Alegerea acestor gene ca țintă a drive-ului înseamnă mai puține mutații și mai puțină rezistență. În septembrie 2018, Crisanti și echipa sa au prăbușit o populație de țânțari Anopheles gambiae în cușcă cu o eficiență de 100%4 prin realizarea unui drive care întrerupe o genă a fertilității numită doublesex. Cu drive-ul în vigoare, țânțarii femele nu pot mușca și nu depun ouă; în decurs de 8-12 generații, populațiile în colivie nu au produs deloc ouă. Și pentru că este crucială pentru procreare, doublesex este rezistentă la mutații, inclusiv la cele care ar conferi rezistență la o construcție drive.
Echipa a efectuat nouă experimente în cuști cu mai mult de un milion de inserții drive care vizează doublesex și nu a observat nicio rezistență, spune Crisanti. Acum, echipa adaptează drive-ul pentru a tăia nu unul, ci doi loci de pe gena doublesex, ca și cum ar trata o boală cu o combinație de medicamente. „Vreau să mă asigur că probabilitatea de a dezvolta rezistență este foarte, foarte îndepărtată înainte de a spune că tehnologia este pregătită pentru teren”, spune Crisanti.
La mamifere, oamenii de știință trebuie să facă față unor provocări mult mai fundamentale decât rezistența. Anul trecut, Kim Cooper și colegii săi de la Universitatea din California, San Diego (UCSD), au proiectat începuturile unui gene drive la un mamifer – un drive care întrerupe o genă de șoarece, Tyr, și transformă haina animalelor în alb5. Drive-ul a avut o eficiență de numai 72% în copierea sa în genom și nu a funcționat bine în linia germinală masculină, spune Cooper. Ea bănuiește că acest lucru se datorează faptului că diviziunea celulară are loc în momente diferite în formarea ovulelor și a spermatozoizilor, ceea ce pare să afecteze capacitatea de copiere cu succes a drive-ului de la un cromozom la altul.
În acel experiment, drive-ul nu s-a autopropagat și Cooper nu a urmărit trăsătura de-a lungul mai multor generații, așa că ea subliniază că, din punct de vedere tehnic, nu poate fi considerat un drive genetic. „Mai este încă atât de mult de lucru de făcut pentru a demonstra că așa ceva este chiar fezabil”, adaugă ea.
La ce mai sunt bune mecanismele de antrenare a genelor?
Deși aplicațiile pentru țânțari domină domeniul, utilizările propuse pentru mecanismele de antrenare a genelor includ, de asemenea, conservarea ecosistemelor delicate și accelerarea lucrărilor de laborator.
Câteva organisme au genomuri care sunt dificil de manipulat, dar făcând acest lucru ar putea ajuta cercetătorii să le studieze. Să luăm exemplul Candida albicans, un agent patogen fungic uman adesea rezistent la medicamente. În calitate de cercetător postdoctoral la Broad Institute și MIT din Cambridge, Massachusetts, Rebecca Shapiro a dezvoltat un sistem6 pentru a introduce mutații în ciupercă cu o eficiență de aproape 100%. Ea poate acum să reproducă ciuperca pentru a reduce la tăcere două gene independente și să lase aceste mutații moștenire urmașilor. „Funcționează cu o eficiență nebănuită”, spune Shapiro, care în prezent lucrează la Universitatea Guelph din Canada. La UCSD, Cooper folosește gene drive într-un scop similar, pentru a crea și studia trăsături complexe la șoareci.
Programul Genetic Biocontrol of Invasive Rodents (GBIRd) vrea să facă mai mult cu șoarecii cu gene drive decât să îi studieze în laborator. GBIRd, un parteneriat de universități, guverne și organizații neguvernamentale gestionat de grupul non-profit Island Conservation, vrea să folosească tehnologia pentru a elimina rozătoarele invazive de pe insule, unde acestea fac ravagii asupra faunei sălbatice native. În prezent, în acest scop se folosesc pesticide, dar acestea sunt costisitoare și dificil de utilizat pe insulele mari cu populație umană. Acestea sunt fezabile doar pe aproximativ 15% din insule, spune Royden Saah, managerul de program al GBIRd. „Încercăm să ne uităm la tehnologii care să se ocupe de celelalte 85%.”
Membrii GBIRd, David Threadgill de la Universitatea Texas A&M din College Station și Paul Thomas de la Universitatea Adelaide din Australia, dezvoltă tehnologii de antrenare a genelor la șoareci, deși Saah estimează că vor trece mai mulți ani până când aceste antrenări vor funcționa cu succes.
Între timp, unii cercetători în domeniul țânțarilor speră să încerce ceva mai subtil decât exterminarea completă a populațiilor de insecte ca mijloc de prevenire a bolilor. Într-un preprint7 din luna mai, Omar Akbari și colegii săi de la UCSD au modificat țânțarii Aedes aegypti pentru a exprima un anticorp care a protejat insectele împotriva tuturor celor patru tulpini majore de dengue. Ei atașează acum acel anticorp la o unitate pentru a vedea dacă se va răspândi. Akbari construiește, de asemenea, o unitate genetică multifuncțională care activează o toxină atunci când orice virus, nu doar dengue, infectează A. aegypti. „Vrem să construim un cal troian în țânțar”, spune Akbari. „Când un țânțar este infectat de un virus – fie că este vorba de dengue, Zika, chikungunya, febră galbenă, orice – acesta activează sistemul nostru, care ucide țânțarul.”
Pot fi controlate mecanismele de antrenare a genelor?
Înainte ca Kevin Esvelt să construiască vreodată un singur mecanism de antrenare a genelor bazat pe CRISPR, el se trezea cu transpirații reci gândindu-se la ramificații. „Mi-am dat seama, oh, hei, acest lucru nu va fi doar despre malarie, ci va fi potențial ceva ce orice individ care poate face o muscă de fructe transgenică ar putea construi pentru a edita toate muștele de fructe.”
Nu este o surpriză, așadar, că în 2014, când Esvelt și geneticianul George Church au construit prima unitate genetică la Harvard Medical School din Boston, Massachusetts, au construit simultan o unitate de inversare pentru a suprascrie unitatea originală la comandă8.
Restul domeniului a urmat exemplul, dezvoltând unități genetice cu controale încorporate, anulări externe sau ambele. Cea mai mare parte a acestui efort este finanțată de Agenția americană pentru proiecte de cercetare avansată în domeniul apărării (DARPA), ramura de cercetare a Departamentului de Apărare al SUA. În 2017, programul „Safe Genes” al DARPA a anunțat că a cheltuit 65 de milioane de dolari americani în cadrul a șapte echipe de cercetare din SUA care studiază cum să controleze, să contracareze și să inverseze mecanismele genetice. „Atenuăm potențialul de utilizare necorespunzătoare, fie că este accidentală sau nefastă”, spune Renee Wegrzyn, managerul programului Safe Genes.
Esvelt, finanțat în faza inițială a programului, a conceput o unitate de auto-epuizare cunoscută sub numele de unitate daisy. Unitatea este proiectată să piardă câte o verigă la un moment dat, ca și cum ar smulge o floare dintr-un lanț legat de la cap la tulpină, până când se epuizează după mai multe generații9.
La UCSD, echipa lui Akbari, finanțată de DARPA, dezvoltă unități genetice care ar trebui să fie incapabile să se răspândească dincolo de o populație țintă de țânțari sau muște. Un astfel de drive necesită o eliberare continuă timp de mai multe generații. Când aceste eliberări se opresc, se diluează cu versiunile de tip sălbatic ale genei și se autodistruge în patru ani. Acest timp ar putea fi suficient pentru a elimina un virus precum Zika sau dengue dintr-o populație de țânțari, spune Akbari. „Este ceva care este, după părerea mea, un pic mai sigur și totuși destul de eficient”. Echipa a produs deja mai multe versiuni ale acestor drive-uri pentru A. aegypti, principalul vector al virusului dengue10.
Echipa Target Malaria dezvoltă, de asemenea, o contramăsură, finanțată de DARPA, pentru a opri răspândirea drive-ului doublesex într-o populație.
Cum pot fi testate drive-urile genetice?
În loc de un test pe teren – pe care contractul DARPA Safe Genes îl interzice în mod expres și pentru care cercetătorii sunt de acord că tehnologia nu este pregătită – echipele măresc experimentele în cuști și construiesc modele ecologice pentru a explora beneficiile și riscurile unei eliberări în sălbăticie în condiții de siguranță.
În orașul Terni din centrul Italiei, Crisanti și Nolan și-au îmbogățit cuștile de țânțari cu condiții de mediu schimbătoare. „Vrem să mărim amploarea pentru a o testa pe diferite medii genetice, în scenarii mai realiste”, spune Nolan, care acum conduce un laborator la Școala de Medicină Tropicală din Liverpool, Marea Britanie. El și Crisanti doresc să reproducă comportamentul natural de împerechere – cum ar fi masculii care formează roiuri pentru a atrage femelele – pentru a vedea cum afectează răspândirea unui drive genetic.
Dinamica răspândirii drive-ului în acele cuști până acum este „promițătoare”, spune Crisanti – drive-ul este transmis în mod eficient, fără semne de rezistență. Dacă nu apar probleme în experimentele cuști mai mari, atunci echipa va preda tehnologia unor grupuri independente pentru testare, în vederea obținerii aprobării de reglementare în aproximativ trei ani, spune el.
Echipa Target Malaria construiește, de asemenea, modele ecologice ale locațiilor de eliberare potențiale pentru a elabora dinamica pe teren. Cel mai recent studiu11 modelează populațiile de țânțari în peste 40.000 de așezări din Burkina Faso și din țările învecinate. Acesta ia în considerare râurile, lacurile și precipitațiile, precum și datele de pe teren privind deplasarea țânțarilor. Rezultatele11 arată că va fi nevoie de introducerea repetată, mai degrabă decât de o singură eliberare, de țânțari modificați pe parcursul a câtorva ani prin sate pentru a reduce numărul total al insectelor.
„Teoria spune că, în principiu, dacă se face o singură eliberare, aceasta se va răspândi pe tot continentul. Realitatea este că acest lucru s-ar întâmpla foarte încet”, spune biologul de populații Charles Godfray de la Universitatea din Oxford, Marea Britanie, colaborator al Target Malaria și cercetător principal al studiului.
O altă preocupare este aceea că mecanismele genetice au potențialul de a modifica populații întregi și, prin urmare, ecosisteme întregi. De asemenea, ele ar putea, în teorie, să afecteze în mod negativ sănătatea umană, determinând parazitul malariei să evolueze pentru a fi mai virulent sau pentru a fi purtat de o altă gazdă, spune biologul molecular și bioeticianul Natalie Kofler. Ea este directorul fondator al grupului Editing Nature de la Universitatea Yale din New Haven, Connecticut, care își propune să abordeze tehnologiile genetice de mediu la nivel mondial. „Această tehnologie are potențialul de a fi extrem de puternică și de a schimba cursul lucrurilor pe care s-ar putea să nu le putem prezice”, spune Kofler.
Cine decide când să folosească un gene drive?
Pentru testele cu medicamente, o companie poate începe să se pregătească pentru un test pe teren cu doar un an sau doi înainte. Gene drive-urile vor avea nevoie de mai mult timp, spune Okumu. Anul trecut, el a făcut parte dintr-un grup de lucru științific format din 15 membri, organizat de Fundația pentru Institutele Naționale de Sănătate, care a prezentat o serie de recomandări12 pentru utilizarea țânțarilor cu antrenare genetică în Africa Subsahariană.
Raportul subliniază că guvernele, comunitățile și oamenii de știință locali vor avea nevoie de timp pentru a asimila știința și pentru a fi împuterniciți să reglementeze tehnologia. „Spun acest lucru cu toată convingerea – în cele din urmă, cele mai bune persoane care pot lua aceste decizii sunt chiar țările”, spune Okumu.
În 2017, Kofler a reunit un grup de oameni de știință și specialiști în etică pentru a se confrunta cu întrebările societale din jurul motoarelor genetice13. „Principalele întrebări se concentrează în jurul justiției”, spune Kofler. În discuțiile despre eliberarea unui organism modificat genetic într-un mediu african, grupurile care au fost marginalizate din punct de vedere istoric au dreptul de a face parte din procesul de luare a deciziilor, spune ea.
Okumu dorește ca oamenii de știință africani să dezvolte și să testeze tehnologia de antrenare a genelor la nivel local, ceea ce va necesita respect și bunăvoință din partea finanțatorilor pentru a sprijini astfel de eforturi. „Oamenii se tem de necunoscut, iar necunoscutul în acest moment este prezentat dintr-o perspectivă occidentală”, spune Okumu. „Aștept cu nerăbdare ziua în care vom putea construi aceste construcții în propriile noastre laboratoare și, în acest fel, să construim încrederea la nivel local.”
În august 2018, Agenția Națională de Biosecuritate din Burkina Faso a autorizat Target Malaria să elibereze o tulpină de țânțari masculi sterili modificați genetic, prima de acest fel de pe continentul african. Săptămâna trecută, echipa a eliberat aproximativ 6.400 de țânțari care au fost modificați genetic, dar care nu adăpostesc unități genetice. Oamenii de știință speră ca această eliberare să îmbunătățească percepția asupra cercetării, precum și să furnizeze date pentru viitoarele eliberări.
Și, deși șoarecii cu gene-drive sunt departe de a fi pregătiți pentru eliberare, GBIRd lucrează deja cu evaluatori de risc, eticieni și ecologiști pentru a identifica o insulă pentru un prim test de teren. „Vrem să ne asigurăm că facem acest lucru corect”, spune Saah. „Nu contează cât de repede se mișcă tehnologiile, putem avansa științele sociale și etica acum.”
.
Leave a Reply