Por que é que #”HF “# tem um ponto de ebulição inferior à água, apesar de #”F “# ser mais electronegativo do que #”O “#?
Existem muitos factores complicados. Isto é o que eu poderia encontrar:
- A água pode fazer uma rede de ligação de hidrogênio mais equilibrada (dois aceitadores e dois doadores, em vez de um doador e três aceitadores), tornando o sistema a granel mais uniforme interagindo e, portanto, mais forte como um todo.
- A água forma uma rede de ligação de hidrogênio mais extensa (um ambiente local tetraédrico tridimensional, em vez de um ambiente bidimensional em ziguezague), tornando o sistema a granel menos facilmente vaporizável.
- A água tem geralmente um ângulo de interacção mais óptimo, uma vez que se aproxima mais da geometria electrónica da molécula e alinha as interacções ao longo do dipolo molecular, enquanto que #”HF “# teria uma ligação de hidrogénio mais forte (em termos de números brutos) se as interacções fossem lineares.
DISCLAIMER: RESPOSTA LONGA! Também muito visual.
A ligação ao hidrogênio é a força intermolecular mais forte em ambos #”HF “# e #”H”_2 “O “#. A força de interação depende da distância de interação, do ângulo de interação e da extensividade da rede.
Quando extraímos todas as interacções de ligação de hidrogénio, e assumimos água pura e pura #”HF “#, obtemos (isolando um conjunto seleccionado de moléculas de uma matriz infinita)#””^()##””^()#:
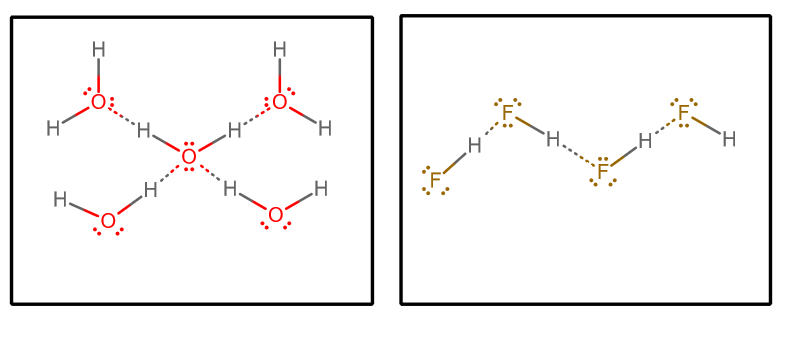
Poderíamos então considerar alguns factores:
- Número de doadores e aceitadores de hidrogênio-ligação
Cada molécula de água pode aceitar duas interações de hidrogênio-ligação (através dos pares solitários) e doar duas interações de hidrogênio-ligação (através dos hidrogênios).
Por outro lado, cada #”HF “# molécula aceita três interacções de ligação de hidrogénio (através dos pares solitários) e doa apenas uma (através do hidrogénio).
Uma poderia então argumentar que a água tem uma rede de ligação de hidrogénio mais equilibrada, o que torna o sistema a granel menos capaz de vaporizar globalmente. Isto suportaria o maior ponto de ebulição da água sobre #”HF “#.
- Electronegatividades de #bb(“F”)# e #bb(“O”)#
#”F “# é mais electronegativo, por isso agarra-se mais facilmente à sua densidade de electrões; assim, espera-se que os pares solitários sejam doadores mais fracos de interacções de ligação de hidrogénio do que os pares solitários sobre #”O “#.
Isto parece prever que cada interacção individual de ligação de hidrogénio é mais fraca, o que suportaria o maior ponto de ebulição da água sobre #”HF “#, MAS isto é contradito pelo ponto seguinte.
- Forças médias de ligação de hidrogênio bruto em #bb(“HF”)# vs. água
#”O”-“H “cdotcdotcdot: “O”-#, #DeltaH_(“H”-“bond”) ~~ “21 kJ/mol “#
#”F”-“H “cdotcdotcdot: “F”-#, #DeltaH_(“H”-“bond”) ~~ “161.5 kJ/mol “#
Estes dados da Wikipédia sugerem que #”HF “# tem interacções de ligação de hidrogénio mais fortes entre #”HF “# moléculas do que na água.
Isso não suportaria a prova experimental de que #”HF “# tem um ponto de ebulição muito mais baixo, mas isso também é apenas um número bruto e não considera, digamos, os ângulos de interação no sistema a granel.
- Abservados ângulos de ligação de hidrogênio e dimensões de interação
#”HF “#, sendo uma molécula linear, tem sido vista como tendo interações de ligação de hidrogênio em ziguezague, em duas dimensões, com ângulos de #116^@#. Um ângulo mais óptimo seria de #180^@#, uma vez que isso daria interacções dipolares mais directas. Isto limita a força de ligação de hidrogênio de #”HF “#.
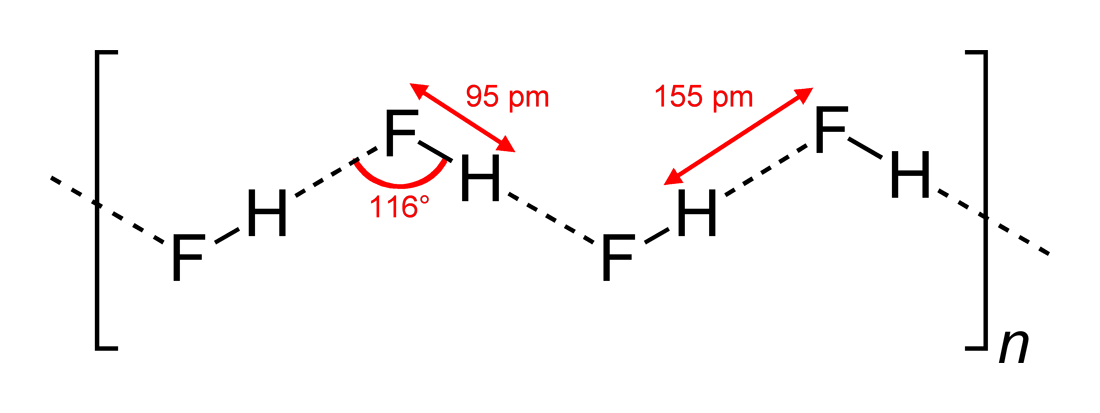
Água, sendo uma molécula dobrada com uma geometria de elétron tetraédrico, pode ligar hidrogênio em três dimensões.
Aqui está um exemplo do aglomerado tetraédrico encontrado no ambiente local de uma interacção hidrogénio-ligação em água:
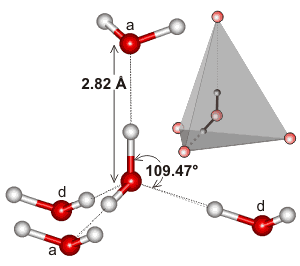
Pode ser que a extensividade da rede de hidrogénio-ligação, e como ela tende a corresponder à geometria electrónica da água, é o que torna o ponto de ebulição da água tão elevado. Isto suportaria o maior ponto de ebulição da água sobre #”HF “#.
Overtodo, estes são os factores menos desafiadores que eu poderia pensar:
- A água pode fazer uma rede de ligação de hidrogénio mais equilibrada (dois aceitadores e dois doadores, em vez de um doador e três aceitadores), tornando o sistema a granel mais uniforme interagindo e assim mais forte como um todo.
- Água forma uma rede de ligação de hidrogênio mais extensa (um ambiente local tetraédrico tridimensional, em vez de um ambiente bidimensional em ziguezague), tornando o sistema a granel menos facilmente vaporizável.
- A água geralmente tem um ângulo de interação mais otimizado, já que se aproxima mais da geometria eletrônica da molécula e alinha as interações ao longo do dipolo molecular, enquanto #”HF “# teria uma ligação de hidrogênio mais forte (em termos de números brutos) se as interações fossem lineares.
Leave a Reply