O que é Electronegatividade?
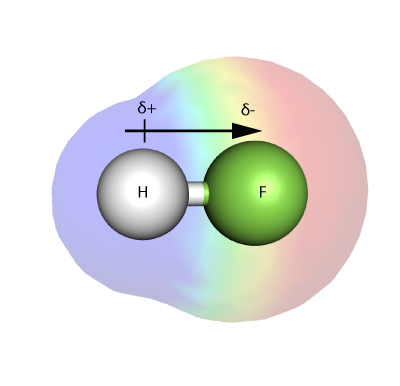
ELECTRONEGATIVIDADE
Electronegatividade é uma medida da força com que um átomo – numa molécula – é capaz de atrair electrões numa ligação a si próprio.
Factores que afectam a electronegatividade:
1) O número atómico
O número atómico é o número de prótons no núcleo de um átomo.
Determina as propriedades químicas de um elemento e o seu lugar na tabela periódica.
Quanto maior for o número atómico, mais forte é a electronegatividade.
2) O raio atómico
O raio atómico de um elemento químico é geralmente medido pela distância do centro do núcleo ao limite da camada mais externa de electrões.
Quanto maiores os raios atómicos, mais fraca a electronegatividade.
Exemplo do raio atómico de um átomo de oxigénio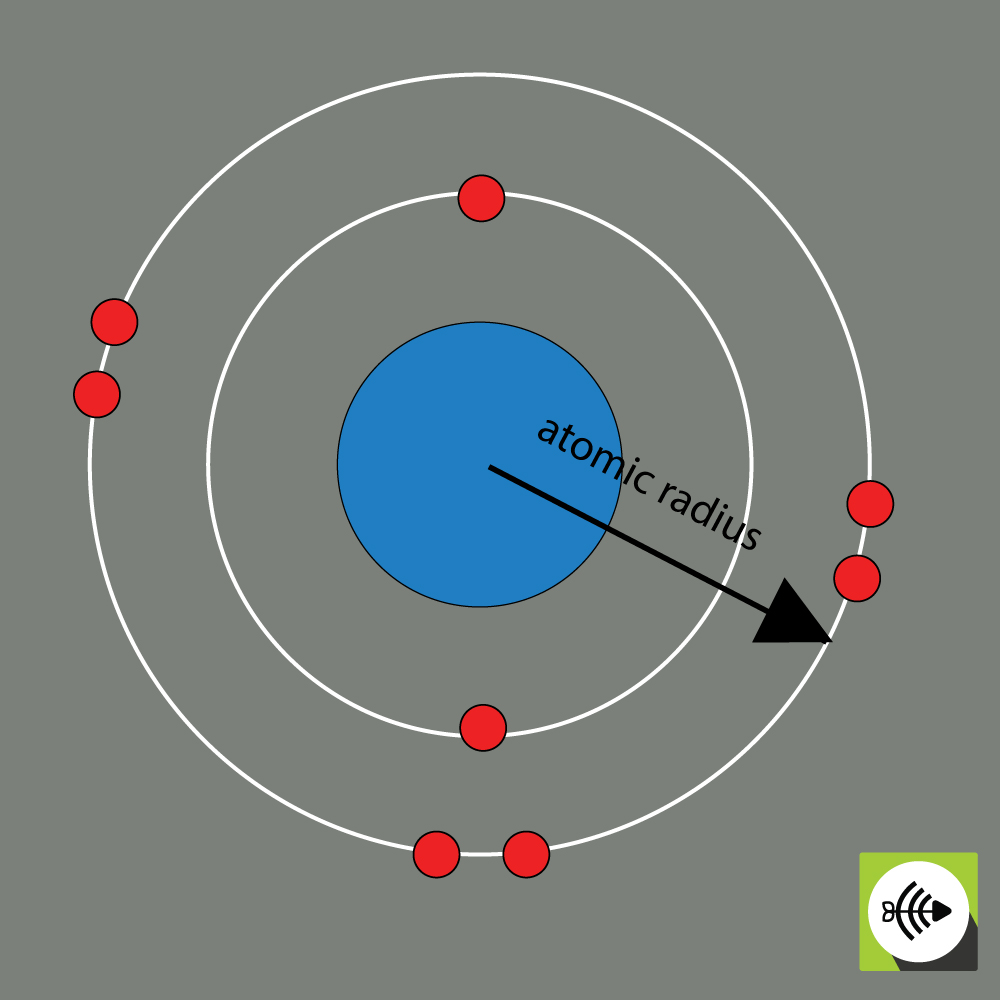
O que é a electronegatividade medida em?
A medida mais comum da electronegatividade é a escala de Pauling, desenhada por Linus Pauling, bicampeão Nobel. A escala de eletronegatividade para elementos diz quão forte cada elemento (em relação um ao outro) pode atrair os elétrons de ligação para si mesmo. Quanto maior o número de eletronegatividade, mais o átomo tentará puxar os elétrons para si mesmo.
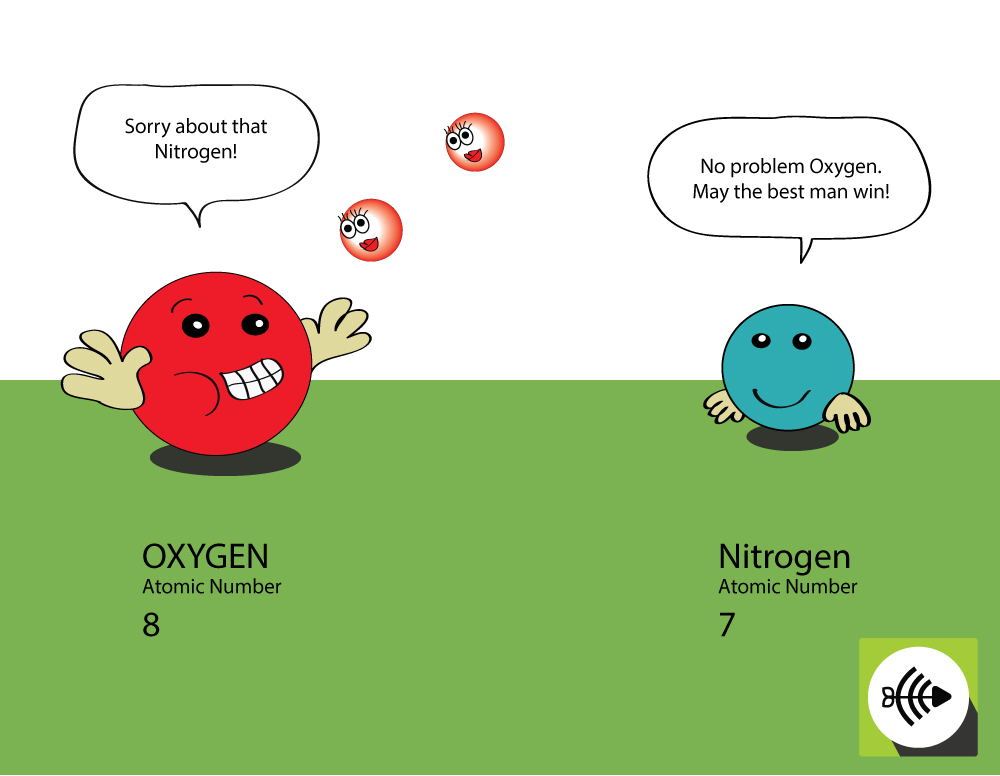
Por que o oxigênio é mais eletronegativo que o nitrogênio?
O oxigênio é maior em número atômico
- O oxigênio tem 8 prótons no núcleo enquanto o nitrogênio tem apenas 7.
- Um par de electrões de ligação irá sentir mais atracção do núcleo do oxigénio do que do azoto, assim a electronegatividade do oxigénio é maior.
Porquê o enxofre é menos electronegativo do que o oxigénio?
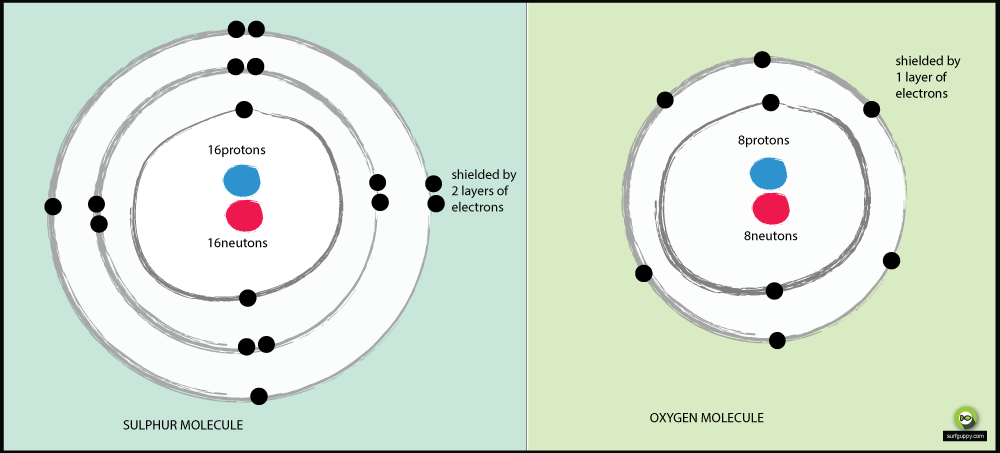
Razões pelas quais o oxigénio é mais electronegativo do que o enxofre:
- O oxigênio tem 2 níveis de energia, o enxofre tem 3
- Os elétrons de ligação no enxofre estão mais longe do núcleo do átomo
- Quando os elétrons de ligação estão mais longe do núcleo do átomo, há menos atração do núcleo
- O par de elétrons de ligação em oxigênio experimentará mais atração de seu núcleo do que os elétrons de ligação do enxofre
- O oxigênio é um átomo mais eletronegativo
Por favor, leia os elétrons de ligação em valência antes de prosseguir. Valence Electrons

O átomo menor tem uma eletronegatividade maior
Tendências de eletronegatividade presentes na tabela periódica
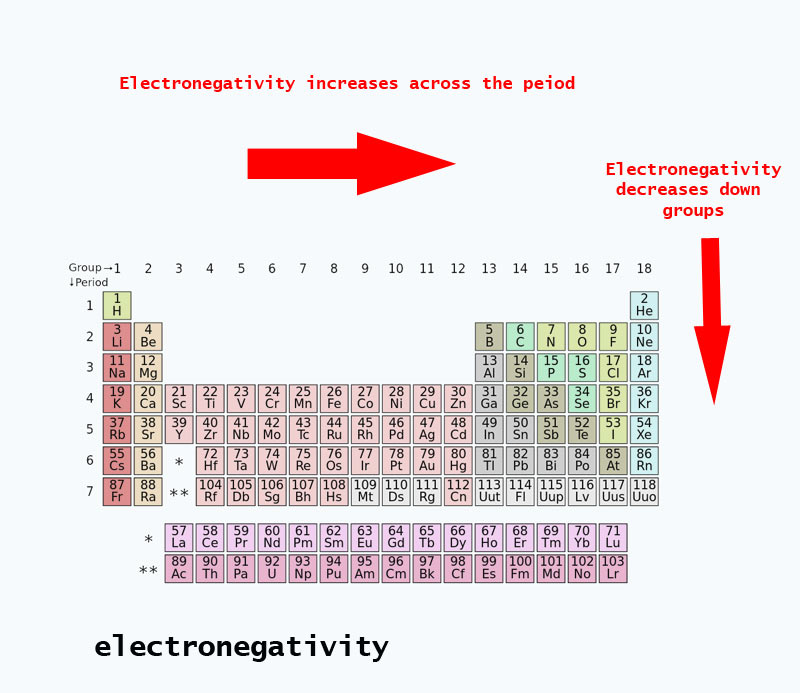
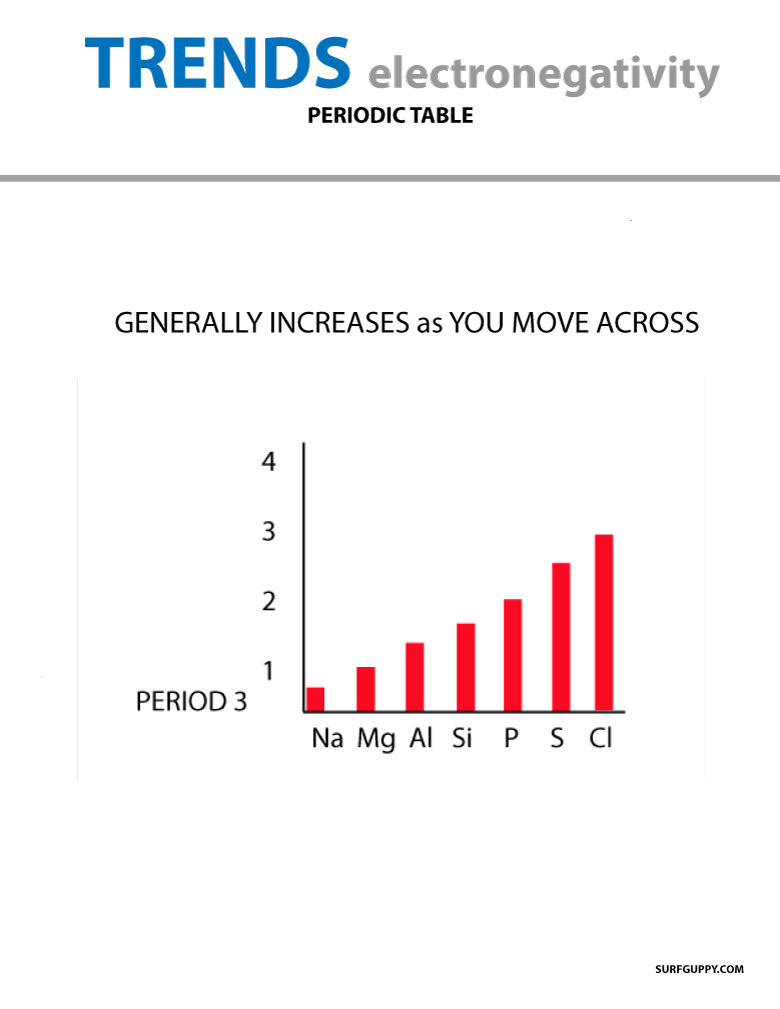
Quando você se move através da tabela periódica, o número de prótons no núcleo aumenta (sem aumento no nível de energia), portanto a eletronegatividade aumenta.
Quando o número atômico aumenta em um grupo, há também um aumento nos níveis de energia. O raio atómico é maior, portanto a electronegatividade diminui.
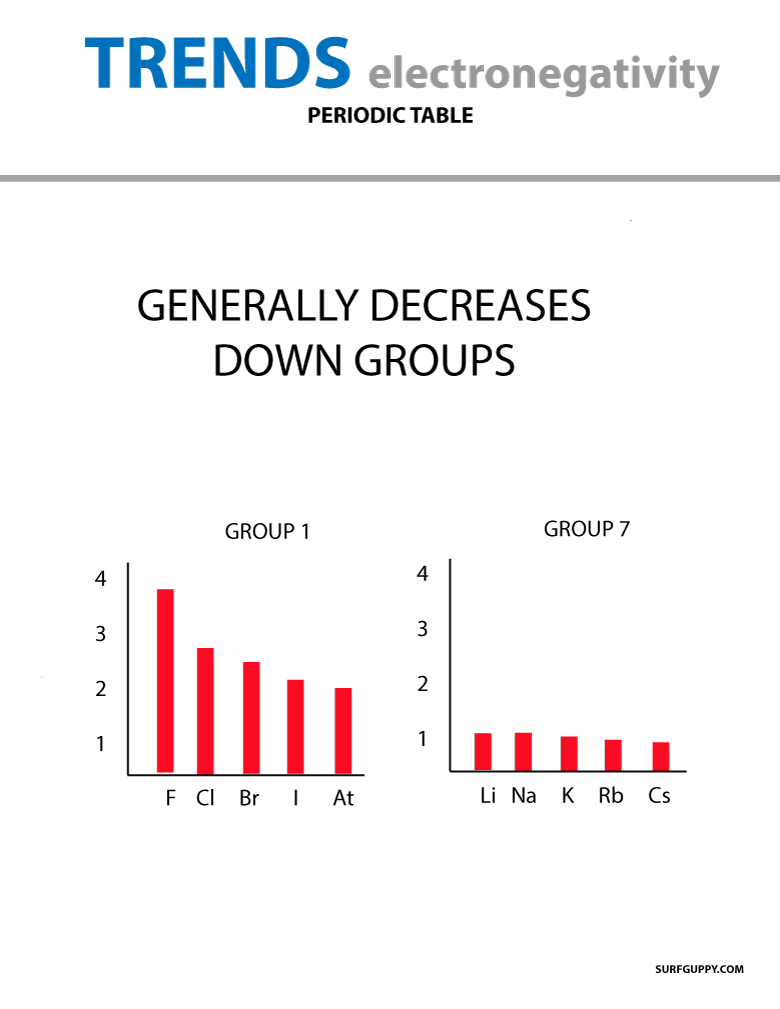
TABELA PERIÓDICA DE ELETRONEGATIVIDADE
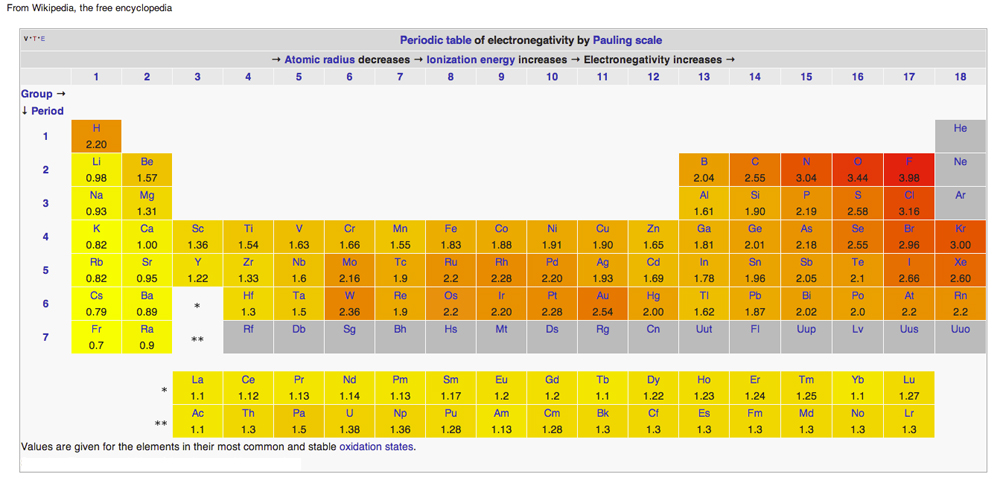 Diagrama da Wikipedia emitido sob Licenças Creative Common Licenses
Diagrama da Wikipedia emitido sob Licenças Creative Common Licenses
Leave a Reply