Mosquitos autodestruidores e roedores esterilizados: a promessa dos genes
Austin Burt e Andrea Crisanti tentavam há oito anos seqüestrar o genoma do mosquito. Eles queriam contornar a seleção natural e ligar um gene que se multiplicasse pela população mais rapidamente do que uma mutação transmitida pelo processo habitual de herança. No fundo da sua mente era uma forma de prevenir a malária, espalhando um gene para derrubar populações de mosquitos para que não pudessem transmitir a doença.
Crisanti lembra-se de ter falhado repetidamente. Mas finalmente, em 2011, os dois geneticistas do Imperial College London receberam de volta os resultados de DNA que esperavam: um gene que tinham inserido no genoma do mosquito tinha irradiado através da população, atingindo mais de 85% dos descendentes dos insetos1.
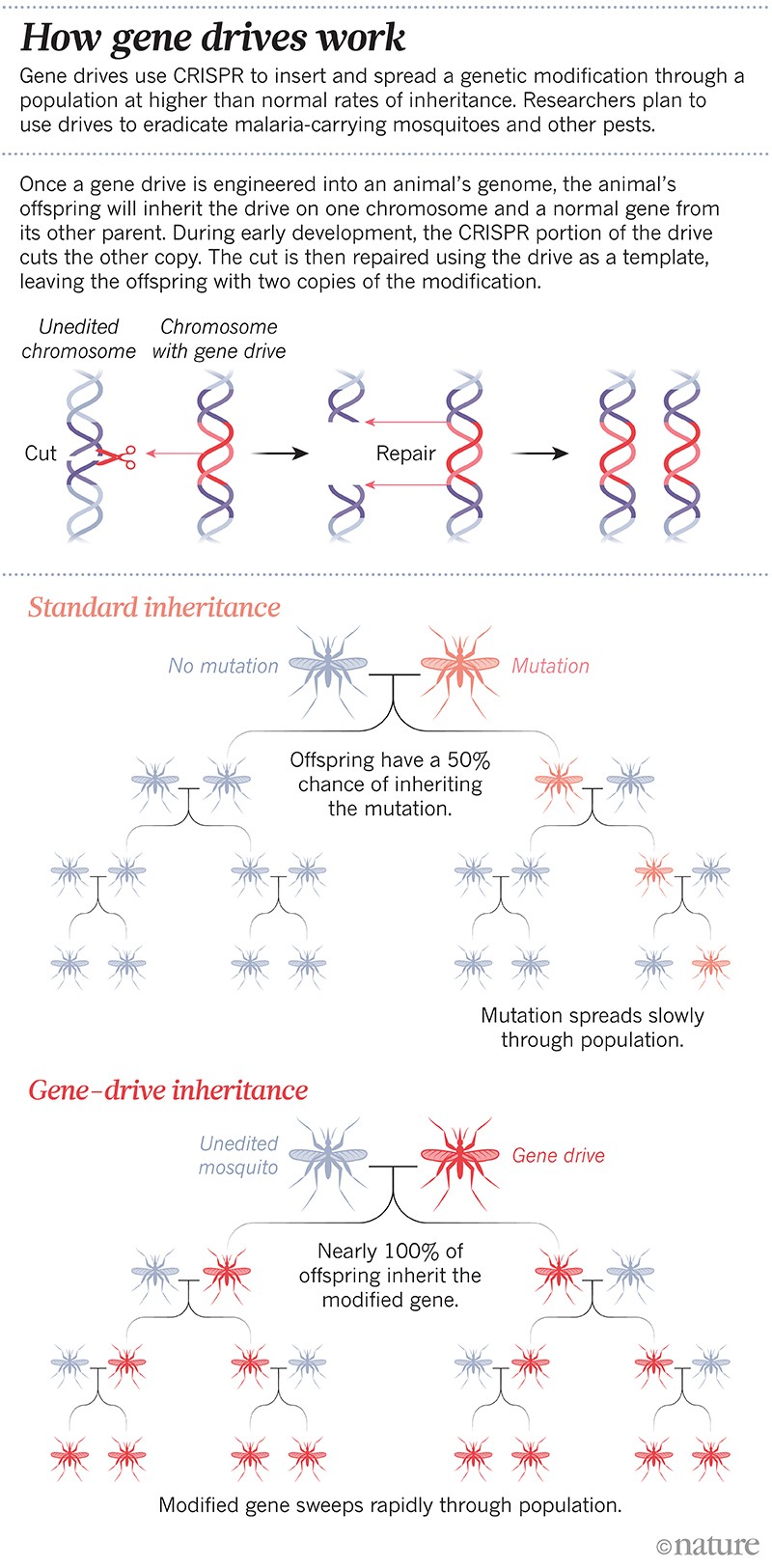
Foi a primeira modificação genética projetada para se espalhar através de uma população com taxas de herança mais altas do que o normal. A transmissão de genes tornou-se rapidamente uma tecnologia de rotina em alguns laboratórios; agora os cientistas podem criar uma transmissão em meses. A técnica baseia-se na ferramenta de edição de genes CRISPR e em alguns pedaços de RNA para alterar ou silenciar um gene específico, ou inserir um novo gene. Na geração seguinte, toda a unidade se copia em seu cromossomo parceiro para que o genoma não tenha mais a versão natural do gene escolhido e, em vez disso, tenha duas cópias da unidade do gene. Desta forma, a mudança é passada para até 100% da descendência, em vez de cerca de 50% (ver ‘Como funcionam as unidades genéticas’).
Desde 2014, os cientistas criaram sistemas de transmissão genética baseados no CRISPR em mosquitos, moscas da fruta e fungos, e estão actualmente a desenvolvê-los em ratinhos. Mas isso é apenas o começo da história. Questões sobre a possibilidade de uma condução genética foram suplantadas por outras incógnitas: como funcionarão, como testá-las e quem deve regular a tecnologia. A condução de genes tem sido proposta como uma forma de reduzir ou eliminar doenças transmitidas por insetos, controlar espécies invasoras e até mesmo reverter a resistência inseticida em pragas. Ainda não foi lançada na natureza nenhuma transmissão genética artificial, mas a tecnologia poderia, em princípio, estar pronta daqui a três anos, diz Crisanti. Ele colabora com o Target Malaria, um consórcio internacional de investigação sem fins lucrativos que procura utilizar mosquitos com propulsão genética para o controlo da malária em África. No dia 1 de Julho, o grupo lançou um lote de testes de mosquitos – geneticamente concebidos mas ainda não equipados com genes – numa aldeia em Burkina Faso.
Os genes são diferentes de qualquer outro tipo de solução ecológica já testada anteriormente, diz Fredros Okumu, director de ciência do Instituto de Saúde Ifakara em Dar es Salaam, Tanzânia. “As unidades Gene se espalharão por si mesmas”, diz ele. “Temos que preparar as pessoas e compartilhar informações abertamente com todos os países envolvidos”
Os desafios técnicos não são tão assustadores quanto os sociais e diplomáticos, diz o bioengenheiro Kevin Esvelt do Laboratório de Mídia do Massachusetts Institute of Technology (MIT), em Cambridge, que foi um dos primeiros a construir uma unidade genética baseada no CRISPR. “Tecnologias como esta têm consequências no mundo real para a vida das pessoas que podem ser quase imediatas”
Dadas as potenciais preocupações sobre a transmissão genética, a Natureza explora cinco questões-chave sobre a tecnologia e suas aplicações.
As transmissões genéticas funcionarão?
Construir uma unidade genética para manipular ou erradicar uma população é como escolher uma luta com a seleção natural, e essa luta pode não ser fácil de vencer.
Assim que os pesquisadores começaram a fazer unidades genéticas regularmente em laboratórios, os animais desenvolveram resistência contra elas – acumulando mutações que impediram que as unidades se espalhassem. Em testes de duas unidades inseridas em moscas da fruta, por exemplo, variantes genéticas conferindo resistência formada frequentemente2. Mais comumente, as mutações alteram uma sequência que o CRISPR está configurado para reconhecer, impedindo que o gene seja editado. Em experimentos com mosquitos enjaulados, o pesquisador Crisanti e Target Malaria Tony Nolan observou um drive genético diminuir gradualmente de frequência em várias gerações, devido a mutações resistentes no gene alvo3. Os resultados abalaram o campo. A resistência tornaria os genes impotentes?
Não necessariamente – se os pesquisadores selecionarem o alvo certo. Alguns genes são altamente conservados, o que significa que qualquer mudança é susceptível de matar os seus proprietários. Escolher estes genes como um alvo de unidade significa menos mutações e menos resistência. Em Setembro de 2018, Crisanti e a sua equipa despenharam uma população de mosquitos Anopheles gambiae enjaulados com 100% de eficiência4 ao fazer um impulso que perturba um gene de fertilidade chamado doublesex. Com a unidade no local, as fêmeas não podem morder e não põem ovos; dentro de 8-12 gerações, as populações enjauladas não produziram nenhum ovo. E por ser crucial para a procriação, o doublesex é resistente a mutações, incluindo aquelas que confeririam resistência a uma construção de unidade.
A equipe realizou nove experimentos em gaiolas com mais de um milhão de inserções de unidades visando o doublesex e não viu nenhuma resistência, diz Crisanti. Agora a equipe está adaptando o drive para cortar não um, mas dois loci no gene doublesex, como tratar uma doença com uma combinação de drogas. “Quero ter certeza de que a probabilidade de desenvolver resistência é muito, muito remota antes de dizer que a tecnologia está pronta para o campo”, diz Crisanti.
Nos mamíferos, os cientistas têm muito mais desafios básicos do que resistência para lidar. No ano passado, Kim Cooper e seus colegas da Universidade da Califórnia, em San Diego (UCSD), projetaram o início de uma movimentação genética em um mamífero – uma movimentação que interrompe um gene de rato, Tyr, e torna o pêlo dos animais branco5. A unidade foi apenas 72% eficiente em copiar-se no genoma e não funcionou bem na linha germinal masculina, diz Cooper. Ela suspeita que isso ocorre porque a divisão celular acontece em momentos diferentes na formação dos óvulos e esperma, o que parece afetar a capacidade da unidade de copiar com sucesso de um cromossomo para outro.
Naquele experimento, a unidade não se autopropagou e Cooper não seguiu o traço durante várias gerações, então ela enfatiza que tecnicamente não pode ser considerada uma unidade gênica. “Ainda há muito trabalho a ser feito para mostrar que algo assim é viável”, acrescenta ela.
Para que mais servem as unidades genéticas?
Embora as aplicações dos mosquitos dominem o campo, os usos propostos das unidades genéticas também incluem a conservação de ecossistemas delicados e a aceleração do trabalho de laboratório.
alguns organismos têm genomas que são difíceis de manipular, mas fazê-lo poderia ajudar os investigadores a estudá-los. Tome Candida albicans, um patógeno fúngico humano muitas vezes resistente a drogas. Como pesquisadora pós-doutora no Broad Institute e no MIT em Cambridge, Massachusetts, Rebecca Shapiro desenvolveu um sistema6 para conduzir mutações para o fungo com quase 100% de eficiência. Ela pode agora reproduzir o fungo para silenciar dois genes independentes e legar essas mutações à prole. “Funciona de forma insanavelmente eficiente”, diz Shapiro, agora na Universidade de Guelph, no Canadá. Na UCSD, Cooper está usando unidades de genes para um propósito similar, para criar e estudar características complexas em ratos.
O programa Genetic Biocontrol of Invasive Rodents (GBIRd) quer fazer mais com os ratos que com os genes do que estudá-los em um laboratório. GBIRd, uma parceria de universidades, governos e organizações não governamentais geridas pelo grupo sem fins lucrativos Island Conservation, quer usar a tecnologia para eliminar os roedores invasivos das ilhas, onde eles causam danos à vida selvagem nativa. Os pesticidas são atualmente utilizados para este fim, mas são caros e difíceis de usar em ilhas maiores com populações humanas. São viáveis em apenas cerca de 15% das ilhas, diz Royden Saah, gestor do programa da GBIRd. “Estamos tentando olhar para tecnologias que cuidariam dos outros 85%”.
Membros da GBIRd David Threadgill na Texas A&M University in College Station e Paul Thomas na University of Adelaide na Austrália estão desenvolvendo tecnologias de acionamento de genes em camundongos, embora Saah estime que serão vários anos antes que esses acionamentos funcionem com sucesso.
Mean enquanto isso, alguns pesquisadores de mosquitos esperam tentar algo mais sutil do que exterminar completamente as populações de insetos como um meio de prevenção de doenças. Em uma pré-impressão de maio7 , Omar Akbari e seus colegas da UCSD projetaram o mosquito Aedes aegypti para expressar um anticorpo que protegia os insetos contra todas as quatro principais cepas da dengue. Eles estão agora anexando esse anticorpo a uma unidade para ver se ele se espalhará. Akbari também está construindo uma unidade de genes para todos os fins que ativa uma toxina quando qualquer vírus, não apenas a dengue, infecta o A. aegypti. “Queremos construir um cavalo de Tróia no mosquito”, diz Akbari. “Quando um mosquito é infectado por um vírus – seja dengue, Zika, chikungunya, febre amarela, o que quer que seja – ele ativa o nosso sistema, o que mata o mosquito.”
Possibilidade de controlar as unidades genéticas?
Antes de Kevin Esvelt construir uma única unidade genética baseada em CRISPR, ele acordava com suores frios pensando nas ramificações. “Eu percebi, oh ei, isto não vai ser apenas sobre malária, isto vai ser potencialmente algo que qualquer indivíduo que pode fazer uma mosca da fruta transgênica poderia construir para editar todas as moscas da fruta.”
Não é surpresa, então, que em 2014, quando Esvelt e o geneticista George Church construíram seu primeiro drive genético na Harvard Medical School em Boston, Massachusetts, eles construíram simultaneamente um drive de reversão para sobrescrever o drive original no comando8.
O resto do campo seguiu o exemplo, desenvolvendo drives genéticas com controles embutidos, overrides externos ou ambos. A maior parte desse esforço é financiada pela Agência de Projetos de Pesquisa Avançada da Defesa dos EUA (DARPA), o braço de pesquisa do Departamento de Defesa dos EUA. Em 2017, o programa Safe Genes da DARPA anunciou que estava gastando US$ 65 milhões em sete equipes de pesquisa dos EUA estudando como controlar, combater e reverter as transmissões de genes. “Estamos mitigando o potencial de mau uso, seja acidental ou nefasto”, diz Renee Wegrzyn, gerente do programa Safe Genes.
Esvelt, financiado na fase inicial do programa, concebeu uma unidade de auto-extracção conhecida como daisy drive. A unidade é projetada para perder um elo de cada vez, como arrancar uma flor de uma cabeça ligada a uma corrente para o caule, até que ela se esgote durante várias gerações9.
Na UCSD, a equipe financiada pelo DARPA da Akbari está desenvolvendo unidades genéticas que devem ser incapazes de se espalhar além de uma população alvo de mosquitos ou moscas. Uma dessas unidades requer liberação contínua por muitas gerações. Quando essas liberações param, ele se dilui com versões do tipo selvagem do gene e se extingue dentro de quatro anos. Isso pode ser tempo suficiente para eliminar um vírus como o Zika ou dengue de uma população de mosquitos, diz Akbari. “É algo que, na minha opinião, é um pouco mais seguro e ainda bastante eficaz.” A equipe já produziu várias versões destes discos para A. aegypti, o principal vetor do vírus da dengue10.
A equipe Target Malaria também está desenvolvendo uma contramedida, financiada pela DARPA, para parar a propagação do disco duplo numa população.
Como os discos genéticos podem ser testados?
Em vez de um teste de campo – que o contrato DARPA Safe Genes proíbe expressamente e para o qual os pesquisadores concordam que a tecnologia não está pronta – as equipes estão ampliando experimentos em gaiolas e construindo modelos ecológicos para explorar os benefícios e riscos de uma liberação selvagem com segurança.
Na cidade de Terni, no centro da Itália, Crisanti e Nolan enriqueceram suas gaiolas mosquiteiras com mudanças nas condições ambientais. “Queremos escalar a fim de testá-la em diferentes origens genéticas, sob cenários mais realistas”, diz Nolan, que agora dirige um laboratório na Escola de Medicina Tropical de Liverpool, Reino Unido. Ele e Crisanti querem replicar o comportamento natural de acasalamento – como machos formando enxames para atrair fêmeas – para ver como isso afeta a propagação de um drive genético.
A dinâmica da propagação do drive nessas gaiolas até agora é “promissora”, diz Crisanti – o drive está sendo transmitido eficientemente sem sinais de resistência. Se nenhuma preocupação surgir nos experimentos em gaiolas maiores, então a equipe entregará a tecnologia a grupos independentes para testes, com o objetivo de obter aprovação regulatória em aproximadamente três anos, diz Crisanti.
A equipe Target Malaria também está construindo modelos ecológicos de possíveis locais de liberação para trabalhar a dinâmica no terreno. O estudo mais recente11 modela populações de mosquitos em mais de 40.000 assentamentos em Burkina Faso e países vizinhos. Ele leva em conta rios, lagos e chuvas, bem como dados de campo sobre o movimento de mosquitos. Os resultados11 mostram que a introdução repetida, em vez de uma única libertação, de mosquitos modificados ao longo de alguns anos nas aldeias será necessária para reduzir o número total de insectos.
“A teoria diz que, em princípio, se se libertar uma vez, espalhar-se-ia por todo o continente. A realidade é que isso aconteceria muito lentamente”, diz o biólogo populacional Charles Godfray da Universidade de Oxford, Reino Unido, um colaborador da Target Malaria e principal pesquisador do estudo.
Outra preocupação é que os genes têm o potencial de alterar populações inteiras e, portanto, ecossistemas inteiros. Em teoria, podem também afectar negativamente a saúde humana, fazendo com que o parasita do paludismo evolua para ser mais virulento ou ser transportado por outro hospedeiro, diz a bióloga molecular e bioética Natalie Kofler. Ela é a diretora fundadora do grupo Editing Nature da Universidade de Yale, em New Haven, Connecticut, que tem como objetivo abordar as tecnologias genéticas ambientais em todo o mundo. “Esta tecnologia tem potencial para ser imensamente poderosa e para mudar o curso de coisas que talvez não sejamos capazes de prever”, diz Kofler.
Quem decide quando usar um gene drive?
Para testes de drogas, uma empresa pode começar a se preparar para um teste de campo com apenas um ou dois anos de antecedência. As unidades genéticas vão precisar de mais tempo, diz Okumu. No ano passado, ele fez parte de um grupo de trabalho científico de 15 membros, organizado pela Fundação para os Institutos Nacionais de Saúde, que apresentou uma série de recomendações12 para o uso de mosquitos gene-drive na África subsaariana.
O relatório enfatiza que governos, comunidades e cientistas locais precisarão de tempo para absorver a ciência e ter poder para regular a tecnologia. “Digo isto com toda a convicção – no final, as melhores pessoas para tomar estas decisões são os próprios países”, diz Okumu.
Em 2017, Kofler reuniu um grupo de cientistas e especialistas em ética para lidar com as questões sociais em torno dos impulsos genéticos13. “As principais questões centram-se em torno da justiça”, diz Kofler. Em discussões sobre a liberação de um organismo geneticamente modificado em um ambiente africano, grupos que historicamente têm sido marginalizados têm o direito de fazer parte do processo de tomada de decisão, diz ela.
Okumu quer que os cientistas africanos desenvolvam e testem localmente a tecnologia de transmissão de genes, o que exigirá respeito e disposição dos financiadores para apoiar tais esforços. “As pessoas temem o desconhecido, e o desconhecido agora está sendo apresentado de uma perspectiva ocidental”, diz Okumu. “Estou ansioso por um dia em que possamos construir estas construções em nossos próprios laboratórios e, desta forma, construir confiança local”
Em agosto de 2018, a Agência Nacional de Biossegurança de Burkina Faso autorizou a Target Malaria a liberar uma cepa de mosquito macho estéril geneticamente modificado, o primeiro deste tipo no continente africano. Na semana passada, a equipe liberou cerca de 6.400 mosquitos que foram geneticamente modificados, mas que não abrigam transmissões de genes. Os cientistas esperam que a libertação melhore a percepção da investigação, bem como forneça dados para futuras libertações.
E embora os ratos com propulsão genética estejam longe de estar prontos para a libertação, a GBIRd já está a trabalhar com avaliadores de risco, especialistas em ética e ecologistas para identificar uma ilha para um ensaio de campo inicial. “Queremos ter a certeza de que isto está certo”, diz Saah. “Não importa o quão rápido as tecnologias se movem, podemos avançar agora as ciências sociais e a ética.”
Leave a Reply