Frontiers in Oncology
Background
Radiation induced osteoporosis and resulting insufficiency fractures (IFs) are very common. A incidência de FI relatada na literatura após as irradiações abdominais ou pélvicas varia entre 7 e 45% (1-8). Em certas situações oncológicas como o tratamento hormonal do cancro da mama e da próstata, os clínicos estão familiarizados com o tratamento relacionado com a osteoporose e o risco de fractura (9-13). A absorção de raios X de dupla energia (DEXA) é pedida rotineiramente e medidas preventivas contra a osteoporose, como cálcio, vitamina D ou bifosfonatos, são tomadas profilaticamente durante o acompanhamento dos pacientes. Entretanto, não há avaliação de rotina da saúde óssea, e não há consciência da toxicidade óssea relacionada à radiação e aos FI entre os oncologistas radiologistas. Embora os FI sejam frequentemente encontrados no acompanhamento dos pacientes após as irradiações abdominais ou pélvicas e observados actualmente com uma frequência muito elevada após as irradiações estereotáxicas, não se consideram as medidas de DEXA ou outras medidas alternativas de densidade mineral óssea (DMO) na prática da oncologia por radiação (1-8, 14-16). Devido ao desconhecimento dos FI pelos oncologistas radiologistas, esses FI muitas vezes não são reconhecidos ou às vezes podem ser considerados como metástases ósseas do câncer primário resultando em má prática e exames desnecessários e estresse psicológico para os pacientes.
Recentemente demonstramos risco de fratura vertebral de 9,6% em pacientes que foram tratados com irradiação abdominal (8). Pensamos que o osso deve ser considerado como um órgão de risco para o planejamento da radioterapia e a DMO deve ser medida e seguida regularmente nestes pacientes antes e depois da irradiação. Os oncologistas radiologistas podem determinar a saúde óssea dos seus pacientes e os FI não reconhecidos, utilizando a sua ferramenta mais importante: o sistema de planeamento do tratamento radiológico.
BMD é a medida da densidade mineral óssea e do cálcio e é determinada pelo DEXA (17, 18). O DEXA é atualmente considerado o método padrão-ouro para quantificação de BMD e tem demonstrado correlação com o risco de fraturas e a eficácia do tratamento (17, 18). Vários estudos têm demonstrado que a tomografia computadorizada (TC) derivada das unidades Hounsfield (UH), tem uma forte correlação com a DMO fornecida pelo DEXA (19-22). Os valores de HU podem fornecer estimativas confiáveis para a força óssea regional e DMO, e podem ser utilizados para excluir osteoporose com alta precisão (19-22). Além disso, a tomografia computadorizada quando comparada com DEXA permite uma identificação mais precisa das fraturas vertebrais (23). As tomografias computadorizadas de diagnóstico e planejamento de radiação são encomendadas para estadiar a doença, planejar o tratamento de radiação ou para o acompanhamento dos pacientes de forma rotineira. Podemos utilizar UHs derivadas de TC nesses pacientes para determinar e monitorar a DMO, e assim podemos evitar custo extra e exposição adicional à radiação da medição DEXA. Além dessas vantagens, as vistas vertebrais sagitais reconstruídas facilmente a partir de tomografias computadorizadas podem ser usadas para avaliar fraturas ósseas não reconhecidas e não-sintomáticas.
O objetivo do presente estudo é demonstrar a perda de densidade mineral óssea e fraturas vertebrais não diagnosticadas, medindo as UHs e a reconstrução sagital das vértebras a partir das tomografias computadorizadas importadas para o sistema de planejamento do tratamento de pacientes que são tratados com radioterapia abdominal.
Métodos
Quinquenta e sete pacientes consecutivos operados por adenocarcinoma gástrico que receberam radioterapia abdominal adjuvante foram incluídos no grupo de estudo. Trinta e quatro pacientes consecutivos com doença em estágio inicial que não necessitaram de tratamento adjuvante após a cirurgia foram incluídos no grupo controle.
Nos pacientes irradiados, a radiação foi administrada com 6 ou 15 fótons de VM por meio de planejamento de tratamento com arco conformado, modulado em intensidade ou modulado volumetricamente. A dose de radiação prescrita foi de 46 Gy em 23 frações com 2 Gy por dia, ou 45 Gy em 25 frações com 1, 8 Gy por dia, 5 dias por semana, durante 5 semanas. Todos os pacientes receberam bolus ou infusão de 5-fluorouracil, um ciclo antes, dois ciclos concomitantes e um ciclo após o tratamento com radiação. O consentimento informado foi obtido de todos os pacientes e o estudo foi aprovado pelo comitê de ética local do hospital.
Tomografias de planejamento e diagnóstico foram obtidas usando tomógrafos multidetectores (LightSpeed 16 fatias ou VCT 64 fatias; GE Healthcare, Waukesha, WI) por cortes de 3 ou 5 mm de espessura. As tomografias abdominais foram importadas do sistema de arquivo de imagens radiológicas e de comunicação para o Sistema de Planejamento do Tratamento do Eclipse (TPS) (Varian Medical Systems, Palo Alto, CA). No grupo de estudo, a primeira tomografia já estava no sistema de planejamento do tratamento para o planejamento da radiação. A segunda foi obtida 1 ano após a radioterapia e importada para o sistema de planejamento de tratamento. No grupo controle, as tomografias abdominais obtidas logo após a cirurgia e 1 ano depois foram importadas para o sistema de planejamento. Os corpos vertebrais T12-L1-L2 foram contornados para determinar a dose média de radiação para cada corpo vertebral nos pacientes irradiados por um oncologista radiologista. Depois disso, um radiologista experiente usando a TPS determinou os valores médios de HU da mesma vértebra para todos os pacientes. Os valores médios de HU para ambos os grupos de pacientes foram remensurados 1 ano depois.
HU valores no início do estudo e aqueles obtidos 1 ano depois foram calculados para cada corpo vertebral em cada grupo e a mudança percentual em UH (Δ%HU) foi determinada. Embora a duração das medidas de UH tenha sido planejada no início e 1 ano depois, continuamos a acompanhar os pacientes regularmente por pelo menos 5 anos após o tratamento para resultado oncológico. As fraturas por compressão vertebral, se alguma desenvolvida, foram determinadas a partir da reconstrução sagital das vértebras a partir das tomografias computadorizadas durante os acompanhamentos.
HU Técnica de Medição
HUs foram medidas nas secções axiais das regiões trabeculares dos corpos vertebrais T12, L1, L2. Cada corpo vertebral foi dividido em três segmentos axiais e as UH foram calculadas colocando a região retangular de interesse (ROI) sobre uma área de osso trabecular no corpo vertebral. Tentamos evitar o plexo venoso basivertebral posterior e o osso esclerótico subcondral. As medidas foram detalhadas na Figura Complementar 1. Os valores médios da UH de três segmentos axiais em cada vértebra foram calculados para determinar o valor final da UH para cada corpo vertebral. A HUpre representa o valor de UC medido na TC inicial para ambos os grupos de estudo e controle, enquanto que a HUpost define o valor de UC medido após 1 ano.
Análises estatísticas
Diminuição percentual da atenuação óssea (Δ%HU) para cada vértebra foi calculada com a seguinte equação:
Análises qui-quadradas foram feitas para demonstrar as diferenças entre idade, sexo e características tumorais dos grupos. O teste t dos alunos foi utilizado para determinar as diferenças entre os valores pré e pós-HUpre em cada grupo e entre dois grupos, e para três níveis de dose de radiação (<20 Gy, 20-40 Gy, e >40 Gy) no grupo de estudo. Para avaliar diretamente o efeito da dose de radiação na mudança em Δ%HU, foi realizada a análise de correlação de Pearson em Δ%HU e dose de radiação. Consideramos um valor de p de < 0,05 como significativo. A análise estatística foi realizada utilizando o programa Statistical Package for Social Sciences (SPSS) 17.0.
Resultados
Os detalhes do paciente e do tratamento são apresentados na Tabela 1. Não houve diferença estatisticamente significativa entre os grupos com relação à idade, sexo, tipo de ressecção cirúrgica e localização do tumor. Os valores médios de HU das vértebras T12, L1 e L2 foram medidos em ambos os grupos. No início do estudo, não houve diferença estatisticamente significativa nos valores de UC medidos para todas as vértebras entre o estudo e os grupos controle. Enquanto a média dos valores de UC das vértebras T12, L1, L2 diminuiu significativamente no grupo de estudo (p < 0,001 para cada vértebra) após 1 ano, não foram encontradas alterações significativas nos valores de UC no grupo controle (p: 0,09-0,08-0,24, respectivamente) durante o mesmo período. A Tabela 2 resume as alterações nas UCs para o estudo e para os grupos controle.
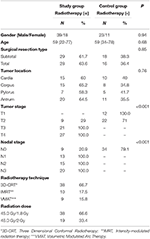
Tábua 1. Características do paciente e do tratamento.

Tabela 2. Comparação das UCs nos dois grupos e entre os dois grupos para cada vértebra.
As doses médias de radiação para as vértebras T12, L1 e L2 no grupo de estudo foram 34,55 ± 11,1; 31,82 ± 12,4; 30,37 ± 13,6 Gy, respectivamente. Foi encontrada uma correlação negativa e significativa entre Δ%HU e a dose de radiação recebida por cada vértebra. medida que a dose de radiação aumenta, as UHs diminuem em cada vértebra. Isto está resumido nas Figuras 1-3.
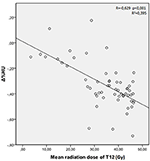
Figura 1. Correlação entre Δ%HU e dose de radiação recebida pela vértebra T12.
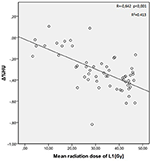
Figura 2. Correlação entre Δ%HU e a dose de radiação recebida pela vértebra L1.
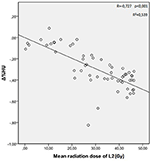
Figura 3. Correlação entre Δ%HU e a dose de radiação recebida pela vértebra L2.
A relação entre a dose de radiação recebida pela vértebra e a alteração da UC foi resumida na Tabela 3. Embora a diminuição nos valores de UC tenha sido estatisticamente significativa em níveis de dose de radiação acima de 20 Gy, os valores de UC não foram alterados significativamente em doses de radiação abaixo de 20 Gy, exceto para vértebras L2.

Tabela 3. Alteração nas UH em relação aos grupos de dose de radiação.
Fracturas
Apesar de nenhum paciente do grupo controle ter sofrido fraturas, 4 dos 57 pacientes (%7) do grupo irradiado desenvolveram fraturas vertebrais ao longo do estudo. Enquanto duas das fraturas vertebrais foram observadas em fêmeas, duas delas foram observadas em machos. As fraturas foram identificadas nos 16º, 18º, 20º e 26º meses após a irradiação, com tempo médio de seguimento de 24 meses (variação: 12-36 meses). Foram observadas fraturas na vértebra L1 em três pacientes e na vértebra L2 em um paciente. As doses médias de radiação recebidas por cada vértebra fraturada foram as seguintes: 39, 28,5, 22,3, 31 Gy. As características dos pacientes com fraturas vertebrais estão resumidas na Tabela Complementar 1 e na Figura Complementar 2.
Discussão
Radioterapia leva à osteoporose por mecanismos diretos e indiretos e os FI se desenvolvem freqüentemente após irradiações pélvicas ou abdominais na prática clínica (1-8). Os FI na coluna vertebral e região pélvica são comuns e representam um importante efeito secundário tardio da radioterapia. No entanto, os oncologistas radiologistas não estão conscientes da osteoporose induzida pela radiação e da toxicidade óssea. Devido ao desconhecimento da toxicidade óssea induzida pela radiação, não é dada especial atenção para evitar esta importante complicação tardia. Nós, em nosso estudo anterior (8), tentamos enfatizar a importância deste problema e relatamos uma incidência muito alta de fraturas vertebrais após a irradiação abdominal como nos pacientes irradiados para tumores pélvicos (1-7).
Os oncologistas radiologistas durante o planejamento do tratamento irradiante prestam muita atenção à dose de radiação recebida por cada órgão em risco. Embora as taxas de toxicidade tardia de grau III/IV para estas complicações muito próximas não estejam acima de certas percentagens, a toxicidade óssea relacionada com a radioterapia abdominal ou pélvica e as fracturas resultantes são de facto superiores às bem conhecidas toxicidade tardia de grau III/IV. Embora as restrições de dose sejam bem definidas para órgãos conhecidos por estarem em risco e sejam determinantes da aprovação final do plano, este não é o caso do tecido ósseo.
Even na última versão do Common Terminology Criteria for Adverse Events (CTCAE) Versão 5.0 não há definição específica de toxicidade óssea resultante da irradiação (24). Não há critérios de avaliação da toxicidade óssea na prática da oncologia por radiação. Nem nas tabelas de pontuação de toxicidade tardia LENT-SOMA, nem nas Análises Quantitativas de Efeitos Teciduais Normais no Relatório Clínico (QUANTEC), o osso foi definido como um órgão em risco, e não foi definida nenhuma restrição de dose e volume para este tecido (25, 26). Entretanto, os estudos anteriores e nosso estudo recentemente publicado demonstraram que a osteoporose e o risco de fraturas devem ser levados em consideração seriamente, e as precauções necessárias devem ser tomadas durante o acompanhamento de pacientes irradiados para evitar fraturas relacionadas à radiação (1-8).
DEXA é o método padrão-ouro para quantificação de BMD e triagem rotineira para osteoporose. Os oncologistas não encomendam DEXA para seus pacientes que recebem irradiação pélvica ou abdominal. Eles não consultam esses pacientes com o endocrinologista para avaliação do risco de fraturas e presença de osteoporose antes de qualquer tratamento com radiação. No entanto, como oncologistas de radiação, podemos usar nosso sistema de planejamento para determinar o risco de DMO e osteoporose. Essas avaliações podem ser feitas facilmente através de tomografias computadorizadas encomendadas para estadiamento da doença, ou para o planejamento do tratamento com radiação e para o acompanhamento dos pacientes. Podemos determinar a diminuição da DMO, osteoporose e fraturas despercebidas, medindo os valores de HU óssea das tomografias computadorizadas dos pacientes importados para o sistema de planejamento e construindo imagens sagitais das áreas ósseas irradiadas.
Foi sugerido recentemente que os valores de HU óssea derivados da tomografia computadorizada podem ser usados para identificar pacientes com diminuição da DMO e osteoporose (19-22, 27-30). Pickhardt et al. (22) definiram claramente como os valores de HU óssea podem ser medidos e usados como uma alternativa ao DEXA para estabelecer o diagnóstico de DMO e osteoporose. Nestes estudos, enquanto valores de UC óssea inferiores a 100 são considerados indicativos de osteoporose, valores de UC entre 100 e 160 são considerados indicativos de osteopenia, e valores de UC acima de 160 demonstram densidade mineral óssea normal (19-22). Os pacientes com valores de UC acima de 160 têm densidade óssea normal e, portanto, não é necessária nenhuma medida de DEXA e não é necessária nenhuma preocupação com a saúde óssea. Os pacientes com valores de UC entre 100 e 160 podem ser considerados osteopénicos e necessitam de intervenção precoce para prevenção de osteoporose e risco de fractura no futuro. Os pacientes com valores de UC abaixo de 100 devem ser considerados como osteoporóticos. Valores baixos de UC devem alertar o oncologista de radiação para o risco de fraturas ulteriores em áreas ósseas que serão expostas à radiação. Estes pacientes devem ser consultados com o endocrinologista antes de administrar qualquer tratamento com radiação. Em estudos comparando UHs com DEXA para densidade mineral óssea e determinação da osteoporose, alguns pacientes que caíram no grupo não osteoporótico por DEXA foram detectados com fraturas vertebrais durante a determinação das UHs a partir de tomografias (22, 29-31).
Em nosso estudo, tentamos encontrar uma maneira fácil para os oncologistas de radiação diagnosticarem a osteoporose e determinarem o risco de fraturas. Se implementarmos essas medidas na rotina diária durante o planejamento do tratamento com radiação, podemos determinar osteopenia, osteoporose e risco de fraturas em pacientes que receberão radioterapia abdominal ou pélvica e intervirão precocemente para prevenir a toxicidade óssea por radiação tardia.
Embora não houvesse diferença estatística significativa nos valores de UH das vértebras T12, L1, L2 obtidas na linha de base e 1 ano depois no grupo controle, os valores de UH diminuíram significativamente nos pacientes irradiados. Encontramos fraturas vertebrais somente nos pacientes irradiados. Quatro dos 57 pacientes tiveram fraturas vertebrais após um seguimento mediano de 24 meses, com uma taxa de incidência acumulada de fraturas de 7%. Embora o tempo de seguimento tenha sido curto e a maioria das fraturas fosse assintomática, relatamos 9,6% de fraturas em nosso estudo anterior, com tempo de seguimento maior, sendo a maioria dessas fraturas sintomáticas (8). O alto risco de fraturas ósseas nesses pacientes merece atenção e o osso deve ser considerado como um órgão de risco. O tempo relatado para o desenvolvimento de fraturas após a radioterapia variou entre 2 e 63 meses (2, 14). Curiosamente, as fraturas como grau IV de toxicidade por radiação tardia são observadas com maior incidência do que outras toxicidade por radiação tardia bem conhecidas, como fibrose por radiação, cistite, proctite, etc.
A diminuição da UH foi dependente da dose. Houve maior risco de diminuição nos valores de UC óssea com doses de radiação mais elevadas recebidas pelas vértebras. No entanto, verificou-se que a diminuição dos valores de UC não foi significativa para os corpos vertebrais expostos a doses de radiação inferiores a 20 Gy.
Na literatura, existem achados contraditórios em termos da dose de radiação onde se observa perda de BMD. Enquanto um estudo demonstrou perda de DMO em pacientes tratados com 22,5 Gy de irradiação pélvica, outro estudo não demonstrou correlação entre dose de radiação e risco de fratura por insuficiência (32, 33). Wei et al. (33) relataram que mesmo 5 doses de radiação vertebral Gy resultam com redução significativa de DMO e IR em pacientes que foram tratados com radioterapia abdominal. Eles também recomendaram limitar as doses de radiação aos corpos vertebrais, especialmente em pacientes com baixos valores de HU detectados durante o planejamento do tratamento com radioterapia. Assim, devemos definir uma restrição de dose para as vértebras dentro do campo de radiação. As restrições de dose podem variar dependendo dos valores de UC medidos durante o planeamento do tratamento de radiação. Devemos tentar diminuir as doses médias de radiação para os ossos vertebrais dentro do campo de radiação, especialmente em pacientes idosos, e já osteoporóticos.
Conclusões
Asteoporose induzida por radiação e as fraturas por insuficiência (FIs) resultantes são muito comuns. A diminuição da DMO, osteoporose e fraturas despercebidas podem ser detectadas através da mensuração dos valores de HU do osso a partir das tomografias computadorizadas dos pacientes importados para o sistema de planejamento e pela reconstrução das imagens sagitais das áreas ósseas irradiadas. Em pacientes com já baixos valores de UC óssea detectados durante o planejamento da radiação, pode-se intervir precocemente para restaurar a saúde óssea e prevenir futuras fraturas relacionadas à radiação. Para prevenir a toxicidade óssea relacionada com a radiação, a dose de radiação para os ossos vertebrais com valores de UC já baixos no momento do planejamento do tratamento deve ser limitada abaixo de 20 Gy.
Data Availability Statement
Materiais descritos no artigo, incluindo todos os dados brutos relevantes, podem ser livremente disponibilizados a qualquer cientista que deseje usá-los para fins não comerciais, sem violar a confidencialidade do participante e podem ser obtidos do autor correspondente.
Ethics Statement
Nosso estudo foi realizado de acordo com a Declaração de Helsinque. O estudo foi aprovado pelo comitê de ética do Dr. Lutfi Kirdar Kartal Education and Research Hospital (2017/514/109/2). O consentimento livre e esclarecido por escrito foi obtido de todos os participantes do estudo.
Autor Contribuições
GY: garantidor da integridade de todo o estudo. GY e GC: conceitos e desenho do estudo. NC: pesquisa bibliográfica. GY, CG, IK, OS, e NC: estudos clínicos. GY: análise estatística. OS: preparação de manuscritos. GC: edição de manuscritos. Todos os autores leram e aprovaram o manuscrito final.
Conflito de interesse
Os autores declaram que a pesquisa foi realizada na ausência de qualquer relação comercial ou financeira que pudesse ser interpretada como um potencial conflito de interesse.
Material Suplementar
O Material Suplementar para este artigo pode ser encontrado online em: https://www.frontiersin.org/articles/10.3389/fonc.2020.00742/full#supplementary-material
A abreviaturas
IFs, Fracturas por insuficiência; DEXA, Absorptiometria de raios X de dupla energia; BMD, Densidade mineral óssea; CT, Tomografia computadorizada; HU, Unidade Hounsfield; Δ%HU, Alteração percentual na HU; ROI, Região de interesse; SPSS, Pacote estatístico para as ciências sociais; CTCAE, Critérios terminológicos comuns para eventos adversos; QUANTEC, Análises quantitativas dos efeitos dos tecidos normais na clínica.
1. Oh D, Huh SJ. Fratura por insuficiência após radioterapia. Radiat Oncol J. (2014) 32:213-20. doi: 10.3857/roj.2014.32.4.213
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Higham CE, Faithfull SJ. Saúde óssea e radioterapia pélvica. Clin Oncol. (2015) 11:668-78. doi: 10.1016/j.clon.2015.07.006
CrossRef Full Text | Google Scholar
3. Shih KK, Folkert MR, Kollmeier MA, Abu-Rustum NR, Sonoda Y, Leitao MM Jr, et al. Fracturas por insuficiência pélvica em doentes com cancro do colo do útero e endometrial tratados com radiação pélvica pós-operatória. Gynecol Oncol. (2013) 128:540-3. doi: 10.1016/j.ygyno.2012.12.021
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Uezono H, Tsujino K, Moriki K, Nagano F, Ota Y, Sasaki R, et al. Fratura por insuficiência pélvica após radioterapia definitiva para câncer de colo uterino: análise retrospectiva dos fatores de risco. J Radiat Res. (2013) 54:1102-9. doi: 10.1093/jrr/rrt055
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Igdem S, Alco G, Ercan T, Barlan M, Ganiyusufoglu K, Unalan B, et al. Insuficiência de fraturas após radioterapia pélvica em pacientes com câncer de próstata. Int J Radiat Oncol Biol Phys. (2010) 77:818-23. doi: 10.1016/j.ijrobp.2009.05.059
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Schmeler KM, Jhingram A, Iyer RB, Sun CC, Eifel PJ, Soliman PT, et al. Fracturas pélvicas após radioterapia para o cancro do colo do útero: implicações para os sobreviventes. Câncer. (2010) 116:625-30. doi: 10.1002/cncr.24811
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Kim HJ, Boland PJ, Meredith DS, Lis E, Zhang Z, Shi W, et al. Fracturas do sacro após quimiorradiação para carcinoma rectal: incidência, factores de risco e avaliação radiográfica. Int J Radiat Oncol. (2012) 84:694-9. doi: 10.1016/j.ijrobp.2012.01.021
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Yaprak G, Gemici C, Temizkan S, Ozdemir S, Dogan BC, Seseogullari OO. Desenvolvimento de osteoporose e fraturas vertebrais após irradiação abdominal em pacientes com câncer gástrico. Câncer de BMC. (2018) 18:972. doi: 10.1186/s12885-018-4899-z
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Lustberg MB, Reinbolt RE, Shapiro CL. Saúde óssea na sobrevivência do cancro em adultos. J Clin Oncol. (2012) 30:3665-74. doi: 10.1200/JCO.2012.42.2097
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Coleman R, Body JJ, Aapro M, Hadji P, Herrstedt J, ESMO Guidelines Working Group. Saúde óssea em pacientes com câncer: Diretrizes para a prática clínica da ESMO. Ann Oncol. (2014) 25:124-37. doi: 10.1093/annonc/mdu103
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Pfeilschifter J, Diel IJ. Osteoporose devido ao tratamento do câncer: patogênese e manejo. J Clin Oncol. (2000) 18:1570-93. doi: 10.1200/JCO.2000.18.7.1570
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Hadji P, Gnant M, Body JJ, Bundred NJ, Brufsky A, Coleman RE, et al. Perda óssea induzida pelo tratamento do câncer em mulheres na pré-menopausa: uma necessidade de intervenção terapêutica? Cancer Treat Rev. (2012) 38:798-806. doi: 10.1016/j.ctrv.2012.02.008
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Skolarus TA, Caram MV, Shahinian VB. Doença óssea associada à privação de Androgênio. Curral Opinião Urol. (2014) 24:601-7. doi: 10.1097/MOU.000000000000010101
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Boehling NS, Grosshans DR, Allen PK, McAleer MF, Burton AW, Azeem S, et al. Risco de fratura por compressão vertebral após radioterapia corporal estereotáxica para metástases espinhais. J Neurocirurgia da Coluna Vertebral. (2012) 16:379-86. doi: 10.3171/2011.11.SPINE116
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Cunha MV, Al-Omair A, Atenafu EG, Masucci GL, Letourneau D, Korol R, et al. Fratura por compressão vertebral (FVC) após terapia de radiação corporal estereotáxica da coluna vertebral (SBRT): análise dos fatores preditivos. Int J Radiat Oncol Biol Phys. (2012) 84:343-9. doi: 10.1016/j.ijrobp.2012.04.034
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Jawad MS, Fahim DK, Gerszten PC, Flickinger JC, Sahgal A, Grills IS, et al. Fraturas por compressão vertebral após radioterapia corporal estereotáxica: uma avaliação grande, multi-institucional, multinacional. J Neurocirurgia da Coluna. (2016) 24:928-36. doi: 10.3171/2015.10.SPINE141261
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Marshall D, Johnell O, Wedel H. Meta-análise de como as medidas da densidade mineral óssea prevêem a ocorrência de fraturas osteoporóticas. BMJ. (1996) 312:1254-9. doi: 10.1136/bmj.312.7041.1254
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Kanis JA, McCloskey EV, Johansson H, Oden A, Melton LJ 3rd, Khaltaev N. Um padrão de referência para a descrição da osteoporose. Osso. (2008) 42:467-75. doi: 10.1016/j.bone.2007.11.001
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Schreiber JJ, Anderson PA, Rosas HG, Buchholz AL, Au AG. Hounsfield units for assessing bone mineral density and strength: a tool for osteoporosis management. J Bone Joint Surg Am. (2011) 93:1057-63. doi: 10.2106/JBJS.J.00160
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Schreiber JJ, Anderson PA, Hsu WK. Uso da tomografia computorizada para avaliação da densidade mineral óssea. Foco em Neurocirurgia. (2014) 37:E4. doi: 10.3171/2014.5.FOCUS1483
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Batawil N, Sabiq S. Hounsfield unit for the diagnosis of bone mineral density disease: a proof of concept study. Radiografia. (2016) 22:93-8. doi: 10.1016/j.radi.2015.11.004
CrossRef Full Text | Google Scholar
22. Pickhardt PJ, Pooler BD, Lauder T, del Rio AM, Bruce RJ, Binkley N. Triagem oportunista para osteoporose usando tomografia computadorizada abdominal obtida para outras indicações. Ann Intern Med. (2013) 158:588-95. doi: 10.7326/0003-4819-158-8-201304160-00003
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Lenchik L, Shi R, Register TC, Beck SR, Beck SR, Langefeld CD, et al. Medição da densidade mineral óssea trabecular na coluna torácica utilizando tomografia computadorizada quantitativa por via cardíaca. J Computador Assist Tomogr. (2004) 28:134-9. doi: 10.1097/00004728-200401000-00023
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Critérios Terminológicos Comuns para Eventos Adversos (CTCAE). Versão 5.0. U.S. Department of Health and Human Services, National Institutes of Health National Cancer Institute. Maryland (2017).
25. Overgaard J, Bartelink H. Late effects Consensus Conference: RTOG/EORTC. Radiother Oncol. (1995) 35:1-82. doi: 10.1016/0167-8140(95)01548-U
CrossRef Full Text | Google Scholar
26. Bentzen SM, Constine LS, Deasy JO, Eisbruch A, Jackson A, Marks LB. Análises quantitativas do efeito normal dos tecidos na clínica (QUANTEC): uma introdução às questões científicas. Int J Radiat Oncol Biol. Phys. (2010) 76(3 Suppl):S3-S9. doi: 10.1016/j.ijrobp.2009.09.040
CrossRef Full Text | Google Scholar
27. Buckens CF, Dijkhuis G, de Keizer B, Verhaar HJ, de Jong PA. Triagem oportunista para osteoporose em tomografia computadorizada de rotina? Um estudo de validação externa. Eur Radiol. (2015) 25:2074-9. doi: 10.1007/s00330-014-3584-0
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Emohare O, Cagan A, Morgan R, Davis R, Asis M, Switzer J, et al. O uso da atenuação por tomografia computorizada para avaliar a osteoporose após fraturas agudas das vértebras torácica e lombar. Reabilitação do Ortopedista Geriatra Orthop Surg Rehabil. (2014) 5:50-5. doi: 10.1177/2151458514525042
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Alacreu E, Moratal D, Arana E. Triagem oportunista para osteoporose por TC de rotina no sul da Europa. Osteoporos Int. (2017) 28:983-90. doi: 10.1007/s00198-016-3804-3
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Lee S, Chung CK, Oh SH, Park SB. Correlação entre a densidade mineral óssea medida por absorptiometria de raios X de energia dupla e as unidades hounsfield medidas por tomografia computadorizada diagnóstica na coluna lombar. Korean Neurosurg Soc. (2013) 54:384-9. doi: 10.3340/jkns.2013.54.5.384
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Miyabara Y, Holmes D, Camp J, Miller VM, Kearns AE. Comparação da densidade mineral óssea calibrada e não calibrada por TC com DEXA em mulheres na menopausa. Climatério. (2012) 15:374-81. doi: 10.3109/13697137.2011.618566
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Park SH, Kim JC, Lee JE, Park IK. Fratura por insuficiência pélvica após radioterapia em pacientes com câncer cervical na era da PET/CT. Radiat Oncol J. (2011) 29:269-76. doi: 10.3857/roj.2011.29.4.269
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Wei RL, Jung BC, Manzano W, Sehgal V, Klempner SJ, Lee SP, et al. Perda da densidade mineral óssea nas vértebras torácicas e lombares após a radiação para os cancros abdominais. Radiother Oncol. (2016) 118:430-6. doi: 10.1016/j.radonc.2016.03.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Leave a Reply