Anatomia dos Nodos Cardíacos e Sistema de Condução Especializada Atrioventricular | Revista Española de Cardiología
INTRODUÇÃO
Os estudos clássicos de Stannius1 em 1852 foram os primeiros a propor que a condução cardíaca era miogênica. Há cerca de um século atrás foi demonstrado que o tecido muscular especializado era responsável pelo início e propagação do batimento cardíaco. Em 1906, Sunao Tawara2 confirmou a existência de um feixe muscular descrito por His3, em 1893. Também em 1906, Keith e Flack4 confirmaram a existência do sistema His-Tawara. Um ano depois eles descreveram a estrutura do nó sinoatrial (SA).5
Embora Purkinje6 tenha sido o primeiro a descrever fibras ventriculares especializadas, ele desconhecia a importância delas na estrutura do coração, e foi Tawara2 que mostrou que o feixe muscular descrito por His era contínuo com as fibras de Purkinje ventricular.6 Os estudos de Tawara foram recentemente traduzidos para o inglês,7 embora a primeira tradução de parte de seu trabalho para este idioma tenha sido feita por Robb8 em seu livro de texto de 1965. Estes trabalhos são leitura básica para todos os pesquisadores que estudariam o sistema de condução cardíaca (SC).
COMPONENTES DO SISTEMA ESPECÍFICO DE CONDUÇÃO ATRIOVENTRICULAR
O feixe muscular que liga os átrios aos ventrículos foi descrito por His3 como um “feixe penetrante”. Entretanto, His não observou a continuação histológica deste feixe no átrio direito com o nó atrioventricular (AV), os ventrículos ou as células de Purkinje ventriculares. Foi Tawara2 quem reconheceu esta conexão enquanto trabalhava para o seu doutorado sob a direção de Aschoff. Anteriormente, em 1893, tanto Kent9 como His3 haviam descrito conexões musculares AV que foram a causa de muita confusão por muitos anos.10 Mais tarde, observou-se que essas conexões não eram encontradas em corações saudáveis, mas naqueles que estavam doentes.
Seguindo os achados de Kent e His, tanto cardiologistas clínicos quanto fisiologistas procuraram a estrutura responsável pela geração do impulso cardíaco. Suspeitou-se que esta estava situada na área de união entre a veia cava superior e o átrio direito; sob condições experimentais esta é a última parte do coração a parar de bater (o chamado ultimum moriens). Em 1907, Keith e Flack5 distinguiram o nó SA ou nó sinusal em todos os mamíferos que estudaram, incluindo os humanos. Acreditava-se que suas células constituintes eram o local de origem do impulso cardíaco.
O CS surge no nó SA, que é encontrado no átrio direito anterior superior (Figura 1). O nó AV é encontrado em uma posição inferior, posterior, no átrio. O SC estende-se do nó AV até o feixe penetrante do dele e depois se divide nos ramos do feixe esquerdo e direito que descem através do septo interventricular, envoltos em uma bainha de tecido conjuntivo que os isola do tecido muscular circundante. Dentro do miocárdio eles são contínuos com a rede de Purkinje (Figura 1).
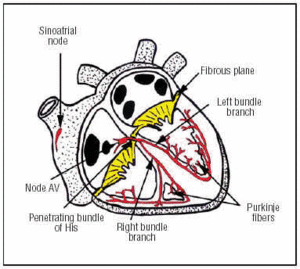
Fig. 1. Representação esquemática do sistema de condução cardíaca (vermelho). O feixe penetrante de Suas perfurações performa o plano atrioventricular fibroso (AV).
Áreas de interesse morfológico-macroscópico
Várias áreas macroscópicas de interesse ajudam a localizar o CS cardíaco. O nó SA, que é subepicárdico (Figura 2a), está encravado na junção entre a musculatura da veia cava superior e a do apêndice atrial. A sua base é oposta à crista terminal. A distância entre o nó SA e o epicárdio é de 0,3±0,1 mm.11 Em cerca de 10% das pessoas, o nó não se estende em direção à veia cava inferior, mas sim em forma de ferradura em torno da parte inferior do orifício da veia cava superior.12 O nó AV é encontrado na base do septo atrial, no ápice de uma área triangular ilustrada primeiramente por Koch.13 Este triângulo está situado na superfície endocárdica do átrio direito (Figuras 2b e c), é delimitado anteriormente pela inserção da cúspide septal da válvula tricúspide e, posteriormente, por um tendão fibroso conhecido como o tendão de Todaro. Este tendão é a continuação fibrosa subendocárdica da valva de Eustáquio, e se insere na musculatura atrial separando o orifício do seio coronário da fossa oval. O ápice deste triângulo é formado superiormente pela junção das bordas anterior e posterior mencionadas acima, correspondendo ao corpo fibroso central (BCF) do coração. A base do triângulo é formada pelo orifício do seio coronário junto com o vestíbulo do átrio direito que suporta o folheto septal da valva tricúspide. Esta base é conhecida pelos eletrofisiologistas como o istmo septal, e é aqui que a ablação por radiofrequência da via lenta é realizada em pacientes com taquicardia nodal reentrante AV.14
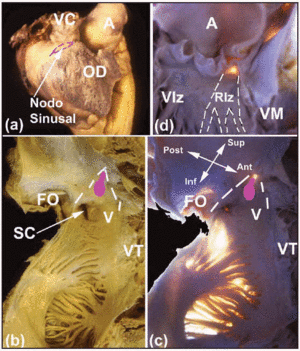
Fig. 2. A: vista epicárdica lateral do átrio direito com o local do nó SA mostrado pela linha rosa a tracejado. B e C: vista endocárdica (normal e com transiluminação) das paredes posterior e septal do átrio direito para mostrar a fossa oval (OF) e os limites do triângulo de Koch (linhas brancas tracejadas), o tendão de Todazo (TT) e a inserção da cúspide septal da valva tricúspide (TV). O vestíbulo (V) do átrio direito e o orifício do seio coronário (SC) formam o limite inferior. A localização do nódulo AV é mostrada por um nódulo oval (rosa). D: visão ventricular esquerda para mostrar o septo membranoso (transiluminação). Este é o ponto de emergência do feixe de His e sua continuidade com os ramos do feixe direito e esquerdo. O ramo do feixe esquerdo (LBB) é marcado com linhas brancas tracejadas. A indica aorta; AA, apêndice atrial; VC, veia cava superior; VD, ventrículo direito; VE, ventrículo esquerdo; VM, valva mitral.
A continuação da condução AV ocorre através do feixe penetrante de His, a única parte do eixo condutivo que perfura a CEC. A CEC é formada pela união do tecido conjuntivo dos folhetos da valva aórtica e mitral com o folheto septal da valva tricúspide – o chamado trigônio fibroso direito – e a parte membranosa do septo interventricular. Em muitos corações de mamíferos, o trigônio é fibroso, mas os corações bovinos têm uma massa central de osso ou cartilagem (os cordis). Em contraste, o tecido fibroso do cachalote CFB é muito frouxo. A porção membranosa ou septo, que pode variar em comprimento, é um bom guia para a localização do feixe AV do seu. Esta aparece acima desta porção membranosa após atravessar o trígono fibroso direito (Figura 2d), e depois se divide nos ramos do feixe esquerdo e direito. O ramo direito passa através da musculatura septal na base do músculo papilar medial do ventrículo direito. Torna-se então uma fina corda que penetra profundamente no trabeculado septomarginal ou banda moderadora ligando os músculos papilares medial e anterior. A origem do ramo esquerdo fica abaixo da comissura entre as cúspides direita e não-coronária da valva aórtica; depois desce pelo subendocárdio do septo interventricular (Figura 2d). Seu caminho é às vezes visível devido à lâmina fibrosa brilhante que a reveste. A parte proximal do ramo esquerdo é muito mais comprida que a direita. Ocasionalmente um terceiro ramo chamado “trajeto sem saída “15 é visto no coração fetal ou infantil, e este continua o seu feixe em direção anterio-superior em direção à raiz da aorta.
estrutura dos nós e do sistema de condução atrioventricular
Estudos nos quais as técnicas histológicas empregadas foram semelhantes às usadas por Tawara2 e mais tarde trabalhadores como Davies16 e Truex et al17 (para mencionar apenas alguns) mostraram que o CS de humanos está arranjado de uma maneira bem parecida com o de outros mamíferos (com pequenas variações entre espécies e entre corações). Tawara2 relatou a separação dos miócitos especializados dos miócitos normais ou de trabalho por uma fina folha de tecido conjuntivo visível sob o microscópio de luz, e nisto se baseiam os critérios propostos por Aschoff18 e Mönckeberg19 para a identificação histológica do miocárdio especializado. Simplificando, os miócitos especializados destacam-se dos miócitos de trabalho quando vistos sob o microscópio de luz e podem ser “seguidos” de uma secção histológica para a outra. Em sua monografia, Robb8 preferiu definir o tecido condutor com o termo “conexão” em vez de “condução”, pois as preparações histológicas definem melhor a morfologia celular do que a função. Ele também observou diferenças na textura do miocárdio especializado, dependendo do frescor do material de autópsia e dos métodos de fixação e coloração utilizados. Tawara2 estava ciente disso e apontou a heterogeneidade da morfologia do miocárdio especializado, mesmo em cortes histológicos do coração. Dentro de uma determinada espécie, as diferenças mais óbvias estão relacionadas à idade dos indivíduos examinados.20 Nos últimos anos, diferentes marcadores moleculares e imunohistoquímicos têm sido usados para localizar o tecido condutor em corações embrionários de humanos e outros mamíferos. No entanto, nenhum marcador específico foi encontrado que possa destacar este tecido em humanos adultos.
No coração humano normal, os nós SA e AV não atendem aos critérios de Aschoff e Mönckeberg18,19 porque não são isolados eletricamente do miocárdio circundante por tecido conjuntivo ou gorduroso. Ao invés disso, eles entram em contato com fibras atriais de trabalho após uma pequena área composta de células de transição. No nó SA, Keith e Flack5 distinguiram entre as células sinusais e as células de trabalho. Tawara2, no entanto, indicou as dificuldades que encontrou em diferenciar as células do nó AV das células do feixe dele. Ele, portanto, propôs que a diferença entre elas era puramente anatômica. Com base nessa definição, a porção do SC completamente embainhada pelo BAFC é chamada de feixe penetrante ou feixe de His (Figura 3a). A porção atrial do sistema de condução proximal até o feixe de His é chamada de nó AV (Figura 3b). Esta distinção anatômica é lógica porque o isolamento do feixe penetrante de His impede que ele faça contato direto com a atividade elétrica do átrio aferente. Portanto, qualquer atividade atrial deve ser previamente dirigida através do nó AV.
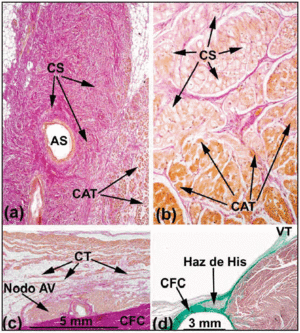
Fig. 3. Secções histológicas sagitais do nó sinoatrial (SA) do coração humano (a;x10) e do coração de porco (b;x40) coradas com o método van Gieson. Observe o contato entre as células sinusais (SC) e as células atriais de trabalho (WAC). As células sinusais são caracterizadas por serem mais claras e embutidas numa maior quantidade de tecido conjuntivo (vermelho). c: secção van Gieson manchada da zona média do triângulo de Koch. Observe a forma do nó compacto AV e das células de transição (TC) em contato com a superfície convexa do nó compacto. d: A secção tricromada de Masson mostrando o feixe penetrante do Seu cercado por tecido fibroso (verde) do CFB. O SNA indica artéria do nó sinusal; CFB, corpo fibroso central; TV, válvula tricúspide.
A função intrínseca do nó SA é ser a fonte do impulso cardíaco. O nódulo SA em humanos é uma estrutura arqueada ou fusiforme. Histologicamente é composto de células ligeiramente menores que as células de trabalho normais que estão dispostas em feixes. Estas se misturam sem ordem espacial, mancham fracamente e estão embutidas em uma densa matriz de tecido conjuntivo (Figuras 3 a e b). Com a idade, a quantidade de tecido conjuntivo aumenta com relação à área ocupada pelas células nodais.21 Na periferia do nó, células especializadas são misturadas com as do miocárdio de trabalho (Figuras 3a e b). Além disso, múltiplas radiações ou extensões interdigitantes com o miocárdio atrial de trabalho têm sido descritas. Estas penetram intramiocárdicamente na crista terminal, e nas veias cavas superior e inferior. O nó SA é organizado em torno de uma artéria conhecida como artéria do nó sinusal, que pode correr de forma central ou excêntrica dentro do nó. Em 29% dos corações humanos esta artéria ramifica-se dentro do nó.11 O nó SA também está intimamente associado com o sistema nervoso autônomo. Tem sido sugerido que a maioria dessas fibras nervosas é parassimpática, sendo as fibras simpáticas concentradas ao redor dos vasos sanguíneos do nó.23
A função inerente do nó AV é retardar o impulso cardíaco. Em humanos, este nó tem uma porção compacta e uma área de células de transição. O primeiro é semi-oval e fica sobre o CFB (Figura 3c). Nas seções próximas à base do triângulo de Koch, a parte compacta do nó se divide em duas extensões ou prolongamentos. A artéria vascularizando o nó AV é normalmente encontrada entre estas. O comprimento dessas extensões varia de um coração para outro.24 O tamanho das células de transição é intermediário entre as células do nó AV e as células atriais de trabalho. Elas estão circundadas por uma quantidade maior de células conjuntivas do que a que cobre as células de trabalho, mas não estão isoladas do miocárdio adjacente. Ao contrário, elas formam uma espécie de ponte entre o miocárdio de trabalho e o nodal, e coletam informações elétricas das paredes atriais, transmitindo-as ao nó AV.
A controvérsia envolve como o impulso do nó SA chega ao nó AV. Alguns autores têm sugerido a existência de tratos especializados entre eles.25 Nossos estudos não apóiam esta idéia, mas favorecem a hipótese de que as próprias fibras musculares trabalhadoras (e sua disposição geométrica nas paredes atriais) são responsáveis pela condução mais rápida em algumas áreas do átrio do que em outras.26
O nó AV continua distalmente com o feixe penetrante de His (Figura 3d), embora existam pequenas diferenças em termos de disposição celular entre estas duas estruturas, incluindo a disposição do feixe de Suas células de forma mais paralela. A explicação para isto pode ser morfológica: o feixe de His começa a ser cercado pelo tecido conjuntivo do CFB, tornando-se assim um trato condutor que leva informações aos ventrículos.
O nó AV do cão é menor do que o dos humanos, mas tem um feixe mais penetrante de His.27 Alguns autores28 interpretam isto como significando que uma porção do nó AV do cão está dentro do CFB. No coelho, outros autores29 descrevem parte do feixe dele como se fosse parte do nó AV, mas isto é um erro (Figuras 4a-d). A diferença morfológica mais marcante entre o nó AV do cão e os do coelho e humanos é que o primeiro não está coberto por células de transição. Em ratos (com um ritmo cardíaco em repouso 10 vezes mais rápido que o dos cães ou humanos), o nó AV é proporcionalmente comparável ao do cão, mas o CFB é menor.
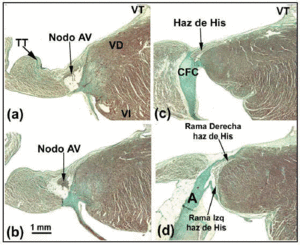
Fig. 4. Esta figura composta mostra o nó atrioventricular (AV) mais o feixe de Seus e seus ramos direito e esquerdo no coelho. A barra horizontal em b representa 1 mm (igual para todas as imagens). Coloração tricromada de Masson. A indica a aorta; TT, tendão de Todaro; VD, ventrículo direito; VE, ventrículo esquerdo; TV, válvula tricúspide.
Quando a trajetória histológica do sistema de condução é seguida em direção ao feixe penetrante de His, este último é visto virado para a esquerda em muitos corações humanos, e emerge na crista muscular do septo interventricular. Rodeado pelo tecido conjuntivo do CFB, o comprimento do seu feixe pode variar antes de se dividir nos ramos do feixe esquerdo e direito. Os ramos anteriores se cascata sobre o lado esquerdo do septo interventricular (Figuras 5a e c). A divisão do feixe de His assemelha-se a um jockey agachado acima da crista muscular do septo interventricular (Figura 5a). No entanto, em algumas ocasiões é desviado para a esquerda (Figura 5c). Quando isto ocorre, o ramo direito entra no interior da musculatura do septo (Figura 5b), aparecendo no ventrículo direito em associação com a inserção do músculo papilar medial.
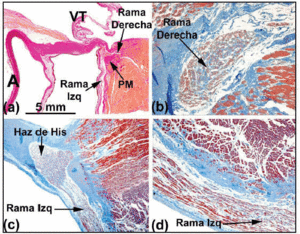
Fig. 5. a: seção de van Gieson mostrando o feixe de His (coração humano) sobre a porção membranosa (MP) do septo interventricular. b: na sua origem, o ramo direito neste coração é intramiocárdico e está rodeado por tecido conjuntivo (azul) (coloração tricromada de Jones, x20). c: a divisão do feixe de His neste coração é deslocada sobre o lado esquerdo da crista muscular do septo interventricular, e desce longitudinalmente sob o endocárdio do ventrículo esquerdo (tricromio de Jones, x5). d: observe a bainha conjuntiva de cobertura (azul) do ramo esquerdo (tricromio de Jones, x10). A indica a aorta; E, endocárdio; TV, válvula tricúspide.
Ao longo de seu curso proximal, os ramos do feixe direito e esquerdo são cobertos por uma lâmina fibrosa (Figuras 5b e d). Como mostrou Tawara2 (Figura 6a), em humanos o ramo esquerdo é tipicamente dividido em três fascículos com extensa intercomunicação. Esses fascículos tornam-se ramificados no ápice ventricular, e se estendem para o interior dos dois músculos papilares da valva mitral, mas também de volta ao longo das paredes ventriculares em direção à base cardíaca. Mais distalmente, no ápice dos ventrículos do coração humano, torna-se quase impossível traçar as ramificações das fibras de Purkinje, uma vez que estas perdem sua camada fibrosa e se parecem muito com o miocárdio de trabalho.
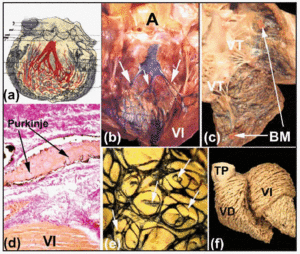
Fig. 6. a: diagrama de Tawara mostrando a disposição trifascicular do ramo do feixe esquerdo em Humanos. b e c: um coração de bezerro fresco no qual os ventrículos direito e esquerdo foram abertos. Injeções subendocárdicas de tinta indiana revelam os ramos do feixe direito e esquerdo e a rede Purkinje. Nota em B os três fascículos do ramo do feixe esquerdo (setas), e em C a banda moderadora (MB). d: seção de um coração de bezerro (coloração van Gieson, x100) obtida após a injeção da tinta indiana na rede Purkinje), que é envolvida na sua origem pelo tecido conjuntivo (vermelho). e: disposição subendocárdica da rede Purkinje no ventrículo esquerdo de um bezerro. Observe o arranjo elíptico da rede e dos ramos das bordas que penetram no miocárdio (setas). f: dissecção das fibras musculares ventriculares de um coração humano adulto. Notar a diferença de arranjo entre as camadas medial e profunda do ventrículo esquerdo. A indica aorta; TP, tronco pulmonar; VE, ventrículo esquerdo; VE, ventrículo esquerdo; TV, valva tricúspide.
A injeção subendotelial de tinta indiana é um dos métodos utilizados para observar estas folhas fibrosas e demonstrar o curso subendocárdico dos ramos do feixe direito e esquerdo e suas ramificações nos corações ungulados (Figuras 6b e d). Nossos estudos sobre os corações de ovelhas e bezerros mostram que estes variam um pouco em relação aos corações humanos. Os corações de bezerros são mais parecidos com os corações humanos na medida em que os fascículos do ramo esquerdo do feixe são geralmente três em número e originam-se na parte superior do septo interventricular (Figura 6b). Entretanto, os corações de ovelhas mostram apenas dois fascículos, e estes aparecem na metade do comprimento da parede do septo. Tanto nos corações de ovelhas quanto nos de bezerros, pequenas trabéculas musculares atravessam a cavidade ventricular – o chamado “falso tendão” – que dentro delas carregam ramificações distais dos Seus ramos em direção aos músculos papilares e às paredes ventriculares adjacentes. No lado direito do coração, a banda moderadora tanto do coração da ovelha quanto do coração do bezerro é mais esbelta do que a dos humanos, mas dentro dela sempre contém um ramo do feixe direito (Figura 6c).
Em corações ungulados a rede subendocárdica Purkinje é elíptica na disposição, tanto no ventrículo esquerdo quanto no direito (Figura 6e). Além disso, de seu contorno surgem ramos que penetram nas paredes ventriculares, levando a novos ramos ou anastomoses com outros ramos (Figura 6e). Entretanto, ramos intramurais da rede de Purkinje não foram demonstrados no coração humano.30
Um ponto controverso em relação à rede de Purkinje é a existência de células de transição entre o miocárdio ventricular de trabalho e as fibras de Purkinje.31 Os estudos anatômicos e imunohistoquímicos de Oosthoek et al,30 mostram que, nos corações bovinos, existe uma zona muito pequena de células de transição onde as fibras de Purkinje perdem sua cobertura de tecido conjuntivo. Entretanto, tais células não foram observadas no coração da ovelha.32 Quando as fibras de Purkinje perdem sua cobertura de tecido conjuntivo, impulsos elétricos passam do CS para os miócitos de trabalho dos ventrículos. A orientação espacial das miofibrilas de trabalho nas paredes ventriculares determina a natureza anisotrópica da condução ventricular (Figura 6f).
CONCLUSÕES
Embora existam diferenças entre espécies, a estrutura dos nós, assim como a do restante do sistema de condução AV humana, é semelhante à dos animais de laboratório comumente utilizados. O nó SA, a estrutura que gera o impulso cardíaco, está situado em um extremo do átrio direito. Os impulsos dele viajam posteriormente nas paredes atriais através de uma intrincada mas precisa disposição espacial das fibras atriais de trabalho até chegar ao final do átrio. Neste extremo, as células de transição do nó AV recebem o impulso e o retardam antes de sua transmissão através do feixe de His. Este último atravessa o plano fibroso isolante entre os átrios e ventrículos, e transmite o impulso através de dois ramos (os ramos do feixe direito e esquerdo) em direção aos ventrículos correspondentes. Cada um destes ramos é isolado por uma bainha conjuntiva de miócitos ventriculares em funcionamento. Este arranjo permite o contato entre os miócitos especializados e operantes somente nas ramificações distais do feixe de His. Desta forma, o sistema de condução AV, amplamente descrito por Tawara2 há quase 100 anos, é estruturado para dar ordem à transmissão dos impulsos cardíacos. Conhecer a estrutura e localização de tecido condutivo específico dentro do coração poderia ajudar a fornecer soluções para diferentes distúrbios no ritmo cardíaco.
Leave a Reply