8.3: Gases e Pressão
Objectivos de aprendizagem
- Para descrever a fase gasosa.
A fase gasosa é única entre os três estados da matéria na medida em que existem alguns modelos simples que podemos utilizar para prever o comportamento físico de todos os gases – independentemente das suas identidades. Não podemos fazer isso para os estados sólido e líquido. Na verdade, o desenvolvimento deste entendimento do comportamento dos gases representa o ponto de divisão histórico entre a alquimia e a química moderna. Os avanços iniciais na compreensão do comportamento dos gases foram feitos em meados do século XVI por Robert Boyle, um cientista inglês que fundou a Royal Society (uma das mais antigas organizações científicas do mundo).
Como podemos modelar todos os gases independentemente da sua identidade química? A resposta está num grupo de afirmações chamado teoria cinética dos gases:
- Os gases são compostos de pequenas partículas que são separadas por grandes distâncias.
- As partículas de gás estão em constante movimento, experimentando colisões com outras partículas de gás e as paredes do seu recipiente.
- A velocidade das partículas de gás está relacionada com a temperatura de um gás.
- As partículas de gás não experimentam qualquer força de atração ou repulsão entre si.
Nota que nenhuma destas afirmações está relacionada com a identidade do gás? Isto significa que todos os gases devem comportar-se de forma semelhante. Um gás que segue perfeitamente estas afirmações é chamado de gás ideal. A maioria dos gases apresenta pequenos desvios em relação a estas afirmações e são chamados gases reais. Entretanto, a existência de gases reais não diminui a importância da teoria cinética dos gases.
Uma das afirmações da teoria cinética menciona colisões. Como as partículas de gás estão em constante movimento, elas também estão em constante colisão umas com as outras e com as paredes do seu recipiente. Há forças envolvidas à medida que as partículas de gás ricocheteiam nas paredes do recipiente (Figura \PageIndex{1}}). A força gerada pelas partículas de gás divididas pela área das paredes do contêiner produz pressão. A pressão é uma propriedade que podemos medir para um gás, mas normalmente não consideramos a pressão para sólidos ou líquidos.
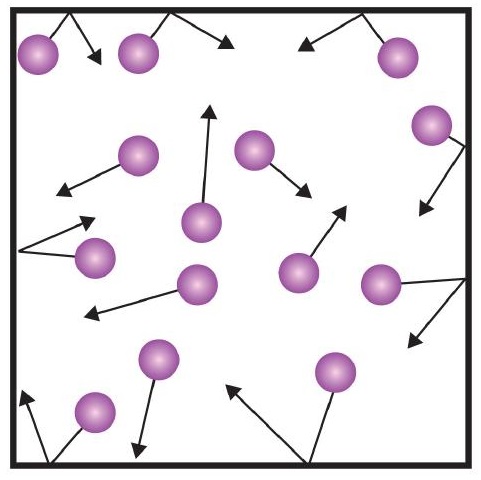
A unidade básica de pressão é o newton por metro quadrado (N/m2). Esta unidade combinada é redefinida como uma pascal (Pa). Uma pascal não é uma quantidade muito grande de pressão. Uma unidade de pressão mais útil é o bar, que é 100.000 Pa (1 bar = 100.000 Pa). Outras unidades comuns de pressão são a atmosfera (atm), que foi originalmente definida como a pressão média da atmosfera terrestre ao nível do mar; e mmHg (milímetros de mercúrio), que é a pressão gerada por uma coluna de mercúrio de 1 mm de altura. A unidade milímetros de mercúrio também é chamada de torr, cujo nome vem do cientista italiano Evangelista Torricelli, que inventou o barômetro em meados dos anos 1600. Uma definição mais precisa da atmosfera, em termos de torr, é que há exatamente 760 torr em 1 atm. Uma barra equivale a 1.01325 atm. Dadas todas as relações entre estas unidades de pressão, a capacidade de converter de uma unidade de pressão para outra é uma habilidade útil.
Exemplo {1}(\PageIndex{1}}): Conversão de pressões
Escreva um fator de conversão para determinar quantas atmosferas estão em 1.547 mmHg.
>
Solução
Porque 1 mmHg é igual a 1 torr, a pressão dada também é igual a 1.547 torr. Como há 760 torr em 1 atm, podemos usar este fator de conversão para fazer a conversão matemática:
\(\mathrm{1,547\\: torr}times \dfrac{1\: atm}{760\: torr}=2.04\: atm})
Nota como as unidades torr cancelam algebricamente.
Exercicio {1}(PageIndex{1}): Conversão de Pressões
Escreva um factor de conversão para determinar quantos milímetros de mercúrio estão em 9,65 atm.
Resposta
(\\mathrm{9,65\: atm por vezes \frac{760\: mm Hg}{1\: atm}=7,334 \: mm Hg}).
A teoria cinética também afirma que não há interacção entre partículas de gás individuais. Embora saibamos que existem, de facto, interacções intermoleculares em gases reais, a teoria cinética assume que as partículas de gás estão tão afastadas que as partículas individuais não se “sentem” umas às outras. Assim, podemos tratar partículas de gás como pequenos pedaços de matéria cuja identidade não é importante para certas propriedades físicas.
Exercício de Revisão de Conceito
-
O que é pressão, e que unidades usamos para expressá-la?
Resposta
-
Pressão é a força por unidade de área; suas unidades podem ser pascal, torr, milímetros de mercúrio, ou atmosferas.
Key Takeaway
- A fase gasosa tem certas propriedades gerais características dessa fase.
Exercícios
-
Qual é a teoria cinética dos gases?
-
De acordo com a teoria cinética dos gases, as partículas individuais de gás estão (sempre, frequentemente, nunca) em movimento.
-
Por que razão um gás exerce pressão?
-
Por que razão a teoria cinética dos gases nos permite presumir que todos os gases terão um comportamento semelhante?
-
Alterar as seguintes quantidades de pressão, por ordem, da menor para a maior: 1 mmHg, 1 Pa, e 1 atm.
-
Que unidade de pressão é maior – a torr ou a atmosfera?
-
Quantas torr existem em 1.56 atm?
-
Converta 760 torr em pascals.
-
Pressão das cheias são expressas em milímetros de mercúrio. Qual seria a pressão arterial em atmosferas se a pressão arterial sistólica de um paciente é 120 mmHg e a diastólica é 82 mmHg? (Em medicina, tal pressão arterial seria relatada como “120/82”, falado como “cento e vinte sobre oitenta e dois”)
-
Em previsão do tempo, a pressão barométrica é expressa em polegadas de mercúrio (in. Hg), onde há exatamente 25,4 mmHg em cada 1 in. Hg. Qual é a pressão barométrica em milímetros de mercúrio se a pressão barométrica for relatada como 30,21 in. Hg?
Respostas
-
Gases são compostos de pequenas partículas que são separadas por grandes distâncias. As partículas de gás estão em constante movimento, sofrendo colisões com outras partículas de gás e com as paredes do seu recipiente. A velocidade das partículas de gás está relacionada com a temperatura de um gás. As partículas de gás não experimentam nenhuma força de atração ou repulsão entre si.
-
Um gás exerce pressão à medida que suas partículas ricocheteiam nas paredes de seu recipiente.
-
1 Pa, 1 mmHg, e 1 atm
-
1,190 torr
9. 0,158 atm; 0,108 atm
10. 767,3 mm Hg
Leave a Reply