Samozniszczające się komary i sterylizowane gryzonie: obietnica napędów genowych
Austin Burt i Andrea Crisanti przez osiem lat próbowali porwać genom komara. Chcieli ominąć naturalną selekcję i wprowadzić gen, który rozprzestrzeniałby się w populacji szybciej niż mutacja przekazywana w zwykłym procesie dziedziczenia. W tyle ich umysłów był sposób, aby zapobiec malarii poprzez rozprzestrzenianie genu, aby znokautować populacje komarów tak, że nie mogą przenosić choroby.
Crisanti pamięta niepowodzenie w kółko. Ale w końcu, w 2011 roku, dwaj genetycy z Imperial College London otrzymali wyniki DNA, na które liczyli: gen, który wprowadzili do genomu komara, rozprzestrzenił się w populacji, docierając do ponad 85% potomków owadów1.
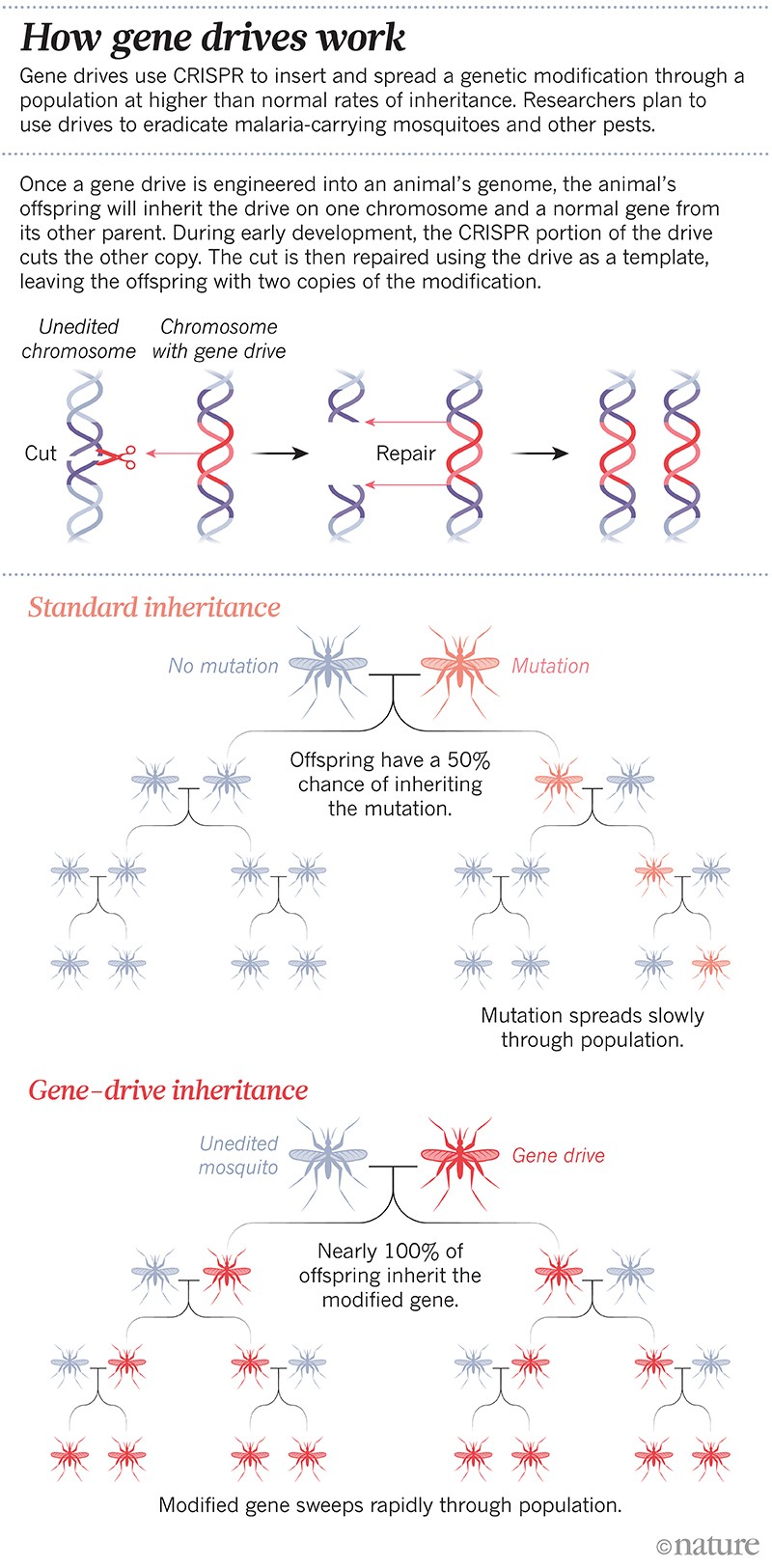
To był pierwszy zmodyfikowany „napęd genowy”: modyfikacja genetyczna zaprojektowana w celu rozprzestrzeniania się w populacji przy wyższym niż normalny tempie dziedziczenia. Napędy genowe szybko stały się rutynową technologią w niektórych laboratoriach; naukowcy mogą teraz stworzyć napęd w ciągu kilku miesięcy. Technika ta opiera się na narzędziu do edycji genów CRISPR i pewnych fragmentach RNA, które zmieniają lub wyciszają określony gen lub wprowadzają nowy. W następnym pokoleniu cały napęd kopiuje się na chromosom partnera, tak że w genomie nie ma już naturalnej wersji wybranego genu, a zamiast tego znajdują się dwie kopie napędu genowego. W ten sposób zmiana jest przekazywana nawet 100% potomstwa, a nie około 50% (patrz „Jak działają napędy genowe”).
Od 2014 r. naukowcy skonstruowali oparte na CRISPR systemy napędów genowych u komarów, muszek owocowych i grzybów, a obecnie rozwijają je u myszy. Ale to dopiero początek historii. Pytania o to, czy napęd genowy jest możliwy, zostały wyparte przez inne niewiadome: jak dobrze będą działać, jak je testować i kto powinien regulować tę technologię. Napędy genowe zostały zaproponowane jako sposób na zmniejszenie lub wyeliminowanie chorób przenoszonych przez owady, kontrolowanie gatunków inwazyjnych, a nawet odwrócenie odporności szkodników na insektycydy. Żaden napęd genowy nie został jeszcze wypuszczony na wolność, ale technologia ta może być gotowa już za trzy lata, mówi Crisanti. Współpracuje on z organizacją Target Malaria, międzynarodowym konsorcjum badawczym non-profit, którego celem jest wykorzystanie komarów z napędem genowym do zwalczania malarii w Afryce. W dniu 1 lipca grupa ta wypuściła testową partię komarów – zmodyfikowanych genetycznie, ale jeszcze nie wyposażonych w napędy genowe – w wiosce w Burkina Faso.
Napędy genowe są niepodobne do żadnej ekologicznej poprawki, jaką kiedykolwiek wcześniej testowano, mówi Fredros Okumu, dyrektor naukowy Instytutu Zdrowia Ifakara w Dar es Salaam w Tanzanii. „Napędy genowe będą się same rozprzestrzeniać” – mówi. „Musimy przygotować ludzi i otwarcie dzielić się informacjami ze wszystkimi zainteresowanymi krajami.”
Wyzwania techniczne nie są tak zniechęcające jak społeczne i dyplomatyczne, mówi bioinżynier Kevin Esvelt z Massachusetts Institute of Technology (MIT) Media Lab w Cambridge, który jako jeden z pierwszych zbudował napęd genowy oparty na CRISPR. „Technologie takie jak ta mają rzeczywiste konsekwencje dla życia ludzi, które mogą być niemal natychmiastowe.”
Zważywszy na potencjalne obawy dotyczące napędów genowych, Nature bada pięć kluczowych pytań dotyczących technologii i jej zastosowań.
Czy napędy genowe w ogóle zadziałają?
Zbudowanie napędu genowego w celu manipulacji lub eliminacji populacji jest jak podjęcie walki z doborem naturalnym, a walka ta może nie być łatwa do wygrania.
Jak tylko naukowcy zaczęli regularnie tworzyć napędy genowe w laboratoriach, zwierzęta rozwinęły przeciwko nim odporność – gromadząc mutacje, które uniemożliwiały rozprzestrzenianie się napędów. W testach dwóch napędów wprowadzonych do muszek owocowych, na przykład, warianty genetyczne nadające odporność tworzyły się często2. Najczęściej mutacje zmieniają sekwencję, którą CRISPR jest w stanie rozpoznać, uniemożliwiając edycję genu. W eksperymentach z komarami w klatkach, Crisanti i Tony Nolan, badacz z Target Malaria, obserwowali, jak napęd genowy stopniowo zmniejsza częstotliwość występowania w ciągu wielu pokoleń z powodu opornych mutacji w docelowym genie3. Wyniki te wstrząsnęły branżą. Czy odporność sprawi, że napędy genowe staną się bezsilne?
Niekoniecznie – jeśli badacze wybiorą właściwy cel. Niektóre geny są bardzo konserwowane, co oznacza, że każda zmiana prawdopodobnie zabije ich właścicieli. Wybieranie tych genów jako celu napędu oznacza mniej mutacji i mniejszą odporność. We wrześniu 2018 r., Crisanti i jego zespół rozbili populację komarów Anopheles gambiae w klatkach ze 100% skutecznością4 poprzez stworzenie napędu, który zakłóca gen płodności zwany doublesex. Po wprowadzeniu napędu samice komarów nie mogą gryźć i nie składają jaj; w ciągu 8-12 pokoleń populacje w klatkach w ogóle nie produkowały jaj. A ponieważ jest on kluczowy dla prokreacji, doublesex jest odporny na mutacje, w tym te, które nadawałyby odporność konstruktowi napędu.
Zespół przeprowadził dziewięć eksperymentów klatkowych z ponad milionem wstawek napędu ukierunkowanych na doublesex i nie zaobserwował żadnego oporu, mówi Crisanti. Teraz zespół dostosowuje napęd do cięcia nie jednego, ale dwóch loci na genie doublesex, jak w przypadku leczenia choroby kombinacją leków. „Chcę się upewnić, że prawdopodobieństwo rozwoju oporności jest bardzo, bardzo odległe, zanim powiem, że technologia jest gotowa do zastosowania w terenie”, mówi Crisanti.
W ssakach naukowcy mają do czynienia z dużo bardziej podstawowymi wyzwaniami niż oporność. W ubiegłym roku Kim Cooper i jej koledzy z Uniwersytetu Kalifornijskiego w San Diego (UCSD) stworzyli początki napędu genowego u ssaków – napędu, który przerywa działanie genu myszy Tyr i sprawia, że płaszcze zwierząt stają się białe5. Napęd był tylko w 72% skuteczny w kopiowaniu siebie w genomie i nie działał dobrze w męskiej linii zarodkowej, mówi Cooper. Podejrzewa ona, że dzieje się tak dlatego, że podziały komórkowe następują w różnym czasie podczas tworzenia jaj i plemników, co wydaje się wpływać na zdolność napędu do skutecznego kopiowania się z jednego chromosomu do drugiego.
W tym eksperymencie napęd nie rozmnażał się samoczynnie, a Cooper nie śledziła cechy przez wiele pokoleń, więc podkreśla, że technicznie nie można go uznać za napęd genowy. „Wciąż pozostaje wiele do zrobienia, aby pokazać, że coś takiego jest w ogóle wykonalne” – dodaje.
Do czego jeszcze przydają się napędy genów?
Pomimo że w tej dziedzinie dominują zastosowania związane z komarami, proponowane zastosowania napędów genów obejmują również zachowanie delikatnych ekosystemów i przyspieszenie pracy laboratoryjnej.
Niektóre organizmy mają genomy, którymi trudno manipulować, ale takie działanie może pomóc naukowcom w ich badaniu. Weźmy na przykład Candida albicans, często oporny na leki ludzki patogen grzybiczny. Jako badaczka podoktorska w Broad Institute i MIT w Cambridge, Massachusetts, Rebecca Shapiro opracowała system6 umożliwiający wprowadzanie mutacji do grzyba z niemal stuprocentową skutecznością. Może ona teraz hodować grzyba, aby wyciszyć dwa niezależne geny i przekazać te mutacje potomstwu. „To działa szalenie wydajnie” – mówi Shapiro, obecnie pracująca na Uniwersytecie Guelph w Kanadzie. W UCSD Cooper wykorzystuje napędy genowe w podobnym celu, do tworzenia i badania złożonych cech u myszy.
Program Genetycznej Biokontroli Inwazyjnych Gryzoni (GBIRd) chce zrobić więcej z myszami o napędzie genowym niż tylko badać je w laboratorium. GBIRd, partnerstwo uniwersytetów, rządów i organizacji pozarządowych zarządzane przez grupę non-profit Island Conservation, chce wykorzystać tę technologię do wyeliminowania inwazyjnych gryzoni z wysp, gdzie sieją one spustoszenie wśród rodzimej fauny i flory. Obecnie do tego celu stosuje się pestycydy, ale są one drogie i trudne do zastosowania na większych wyspach zamieszkałych przez ludzi. Można je stosować tylko na około 15% wysp, mówi Royden Saah, kierownik programu GBIRd. „Próbujemy przyjrzeć się technologiom, które zajęłyby się pozostałymi 85%.”
Członkowie GBIRd David Threadgill na Texas A&M University w College Station i Paul Thomas na University of Adelaide w Australii rozwijają technologie napędu genowego u myszy, chociaż Saah szacuje, że minie kilka lat, zanim te napędy będą działać z powodzeniem.
W międzyczasie niektórzy badacze komarów mają nadzieję spróbować czegoś bardziej subtelnego niż całkowite wymazanie populacji owadów jako środka zapobiegania chorobom. W majowym preprint7, Omar Akbari i jego koledzy z UCSD zmodyfikowali komary Aedes aegypti do ekspresji przeciwciała, które chroniło owady przed wszystkimi czterema głównymi szczepami dengi. Teraz dołączają to przeciwciało do dysku, aby sprawdzić, czy będzie się ono rozprzestrzeniać. Akbari buduje również uniwersalny napęd genowy, który aktywuje toksynę, gdy jakikolwiek wirus, nie tylko denga, zainfekuje A. aegypti. „Chcemy zbudować konia trojańskiego w komarze” – mówi Akbari. „Kiedy komar zostaje zainfekowany wirusem – czy to denga, Zika, chikungunya, żółta gorączka, cokolwiek – aktywuje nasz system, który zabija komara.”
Czy napędy genowe mogą być kontrolowane?
Zanim Kevin Esvelt kiedykolwiek zbudował pojedynczy napęd genowy oparty na CRISPR, budził się zlany zimnym potem myśląc o konsekwencjach. „Zdałem sobie sprawę, że to nie będzie dotyczyć tylko malarii, ale potencjalnie będzie to coś, co każda osoba, która może stworzyć transgeniczną muszkę owocową, może zbudować, aby edytować wszystkie muszki owocowe.”
Nie jest więc zaskoczeniem, że w 2014 roku, kiedy Esvelt i genetyk George Church zbudowali swój pierwszy napęd genowy w Harvard Medical School w Bostonie, Massachusetts, jednocześnie zbudowali napęd odwracający, aby nadpisać oryginalny napęd na polecenie8.
Reszta pola poszła za przykładem, rozwijając napędy genowe z wbudowanymi kontrolami, zewnętrznymi nadpisaniami lub obiema. Finansowanie większości tych wysiłków to Agencja Zaawansowanych Projektów Badawczych Obrony USA (DARPA), ramię badawcze Departamentu Obrony USA. W 2017 r. w ramach programu „Bezpieczne geny” DARPA ogłosiła, że przeznacza 65 mln USD na siedem amerykańskich zespołów badawczych badających sposoby kontrolowania, przeciwdziałania i odwracania napędów genowych. „Łagodzimy potencjał niewłaściwego użycia, niezależnie od tego, czy jest to przypadkowe, czy nikczemne” – mówi Renee Wegrzyn, kierownik programu Safe Genes.
Esvelt, finansowany w początkowej fazie programu, opracował samowyczerpujący się napęd znany jako napęd daisy. Napęd jest tak skonstruowany, że traci jedno ogniwo naraz, jak gdyby wyrywał jeden kwiat z łańcucha połączonego od głowy do łodygi, aż do wyczerpania w ciągu kilku pokoleń9.
Na UCSD zespół Akbariego, finansowany przez DARPA, opracowuje napędy genowe, które nie powinny być w stanie rozprzestrzeniać się poza docelową populację komarów lub much. Jeden z takich napędów wymaga ciągłego uwalniania przez wiele pokoleń. Kiedy przestaje być uwalniany, ulega rozcieńczeniu z dzikimi wersjami genu i wymazuje się w ciągu czterech lat. To może być wystarczająco długo, aby wyeliminować wirusy takie jak Zika lub denga z populacji komarów, mówi Akbari. „To coś, co jest, moim zdaniem, nieco bezpieczniejsze i nadal dość skuteczne”. Zespół wyprodukował już kilka wersji tych napędów dla A. aegypti, głównego wektora wirusa dengi10.
Zespół Target Malaria opracowuje również środek zaradczy, finansowany przez DARPA, aby zatrzymać rozprzestrzenianie się napędu doublesex w populacji.
Jak można wypróbować napędy genowe?
W miejsce testów terenowych – których wyraźnie zabrania kontrakt DARPA Safe Genes i na które badacze zgadzają się, że technologia nie jest gotowa – zespoły zwiększają skalę eksperymentów w klatkach i budują modele ekologiczne, aby bezpiecznie zbadać korzyści i zagrożenia związane z wypuszczeniem na wolność.
W mieście Terni w środkowych Włoszech, Crisanti i Nolan wzbogacili swoje klatki z komarami o zmieniające się warunki środowiskowe. „Chcemy zwiększyć skalę, aby przetestować je na różnych podłożach genetycznych, w bardziej realistycznych scenariuszach” – mówi Nolan, który obecnie prowadzi laboratorium w Liverpool School of Tropical Medicine w Wielkiej Brytanii. On i Crisanti chcą odtworzyć naturalne zachowania godowe – takie jak samce tworzące roje w celu przyciągnięcia samic – aby zobaczyć, jak wpływa to na rozprzestrzenianie się napędu genowego.
Dynamika rozprzestrzeniania się napędu w tych klatkach jak dotąd jest „obiecująca”, mówi Crisanti – napęd jest przekazywany skutecznie bez oznak oporu. Jeśli w większych eksperymentach w klatkach nie pojawią się żadne obawy, zespół przekaże technologię niezależnym grupom do przetestowania, aby w ciągu około trzech lat uzyskać zatwierdzenie prawne. Najnowsze badanie11 modeluje populacje komarów w ponad 40 000 osiedli w Burkina Faso i okolicznych krajach. Uwzględnia ono rzeki, jeziora i opady deszczu, jak również dane terenowe dotyczące przemieszczania się komarów. Wyniki11 pokazują, że wielokrotne wprowadzanie, a nie pojedyncze wypuszczanie, zmodyfikowanych komarów w ciągu kilku lat w różnych wioskach będzie potrzebne do zmniejszenia ogólnej liczby owadów.
„Teoria mówi, że w zasadzie, jeśli wypuścisz raz, to rozprzestrzeni się to na cały kontynent. W rzeczywistości dzieje się to bardzo powoli” – mówi biolog populacyjny Charles Godfray z Uniwersytetu Oksfordzkiego w Wielkiej Brytanii, współpracownik organizacji Target Malaria i główny badacz badania.
Innym powodem do niepokoju jest fakt, że napędy genowe mogą potencjalnie zmieniać całe populacje, a zatem całe ekosystemy. Mogłyby również, teoretycznie, negatywnie wpływać na zdrowie ludzkie, powodując ewolucję pasożyta malarii, aby był bardziej zjadliwy lub aby był przenoszony przez innego gospodarza, mówi biolog molekularny i bioetyk Natalie Kofler. Jest ona dyrektorem-założycielem grupy Editing Nature na Uniwersytecie Yale w New Haven w stanie Connecticut, której celem jest zajmowanie się środowiskowymi technologiami genetycznymi na całym świecie. „Ta technologia ma potencjał, aby być niezwykle potężna i zmienić bieg rzeczy, których możemy nie być w stanie przewidzieć”, mówi Kofler.
Kto decyduje, kiedy użyć napędu genowego?
W przypadku badań leków firma może rozpocząć przygotowania do testów terenowych z wyprzedzeniem roku lub dwóch. Napędy genowe będą potrzebowały więcej czasu, mówi Okumu. W zeszłym roku był on członkiem 15-osobowej naukowej grupy roboczej, zorganizowanej przez Fundację Narodowych Instytutów Zdrowia, która przedstawiła szereg zaleceń12 dotyczących wykorzystania komarów napędzanych genami w Afryce Subsaharyjskiej.
W raporcie podkreślono, że rządy, społeczności i lokalni naukowcy będą potrzebowali czasu na przyswojenie nauki i uzyskanie uprawnień do regulowania tej technologii. „Mówię to z całym przekonaniem – w końcu najlepszymi ludźmi do podejmowania tych decyzji są same kraje,” mówi Okumu.
W 2017 roku Kofler zebrał grupę naukowców i etyków, aby zmagać się ze społecznymi pytaniami dotyczącymi napędów genowych13. „Główne pytania koncentrują się wokół sprawiedliwości” – mówi Kofler. W dyskusjach na temat uwalniania genetycznie zmodyfikowanego organizmu do afrykańskiego środowiska, grupy, które historycznie były marginalizowane, mają prawo być częścią procesu decyzyjnego, mówi.
Okumu chce, aby afrykańscy naukowcy rozwijali i testowali technologię napędów genowych lokalnie, co będzie wymagało szacunku i gotowości od fundatorów do wspierania takich wysiłków. „Ludzie boją się nieznanego, a nieznane w tej chwili jest przedstawiany z zachodniej perspektywy,” mówi Okumu. „Z niecierpliwością czekam na dzień, w którym będziemy mogli zbudować te konstrukcje w naszych własnych laboratoriach i w ten sposób budować lokalne zaufanie.”
W sierpniu 2018 roku Narodowa Agencja Bezpieczeństwa Biologicznego Burkina Faso upoważniła Target Malaria do uwolnienia szczepu genetycznie zmodyfikowanego sterylnego samca komara, pierwszego tego rodzaju na kontynencie afrykańskim. W zeszłym tygodniu zespół uwolnił około 6 400 komarów, które zostały zmodyfikowane genetycznie, ale nie są nosicielami napędów genowych. Naukowcy mają nadzieję, że uwolnienie poprawi postrzeganie badań, jak również dostarczy danych dla przyszłych uwolnień.
I chociaż myszy z napędem genowym są dalekie od gotowości do uwolnienia, GBIRd już pracuje z oceniającymi ryzyko, etykami i ekologami, aby zidentyfikować wyspę dla wstępnej próby terenowej. „Chcemy mieć pewność, że zrobimy to dobrze” – mówi Saah. „Niezależnie od tego, jak szybko postępują technologie, możemy już teraz rozwijać nauki społeczne i etykę.”
.
Leave a Reply