Frontiers in Pharmacology
Introduction
Najczęstszemu rodzajowi demencji, chorobie Alzheimera (AD), towarzyszy przewlekłe pogorszenie funkcji poznawczych i stanowi ona 60-70% przypadków demencji (Fan i Chiu, 2014; Lu i in., 2018). Według przeglądu z 2014 roku obecnie na AD cierpi około 35,6 mln osób, a częstość występowania AD stopniowo wzrasta wraz z wiekiem i do roku 2050 na całym świecie dotknie około 115,4 mln osób (Fan i Chiu, 2014). Ogólnie przyjmuje się, że AD jest skomplikowaną chorobą neurodegeneracyjną o wielu patologiach, które głównie związane są z degeneracją przekaźnictwa cholinergicznego, stresem oksydacyjnym, neurozapaleniem i tak dalej (Coyle i in., 1983; Aucoin i in., 2005; Lin i Beal, 2006; Verri i in., 2012; Heneka i in., 2015; Bassani i in., 2017). Inhibitory acetylocholinoesterazy (AChE), takie jak donepezil, rywastygmina i galantamina, są preferencyjnie przepisywane do klinicznego leczenia AD we wczesnych stadiach (Kwon i in., 2010; Rijpma i in., 2014; Kumar i Singh, 2015). Ponadto, antyoksydanty i środki przeciwzapalne są również przysłowiowo stosowane w adiuwantowej terapii AD (Zhou et al., 2016; Demirci et al., 2017). Wszystkie te środki wywierają jednak ograniczoną skuteczność ze względu na stopniową utratę skuteczności wraz z postępem choroby, a leki te wiążą się również z wieloma toksycznymi działaniami niepożądanymi (Zhou i in., 2016; Jeon i in., 2017; Lu i in., 2018). Mianowicie, nie ma obecnie dostępnego zadowalającego leczenia, które mogłoby wyleczyć AD lub zmienić jej postępujący przebieg.
Harmalina (HAL) i harmina (HAR) są obfitymi farmakologicznie alkaloidami β-karbolinowymi Peganum harmala L. o podobnej strukturze chemicznej (Li et al., 2017b). Posiadają one znaczącą aktywność hamującą AChE, monoaminooksydazę (MAO) i mieloperoksydazę (MPO), działanie przeciwutleniające, przeciwzapalne, przeciwnowotworowe i przeciwnadciśnieniowe, a także mogą wpływać na zawartość różnych neuroprzekaźników, co może prowadzić do zmian biochemicznych, fizjologicznych i behawioralnych u zwierząt i ludzi (Mahmoudian i in., 2002; Frison et al., 2008; Jiménez et al., 2008; Herraiz et al., 2010; Louis et al., 2010; Bensalem et al., 2014; Wang et al., 2015; Li et al., 2017a). Zgodnie z naszymi wcześniejszymi badaniami, HAL i HAR wykazywały podobną inhibicję AChE w porównaniu do galantaminy in vitro (Zhao i in., 2013). Ponadto, całkowite alkaloidy (28 mg/kg) P. harmala zawierające głównie HAL i HAR wykazywały działanie poprawiające deficyty uczenia się i pamięci indukowane przez skopolaminę i 30% etanol (He et al., 2015b). Następnie badanie He et al. (2015a) potwierdziło, że HAR (20 mg/kg) może poprawić upośledzoną pamięć u myszy wywołaną skopolaminą poprzez wzmocnienie funkcji cholinergicznych dzięki hamowaniu AChE. Niemniej jednak najnowsze badania wskazały, że HAR był nie tylko substratem izoformy 2 białka związanego z opornością wielolekową (MRP2), ale również miał słabą stabilność metaboliczną, a ostatecznie doprowadził do znacznie niższej biodostępności niż HAL u różnych zwierząt (Li i in., 2017b). Spekuluje się zatem, że skuteczna dawka HAL przeciwko AD może być znacznie niższa niż HAR. Dlatego należy przeprowadzić systematyczne badanie porównawcze dotyczące efektów i mechanizmów antyamnezyjnych tych dwóch analogów w celu poszukiwania preferowanego związku kandydującego do terapii AD.
W obecnym badaniu porównano modulacyjne efekty HAL i HAR na wywołane skopolaminą upośledzenie pamięci za pomocą oceny behawioralnej w labiryncie wodnym Morrisa (MWM). MWM był szeroko stosowany w badaniach neurobiologii i neurofarmakologii uczenia się i pamięci przestrzennej, i który odgrywa ważną rolę w walidacji modeli gryzoni dla zaburzeń neurokognitywnych, takich jak AD (Bromley-Brits et al., 2011). Ponadto przeprowadzono kompleksowe badania biochemiczne, western blotting oraz analizę immunofluorescencyjną w celu wyjaśnienia możliwego wpływu HAL i HAR na niektóre mechanizmy leżące u podstaw postępu AD. Wyniki obecnego badania będą korzystne dla oceny antyamnezyjnego działania alkaloidów β-karbolinowych w dalszych badaniach i rozwoju, a także mogą dostarczyć cennych informacji dla klinicznego leczenia choroby Alzheimera.
Materiały i Metody
Materiały
Harmalina, HAR, L-tryptofan (L-Trp), 5-hydroksytryptamina (5-HT), kwas 5-hydroksyindol-3-octowy (5-HIAA), chlorek acetylocholiny (ACh), chlorek choliny (Ch), kwas γ-aminomasłowy (γ-GABA), monohydrat soli monosodowej kwasu L-glutaminowego (L-Glu), L-fenyloalanina (L-Phe), L-tyrozyna (L-Tyr), teofilina i wszystkie inne użyte chemikalia zostały zakupione od Sigma-Aldrich, Co., Ltd. (St. Louis, MO, Stany Zjednoczone). Hydrobromek skopolaminy i monohydrat chlorowodorku donepezilu zostały zakupione od TCI (Shanghai) Development, Co., Ltd. (Szanghaj, Chiny). (Szanghaj, Chiny). Sól sodową karboksymetylocelulozy (CMC-Na) i NaCl otrzymano z firmy Meilunbio® Biotech, Co., Ltd. (Dalian, Chiny). (Dalian, Chiny). Złożony barwnik ditlenek tytanu zakupiono od Shanghai Dyestuffs Research Institute, Co., Ltd. (Szanghaj, Chiny). (Szanghaj, Chiny). Zestaw do ilościowego oznaczania białek BCA, bufor do lizy RIPA, surowicza albumina bydlęca (BSA), PBST (10X), 30% amid akrylowy, 10% SDS, glicyna, bufor do ładowania próbek (4X) i TEMED zostały zakupione od YEASEN Biotechnology, Co., Ltd. (Szanghaj, Chiny). (Szanghaj, Chiny). Inhibitor fosfolipazy i inhibitor proteazy zostały zakupione od Roche Applied Science (Foster City, CA, Stany Zjednoczone). Membrana PVDF i substrat ImmobilonTM Western chemiluminescencyjny HRP zostały zakupione od Millipore (Billerica, MA, Stany Zjednoczone). Rabbit anti-AChE, rabbit anti-choline acetyltransferase (ChAT), rabbit anti-MPO i anti-glyceraldehyde 3-phosphate dehydrogenase (GAPDH), HRP-conjugated anti-rabbit IgG antibodies, and marker were purchased from Abcam Technology (Cambridge, MA, United States). Acetonitryl, metanol i kwas mrówkowy klasy HPLC zostały zakupione od Fisher Scientific, Co. (Santa Clara, CA, Stany Zjednoczone). Woda dejonizowana (>18 mΩ) została oczyszczona przez Milli-Q Academic System (Millipore, Corp., Billerica, MA, Stany Zjednoczone). Wszystkie inne substancje chemiczne były klasy analitycznej.
Zwierzęta
Sto osiem samców myszy C57BL/6 (w wieku 10 tygodni) otrzymano z Drug Safety Evaluation and Research Center of Shanghai University of Traditional Chinese Medicine. Myszy hodowano w dobrze oświetlonym, klimatyzowanym pomieszczeniu (25 ± 1°C) w standardowych warunkach środowiskowych (wilgotność względna: 60-65%, 12-godzinne cykle światło-ciemność: światło włączone od 7:00 do 19:00) i miały swobodny dostęp do karmy dla gryzoni i wody z kranu. Wszystkie procedury z wykorzystaniem zwierząt były zgodne z przepisami dotyczącymi doświadczeń na zwierzętach wydanymi przez Państwowy Komitet Nauki i Technologii Chin w dniu 14 listopada 1988 r. i zatwierdzonymi przez Komisję Etyki Zwierząt Doświadczalnych Uniwersytetu Tradycyjnej Medycyny Chińskiej w Szanghaju (nr. SUTCM-2011-1107; Data zatwierdzenia: 10 listopada, 2011).
Podawanie leków
W oparciu o różnicę w biodostępności HAL i HAR, dawki ustalono na 2, 5, i 10 mg/kg dla HAL, oraz 10, 20, i 30 mg/kg dla HAR (Zhang, 2013; Shi i in., 2014). Sto osiem myszy podzielono losowo na dziewięć grup (12 myszy w każdej grupie), a mianowicie grupę kontrolną (pojazd, 0,5% CMC-Na), grupę skopolaminy (1 mg/kg), grupę donepezilu (kontrola pozytywna, 5 mg/kg), grupy HAL (2, 5, i 10 mg/kg, czyli dawki niskie: L, średnie: M, i wysokie: H) oraz grupy HAR (10, 20, i 30 mg/kg, czyli dawki L, M, i H). Jak pokazano na rycinie 1, przed testem MWM, grupom kontrolnym i skopolaminowym podawano doustnie 0,5% roztwór CMC-Na, a grupom HAL (dawki L, M i H), HAR (dawki L, M i H) i donepezil (5 mg/kg) podawano przez siedem kolejnych dni. Od dnia 8 do dnia 16 skopolaminę (1 mg/kg) wstrzykiwano dootrzewnowo (i.p.) wszystkim grupom z wyjątkiem grupy kontrolnej, która otrzymywała normalny roztwór soli 30 min po różnych zabiegach. Następnie codziennie wykonywano testy behawioralne 30 min po wstrzyknięciu i.p. skopolaminy lub normalnej soli fizjologicznej.
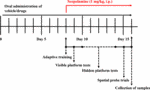
FIGURE 1. Rozkład czasowy projektów eksperymentalnych i leczenia myszy.
Behavioral Assessment in Morris Water Maze
Test MWM zastosowano do oceny wpływu HAL i HAR na uczenie się i pamięć przestrzenną myszy, jak wcześniej opisał Richard Morris w 1982 r. z niewielkimi modyfikacjami (Morris i in., 1982; He et al., 2015a; Singh et al., 2016).
Sprzęt MWM składał się z białego okrągłego zbiornika z wodą (średnica: 120 cm i wysokość: 50 cm) otoczonego różnymi wskazówkami wizualnymi (gwiazda, kwadrat, prostokąt i koło, itp.) na filarach w stałych pozycjach podczas całego eksperymentu. Zbiornik wybielono przez dodanie nietoksycznego barwnika, dwutlenku tytanu, w temperaturze 22 ± 2°C, tak że platforma była niewidoczna pod powierzchnią wody. Zbiornik został wirtualnie podzielony na cztery równe kwadranty, w tym południowo-wschodni, północno-wschodni, południowo-zachodni i północno-zachodni. Biała platforma (średnica: 10 cm i wysokość: 25 cm) została wyśrodkowana w kwadrancie południowo-zachodnim (Jeon i in., 2017; Kouémou i in., 2017; Lu i in., 2018). Cała procedura eksperymentalna składała się z treningu adaptacyjnego (1 dzień, raz dziennie), testu widocznej platformy (1 dzień, cztery próby dziennie), testów ukrytej platformy (5 dni, cztery próby dziennie) i próby sondy przestrzennej (24 h po ostatnim teście ukrytej platformy, raz dziennie).
Dla treningu adaptacyjnego (1 dzień, raz dziennie), pierwszego dnia testu MWM (dzień 8 leczenia lekami), każda mysz została umieszczona wewnątrz zbiornika wodnego, aby pływać przez 60 s, aby otrzymać sesję aklimatyzacyjną. Następnego dnia (dzień 9 leczenia farmakologicznego), w celu zbadania wzrokowych, czuciowych i motorycznych zdolności myszy, widoczna platforma została umieszczona 1 cm nad powierzchnią wody, a każda mysz mogła znaleźć platformę w ciągu 60 s. Test (1 dzień, cztery próby dziennie) został przeprowadzony przed próbą z ukrytą platformą, aby przesiać zakwalifikowane myszy. Następnie platformę zanurzano 1 cm poniżej powierzchni wody w testach z ukrytą platformą (5 dni, cztery próby dziennie, dni 10-14 leczenia farmakologicznego). Aktywność pływacka była rejestrowana przez kamerę wideo umieszczoną nad głową i analizowana przez komputerowy system śledzenia i analizy obrazu (RD1101-MWM-G, Shanghai Mobile Datum Information Technology Company, Shanghai, China). Myszy wypuszczano do zbiornika z głową zwróconą w kierunku ściany zbiornika kolejno z jednego z czterech kwadrantów (północno-wschodniego, północnego, wschodniego i południowo-wschodniego) i pozwalano im odnaleźć platformę w ciągu 60 s. Jeśli mysz nie zlokalizowała platformy, powinna być delikatnie naprowadzana przez określonego eksperymentatora i pozwalano jej pozostać na platformie przez 15 s. Po każdej próbie, każdą mysz zabierano do klatki i pozwalano jej wyschnąć pod grzejnikiem. Dla każdej próby rejestrowano opóźnienie ucieczki i szybkość ucieczki. W próbie sondy przestrzennej (15 dzień leczenia farmakologicznego), platforma była usuwana ze zbiornika. Każda mysz została umieszczona w zbiorniku wodnym z kwadrantu (dla natychmiastowego, północno-zachodniego) przeciwnego do poprzedniej lokalizacji platformy (kwadrant docelowy), aby otrzymać 60 s test retencji pamięci (Lee i in., 2016; Liu i in., 2017; Malik i in., 2017). Czas w kwadrancie docelowym i numer przejścia zostały zarejestrowane.
Zbieranie tkanek mózgowych
W 16 dniu po leczeniu lekami wszystkie myszy zostały znieczulone i osocze zostało zebrane przez oftalmectomię, a następnie tkanki mózgowe zostały zebrane po dekapitacji. W każdej grupie, mózgi z podzestawu zwierząt były używane do analizy immunofluorescencji i innych do analizy biochemicznej i western blotting. Po uśmierceniu, tkanki mózgowe były natychmiast wycinane, płukane normalnym roztworem soli fizjologicznej, bibułą filtracyjną usuwano wilgoć z powierzchni i ważono. Kora i hipokamp każdego mózgu zostały podzielone na dwie części (lewą i prawą), odpowiednio, na lodzie. Niektóre z nich zostały utrwalone 4% paraformaldehydem do analizy immunofluorescencyjnej, a pozostałe zostały natychmiast zamrożone ciekłym azotem, a następnie przechowywane w temperaturze -80°C do czasu analizy.
Biochemical Assay
Korę i hipokamp homogenizowano w lodowato zimnym 0.1 M buforze fosforanowym (pH 7,4), a 10% (w/v) homogenaty odwirowano w 4°C przy 12 000 obr/min przez 10 min, a supernatanty oddzielono, a następnie przechowywano w -80°C do oceny biochemicznej (Malik i in., 2017). Poziomy AChE, ChAT, dysmutazy ponadtlenkowej (SOD), peroksydazy glutationowej (GSH-px), diadehydu maleinowego (MDA), MPO, czynnika martwicy nowotworów α (TNF-α), interleukiny 1β (IL-1β), interleukiny 6 (IL-6), interleukiny 10 (IL-10), i tlenku azotu (NO) w homogenatach kory mózgowej i/lub hipokampa oznaczono metodą ELISA przy użyciu dostępnych w handlu zestawów testowych (Jiancheng, Nanjing, Chiny) zgodnie z protokołami producenta. W szczególności, poziomy powyższych czynników biochemicznych w korze mózgowej i hipokampie były normalizowane przy użyciu stężenia białka każdej próbki. Oznaczenia wykonywano w dwóch egzemplarzach.
Western Blotting Analysis
Korę mózgową i hipokamp homogenizowano w lodowato zimnym 50 mM buforze Tris-HCl (pH 7,4) zawierającym inhibitor fosfatazy i inhibitor proteazy. Po odwirowaniu (12 000 obr./min.) przez 10 min w temp. 4°C, oznaczano całkowitą zawartość białka za pomocą zestawu do oznaczania białka BCA. Próbki białek mieszano z ¼ objętości buforu obciążającego, a następnie ogrzewano przez 5 min w temp. 100°C. 20 μg białka z każdej próbki poddawano elektroforezie w 8% SDS-PAGE i przenoszono na membrany PVDF. Następnie membrany blokowano przez 1 h w 5% mleku beztłuszczowym w temperaturze pokojowej i inkubowano z anty-GAPDH (1:5000), anty-AChE (1:1000), anty-ChAT (1:1000) i anty-MPO (1:1000) w temperaturze 4°C przez noc. Następnie membrany były dokładnie płukane PBST, a następnie inkubowane z przeciwciałem drugorzędowym anty-rabbit (1:5000) sprzężonym z HRP przez 2 h w temperaturze pokojowej. Po całkowitym przemyciu PBST pasma białkowe wizualizowano za pomocą zestawu ECL prime kit.
Analiza immunofluorescencyjna
Wydzielanie mieloperoksydazy wizualizowano za pomocą mikroskopii immunofluorescencyjnej, jak opisano wcześniej z niewielkimi zmianami (Gray i in., 2008). Po utrwaleniu w 4% paraformaldehydzie, kory były cięte na sekcje strzałkowe o grubości 5 μm, były deparafinowane i przetwarzane do analizy immunofluorescencyjnej. Sekcje mózgu umieszczano w roztworze kwasu cytrynowego (pH 6,0) w celu naprawy antygenu w kuchence mikrofalowej. Następnie przez 5 min prowadzono wygaszanie autofluorescencji. Po zablokowaniu w 2% BSA, sekcje były sondowane anty-MPO (1:100) przez noc w 4°C. Następnie sekcje przemywano trzykrotnie PBS (pH 7,4) i inkubowano z przeciwciałem drugorzędowym anty-rabbit (1:300) sprzężonym z HRP przez 30 min w temperaturze pokojowej. Następnie zastosowano 4′,6-diamidino-2-fenyloindol (DAPI) do przeciwbarwienia DNA i sekcje mózgu obserwowano pod mikroskopem fluorescencyjnym (Nikon ECLIPSE C1, Japonia), a obrazy zostały odpowiednio uchwycone. Tutaj, fluorescencja DAPI lub MPO była mierzona przy długości fali wzbudzenia 330-380 lub 510-560 nm i długości fali emisji 420 lub 590 nm, odpowiednio.
Wpływ HAL i HAR na neuroprzekaźniki
Procedura ekstrakcji
Szybka, niezawodna i wygodna metoda wytrącania została zastosowana do przygotowania homogenatów kory mózgowej i próbek osocza. Do 100 μL próbki dodawano 200 μL lodowatego acetonitrylu zawierającego 60 ng/mL IS w 1,5 mL probówce wirówkowej i mieszano vorteksem przez 1 min. Następnie mieszaninę odwirowano przy 12 000 obr/min przez 10 min (4°C). Podwielokrotność 5 μL supernatantu z każdej próbki wstrzykiwano do ultra wydajnej chromatografii cieczowej połączonej z kwadrupolową spektrometrią mas z jonizacją elektrospray (ESI) (UPLC-ESI-MS/MS) do analizy ilościowej.
Analiza UPLC-ESI-MS/MS
Stężenia różnych neuroprzekaźników były jednocześnie oznaczane ilościowo za pomocą systemu SHIMADZU LC-30AD UPLC (Shimadzu, Kyoto, Japonia) połączonego z potrójnym kwadrupolowym spektrometrem mas AB Sciex QTRAP® 6500 (SCIEX, Stany Zjednoczone) wyposażonym w źródło ESI wykorzystujące tryb detekcji jonów dodatnich do monitorowania reakcji wielokrotnych. Rozdział chromatograficzny przeprowadzono przy użyciu kolumny ZIC-cHILIC (150 mm × 2,1 mm, 3 μm, Merck-Sequant, Niemcy) z kolumną ochronną SeQuant ZIC-cHILIC (20 mm × 2,1 mm, 5 μm, Merck-Sequant, Niemcy). Faza ruchoma, acetonitryl-woda (65:35, v/v) zawierająca 0,1% kwasu mrówkowego, była dostarczana z szybkością przepływu 0,2 mL/min. W celu ochrony spektrometru mas przed zanieczyszczeniami, przepływ był kierowany do odpadów w ciągu pierwszej minuty po wstrzyknięciu. Wszystkie pozostałe parametry instrumentalne zostały ustawione zgodnie z naszymi wcześniejszymi badaniami (Jiang, 2016). Metoda UPLC-ESI-MS/MS została dobrze zwalidowana i z powodzeniem zastosowana do oznaczania stężeń neuroprzekaźników w homogenatach kory mózgowej i osoczu (Jiang, 2016).
Analiza statystyczna
Ocena statystyczna została przeprowadzona za pomocą oprogramowania SPSS w wersji 18.0, a dane wyrażono jako średnie ± SD. Przedstawione dane dotyczące latencji ucieczki i długości drogi w teście MWM analizowano metodą dwuczynnikowej ANOVA. Pozostałe dane behawioralne oraz zmiany biomarkerów in vitro testowano metodą jednoczynnikowej ANOVA dla wielokrotnych porównań. Istotne wyniki oznaczono zgodnie z konwencjonalnymi krytycznymi wartościami P: #P < 0,05; ##P < 0,01; ###P < 0,001, vs. grupa kontrolna. ∗P < 0,05; ∗∗P < 0,01; ∗∗∗P < 0,001, vs. grupa indukowana skopolaminą.
Wyniki
HAL i HAR Attenuated Cognitive Dysfunction of Scopolamine-Treated Mice in MWM
Aby określić wpływ HAL (dawki L, M i H) i HAR (dawki L, M i H) na uczenie się i pamięć przestrzenną, przeprowadzono zadanie MWM u myszy z upośledzeniem pamięci wywołanym skopolaminą. Dwukierunkowa analiza powtarzanych środków z modelem mieszanym wykazała, że opóźnienie dotarcia do platformy było znacząco różne między grupami eksperymentalnymi myszy (F(8,396) = 26,011, P < 0,001) i dniami szkolenia akwizycyjnego (F(4,396) = 15,274, P < 0,001). Nie było znaczącej interakcji między grupami i dniami (F(32,396) = 1,132, P > 0,05), co sugeruje, że różnice między grupami były zależne od leczenia. Jak przedstawiono na rycinie 2, w teście ukrytej platformy, latencja ucieczki i długość ścieżki w grupie indukowanej skopolaminą były istotnie dłuższe niż w grupie kontrolnej na czwartym (Figura 2A, F(8,99) = 3,135, P < 0.01; Figura 2B, F(8,99) = 4,074, P < 0,01) i piątego dnia (Figura 2A, F(8,99) = 4,164, P < 0,01; Figura 2B, F(8,99) = 4,548, P < 0,01), wskazując na pomyślnie skonstruowany mysi model upośledzenia pamięci. Jednak deficyty poznawcze wywołane skopolaminą zostały odwrócone zarówno przez HAL, jak i HAR. W porównaniu z grupą indukowaną skopolaminą, latencja ucieczki i długość ścieżki zostały skutecznie zmniejszone w grupach leczonych HAL (dawki L, M i H) i HAR (dawki M i H) na czwartym (Figura 2A, F(8,99) = 4,975, P < 0,01; F(8,99) = 2.816, P < 0,05; F(8,99) = 2,795, P < 0,05; Figura 2B, F(8,99) = 3,836, P < 0,01; F(8,99) = 3.231, P < 0,01; F(8,99) = 2,658, P < 0,05; Rycina 2C, F(8,99) = 4,673, P < 0,01; F(8,99) = 4,881, P < 0.01; Rysunek 2D, F(8,99) = 3,817, P < 0,01; F(8,99) = 3,129, P < 0,01) i piątego dnia (Rysunek 2A, F(8,99) = 12,637, P < 0,001; F(8,99) = 2,802, P < 0,05; F(8,99) = 2,772, P < 0,05; Rysunek 2B, F(8,99) = 4.014, P < 0,01; F(8,99) = 2,722, P < 0,05; F(8,99) = 2,531, P < 0,05; Rycina 2C, F(8,99) = 4,574, P < 0.01; F(8,99) = 4,632, P < 0,01; Figura 2D, F(8,99) = 2,547, P < 0,05; F(8,99) = 3,905, P < 0,01). Jakkolwiek, gdy traktowane z niską dawką HAR w 10 mg/kg (grupa dawki L), nie ma istotnego zmniejszenia latencji ucieczki i długości ścieżki przez cały okres szkolenia na czwartym (rysunek 2C, F(8,99) = 1.182, P > 0,05; Figura 2D, F(8,99) = 0,494, P > 0,05) i piątego dnia (Figura 2C, F(8,99) = 0,873, P > 0,05; Figura 2D, F(8,99) = 0,201, P > 0,05). Można również zauważyć z Figury 2, latencja ucieczki i długość ścieżki grupy leczonej donepezilem (5 mg/kg) były znacznie skrócone w porównaniu z tymi z grupy indukowanej skopolaminą na czwartym (Figura 2A, F(8,99) = 2,668, P < 0.05; Rycina 2B, F(8,99) = 2,643, P < 0,05) i piątego dnia (Rycina 2A, F(8,99) = 2,780, P < 0,05; Rycina 2B, F(8,99) = 2,897, P < 0,05) podczas treningowej sesji próbnej trzeciej.
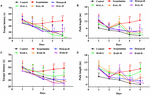
RYSUNEK 2. Wpływ HAL (2, 5, i 10 mg/kg, czyli dawki niskie: L, średnie: M, i wysokie: H) i HAR (10, 20, i 30 mg/kg, czyli dawki L, M, i H) na wywołane skopolaminą upośledzenie pamięci u myszy. HAL (w dawkach L, M i H), HAR (w dawkach L, M i H) oraz donepezil (5 mg/kg) podawano przez zgłębnik przez 7 dni przed treningiem do testów w labiryncie wodnym Morrisa (MWM) i kontynuowano w trakcie testów. Upośledzenie pamięci indukowano skopolaminą (1 mg/kg, i.p.). Latencja ucieczki (A) i długość drogi (B) grup leczonych HAL (dawki L, M i H) w testach z ukrytą platformą przez pięć kolejnych dni, oraz latencja ucieczki (C) i długość drogi (D) grup leczonych HAR (dawki L, M i H) w testach z ukrytą platformą przez pięć kolejnych dni. Pasek błędu (SD) dla punktów danych na tym rysunku nie został podany w celu wyraźnego rozróżnienia różnic między sposobami leczenia. N = 12/grupa. ##P < 0,01, vs. grupa kontrolna. ∗P < 0,05; ∗∗P < 0,01; ∗∗∗P < 0,001, vs. grupa indukowana skopolaminą.
W dniu po testach z ukrytą platformą przeprowadzono próbę sondy przestrzennej, zabierając platformę, aby ocenić pamięć przestrzenną wszystkich myszy. Jak pokazano na rycinie 3, częstotliwość przechodzenia była znacznie zmniejszona w grupie wywołanej skopolaminą (F(8,81) = 5,498, P < 0,05), ilustrując, że 1 mg/kg skopolaminy uszkodził formowanie się pamięci przestrzennej u myszy. W szczególności, oprócz grupy leczenia HAR (dawka L) (F(8,81) = 0,494, P > 0,05), pozostałe grupy leczenia HAL (dawki L, M i H) i HAR (dawki M i H) dramatycznie podniosły częstotliwość przechodzenia (F(8,81) = 11,667, P < 0.01; F(8,81) = 9,072, P < 0,01; F(8,81) = 4,507, P < 0,05; F(8,81) = 7,063, P < 0,05; F(8,81) = 8,583, P < 0,01, odpowiednio), a wzrost grupy dawki HAL-L był bardziej zauważalny w porównaniu z innymi grupami (Figura 3). Poza tym, grupa leczona donepezilem (5 mg/kg) również znacząco zwiększyła częstotliwość przechodzenia w porównaniu z myszami indukowanymi skopolaminą (Figura 3, F(8,81) = 5,345, P < 0,05). Wszystkie te wyniki sugerowały, że HAL (dawki L, M i H) i HAR (dawki M i H) mogą poprawić zdolność pamięci przestrzennej myszy z zaburzeniami funkcji poznawczych wywołanymi skopolaminą, a HAL wykazywał silniejszy wpływ niż HAR na uczenie się i pamięć przestrzenną w MWM.
RYSUNEK 3. Wpływ HAL (2, 5, i 10 mg/kg, czyli dawki niskie: L, średnie: M, i wysokie: H) i HAR (10, 20, i 30 mg/kg, czyli dawki L, M, i H) na wywołane skopolaminą upośledzenie pamięci u myszy. Częstotliwość przechodzenia myszy przez lokalizację platformy (A) i tory pływania myszy w zbiorniku wodnym (B). Zielone kółko wskazuje lokalizację ukrytej platformy, a czerwone krzywe przedstawiają tory ruchu myszy. N = 10/grupa. #P < 0,05, vs. grupa kontrolna. ∗P < 0,05; ∗∗P < 0,01; vs. grupa indukowana skopolaminą.
Effects of HAL and HAR on Scopolamine-Induced Cholinergic System, Oxidative Stress, and Inflammation
Aby dokładniej wyjaśnić potencjalne mechanizmy działania HAL i HAR w poprawie pamięci indukowanej skopolaminą, zbadano poziomy wielu różnych czynników biochemicznych i ekspresji białek związanych z układem cholinergicznym, stresem oksydacyjnym i stanem zapalnym. Na rycinach 4, 5 przedstawiono zmiany różnych czynników biochemicznych w korze mózgowej lub hipokampie, a na rycinach 6-8 wpływ HAL i HAR na ekspresję białek w korze mózgowej myszy.
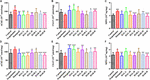
RYSUNEK 4. Wpływ HAL (2, 5, i 10 mg/kg, czyli niskie: L, średnie: M, i wysokie: H) i HAR (10, 20, i 30 mg/kg, czyli dawki L, M i H) na aktywność acetylocholinoesterazy (AChE), acetylotransferazy cholinowej (ChAT) i mieloperoksydazy (MPO) w korze mózgowej (A-C) i hipokampie (D-F) myszy z zaburzeniami poznawczymi wywołanymi przez skopolaminę, odpowiednio. Dane zostały wyrażone jako średnia ± SD (n = 10). #P < 0,05; ##P < 0,01; ###P < 0,001, vs. grupa kontrolna. ∗P < 0,05; ∗∗P < 0,01; ∗∗∗P < 0,001, vs. grupa indukowana skopolaminą.
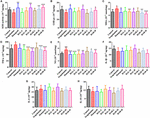
RYSUNEK 5. Wpływ HAL (2, 5, i 10 mg/kg, czyli dawki niskie: L, średnie: M, i wysokie: H dawki) i HAR (10, 20, i 30 mg/kg, czyli L, M, i H dawki) na aktywność lub produkcję dysmutazy ponadtlenkowej (SOD) (A), peroksydazy glutationowej (GSH-px) (B), diadehyd maleinowy (MDA) (C), czynnik martwicy nowotworów α (TNF-α) (D) i tlenek azotu (NO) (E) w korze mózgowej myszy z zaburzeniami funkcji poznawczych wywołanymi przez skopolaminę. Dane zostały wyrażone jako średnia ± SD (n = 10). #P < 0,05; ##P < 0,01; ###P < 0,001, vs. grupa kontrolna. Interleukina 1β (IL-1β) (F), interleukina 6 (IL-6) (G) i interleukina 10 (IL-10) (H). ∗P < 0,05; ∗∗P < 0,01; ∗∗∗P < 0,001, vs. grupa indukowana skopolaminą.
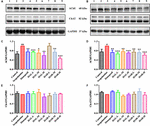
RYSUNEK 6. Wpływ HAL (2, 5, i 10 mg/kg, czyli dawki niskie: L, średnie: M, i wysokie: H) i HAR (10, 20, i 30 mg/kg, czyli dawki L, M, i H) na poziom ekspresji białka acetylocholinoesterazy (AChE), i acetylotransferazy choliny (ChAT) w korze mózgowej (A,C,E) i hipokampie (B,D,F) myszy z zaburzeniami poznawczymi wywołanymi skopolaminą. Dane zostały wyrażone jako średnia ± SD (n = 3). #P < 0,05; ##P < 0,01, vs. grupa kontrolna. ∗P < 0,05; ∗∗P < 0,01; ∗∗∗P < 0,001, vs. grupa indukowana skopolaminą.

RYSUNEK 7. Wpływ HAL (2, 5, i 10 mg/kg, czyli dawki niskie: L, średnie: M, i wysokie: H) i HAR (10, 20, i 30 mg/kg, czyli dawki L, M, i H) na poziom ekspresji białka mieloperoksydazy (MPO) w korze mózgowej (A,C) i hipokampie (B,D) myszy z upośledzeniem funkcji poznawczych wywołanym przez skopolaminę. Dane zostały wyrażone jako średnia ± SD (n = 3). #P < 0,05; ##P < 0,01, vs. grupa kontrolna. ∗P < 0,05; ∗∗P < 0,01; ∗∗∗P < 0,001, vs. grupa indukowana skopolaminą.

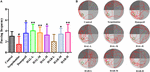
RYSUNEK 8. Wpływ HAL (2, 5, i 10 mg/kg, czyli dawki niskie: L, średnie: M, i wysokie: H) i HAR (10, 20, i 30 mg/kg, czyli dawki L, M, i H) na wytwarzanie mieloperoksydazy (MPO) w korze mózgowej myszy z upośledzeniem funkcji poznawczych wywołanym skopolaminą, wizualizowane za pomocą mikroskopii immunofluorescencyjnej.
Effects of HAL and HAR on Cholinergic Deficits
Aby wyjaśnić wpływ HAL i HAR na mózgową funkcję cholinergiczną, oceniono zmiany w aktywności i poziomie białka AChE i ChAT w tkankach korowych i hipokampalnych wszystkich myszy. Jak pokazano na ryc. 4A,D, leczenie skopolaminą w dawce 1 mg/kg istotnie zwiększyło aktywność AChE w korze i hipokampie (F(8,81) = 10,553, P < 0,01; F(8,81) = 6,177, P < 0,05). Z wyjątkiem grupy dawki HAR-L w korze mózgowej, pozostałe grupy leczenia HAL (dawki L, M i H) i HAR (dawki M i H) znacznie zmniejszyły aktywność AChE (Figura 4A, F(8,81) = 10,837, P < 0,01; F(8,81) = 8,621, P < 0,05; F(8,81) = 15,177, P < 0.01; F(8,81) = 8,615, P < 0,05; F(8,81) = 16,330, P < 0,001; Rycina 4D, F(8,81) = 46,593, P < 0,001; F(8,81) = 34,179, P < 0.001; F(8,81) = 7,968, P < 0,05; F(8,81) = 4,769, P < 0,05; F(8,81) = 49,802, P < 0,001; F(8,81) = 46,665, P < 0,001). Podobnie, grupa leczona donepezilem ewidentnie zmniejszyła aktywność AChE w porównaniu z poziomami w grupie indukowanej skopolaminą (Figura 4A, F(8,81) = 13,138, P < 0,01; Figura 4D, F(8,81) = 7,400, P < 0,05). Dodatkowo, grupa indukowana skopolaminą wykazywała znaczący spadek aktywności ChAT zarówno w korze, jak i hipokampie (Figura 4B, F(8,81) = 5,481, P < 0,05; Figura 4E, F(8,81) = 4,874, P < 0,05). Niemniej jednak, podawanie HAL (dawki L i M) i HAR (dawki M i H) znacznie zwiększyło aktywność ChAT w korze mózgowej (Figura 4B, F(8,81) = 7,956, P < 0,05; F(8,81) = 8,390, P < 0,05; F(8,81) = 7.835, P < 0,05; F(8,81) = 51,927, P < 0,001), a poziomy ChAT we wszystkich grupach leczenia HAL i HAR w hipokampie były znacznie wyższe niż w grupie indukowanej skopolaminą (Figura 4E, F(8,81) = 18.139, P < 0,001; F(8,81) = 9,665, P < 0,01; F(8,81) = 14,113, P < 0,01; F(8,81) = 5,178, P < 0,05; F(8,81) = 7,599, P < 0.05; F(8,81) = 11,953, P < 0,01), a wpływ grupy dawkowania HAL-L na aktywność ChAT był bardziej znaczący w porównaniu z grupami podawania HAR.
Jak przedstawiono na Figurze 6, w porównaniu z grupą kontrolną, poziomy ekspresji białka AChE w korze mózgowej i hipokampie grupy indukowanej skopolaminą były wyraźnie zwiększone (Figura 6C, F(8,18) = 36,632, P < 0,01; Figura 6D, F(8,18) = 14,823, P < 0,05), podczas gdy poziomy białka ChAT były prawie niezmienione (Figury 6E,F). Po leczeniu za pomocą HAL (dawki L, M i H), HAR (dawki M i H) i donepezilu, z wyjątkiem HAR (dawka L), poziomy białka AChE w korze były znacznie zmniejszone w porównaniu z grupą indukowaną skopolaminą (Figura 6C, F(8,18) = 50.590, P < 0,001; F(8,18) = 16,950, P < 0,05; F(8,18) = 30,993, P < 0,01; F(8,18) = 23,821, P < 0.01; F(8,18) = 52,196, P < 0,001; F(8,18) = 29,284, P < 0,01), podczas gdy poziomy ChAT nie były zmienione (Figura 6E). I podobny wpływ na poziomy AChE i ChAT zaobserwowano z podawaniem HAL i HAR (dawki L, M i H) w hipokampie (Figura 6D, F(8,18) = 41,195, P < 0.001; F(8,18) = 28,111, P < 0,01; F(8,18) = 47,611, P < 0,001; F(8,18) = 30,539, P < 0,01; F(8,18) = 33,225, P < 0,01; F(8,18) = 40,032, P < 0,001; Figura 6F). Ponadto, hamujący wpływ HAR na ekspresję białka AChE był zależny od dawki, podczas gdy HAL miał zauważalny efekt hamujący w niskiej dawce 2 mg/kg (Figura 6). Tak więc, leczenie HAL i HAR zapobiegało wywołanemu przez skopolaminę zwiększeniu aktywności AChE i ekspresji białka oraz zmniejszeniu aktywności ChAT, co wykazało, że HAL i HAR mogą wzmocnić funkcję układu cholinergicznego i złagodzić dysfunkcję behawioralną. W szczególności, HAL manifestował znaczącą poprawę pod niską dawką.
Effects of HAL and HAR on Oxidative Stress Markers
The effects of HAL and HAR on the activities of antioxidant enzymes SOD, GSH-px, and the level of MDA in the cortex were measured. Jak wykazała Figura 5, grupa indukowana skopolaminą wyraźnie osłabiła aktywność SOD i GSH-px w porównaniu z grupą kontrolną (Figura 5A, F(8,81) = 12,254, P < 0,01; Figura 5B, F(8,81) = 4,577, P < 0,05). Natomiast podawanie HAL (dawka H), HAR (dawki M i H) oraz donepezilu istotnie zwiększało aktywność SOD (Figura 5A, F(8,81) = 13,287, P < 0,01; F(8,81) = 13,424, P < 0,01; F(8,81) = 34,510, P < 0.001; F(8,81) = 8,670, P < 0,01), a leczenie HAL, HAR (obie dawki H) i donepezil wyraźnie podniosło aktywność GSH-px (Figura 5B, F(8,81) = 6,010, P < 0,05; F(8,81) = 6,008, P < 0,05; F(8,81) = 6,860, P < 0,05). Ponadto, przy leczeniu HAL, HAR (obie dawki M i H) i donepezilu (5 mg/kg), obserwowano znaczące tłumienie wzrostu poziomu MDA w porównaniu z myszami indukowanymi skopolaminą (Figura 5C, F(8,81) = 9.302, P < 0,01; F(8,81) = 6,565, P < 0,05; F(8,81) = 12,690, P < 0,01; F(8,81) = 33,627, P < 0,001; F(8,81) = 5,874, P < 0,05). Wyniki te sugerują, że HAL i HAR mogą zapobiegać uszkodzeniom oksydacyjnym wywołanym przez skopolaminę poprzez ochronę kory mózgowej przed stresem oksydacyjnym. Zauważalnie, uszkodzenie oksydacyjne mogło być poprawione tylko przy wysokich dawkach zarówno HAL jak i HAR, a poprawa HAL i HAR była ogólnie porównywalna.
Effects of HAL and HAR on Inflammation Levels
The effects of HAL and HAR on the activities of inflammatory factors MPO, TNF-α, IL-1β, IL-6, IL-10 and the level of NO in the cortex or hippocampus were analysed. Aktywności MPO (kora i hipokamp) i TNF-α (kora) były podwyższone u myszy z indukowaną skopolaminą w porównaniu z myszami kontrolnymi (Figura 4C, F(8,81) = 34.740, P < 0,001; Figura 4F, F(8,81) = 6,729, P < 0,05; Figura 5D, F(8,81) = 6,316, P < 0,05), ale poziomy IL-1β, IL-6 i IL-10 nie uległy zmianie (Figura 5F-H). Jednak podawanie HAL, HAR (obie dawki M i H) i donepezilu spowodowało znaczące zmniejszenie aktywności MPO w korze i hipokampie w sposób zależny od dawki (Figura 4C, F(8,81) = 10.435, P < 0,01; F(8,81) = 32,309, P < 0,001; F(8,81) = 16,397, P < 0,01; F(8,81) = 31,291, P < 0.001; F(8,81) = 7,129, P < 0,05; Rycina 4F, F(8,81) = 7,212, P < 0,05; F(8,81) = 10,533, P < 0.01; F(8,81) = 9,150, P < 0,01; F(8,81) = 18,903, P < 0,001; F(8,81) = 11,641, P < 0,01), a leczenie HAL (dawki L, M i H), HAR (dawki M i H) i donepezilem również osłabia aktywność TNF-α w korze (Figura 5D, F(8,81) = 10.377, P < 0,01; F(8,81) = 28,257, P < 0,001; F(8,81) = 31,088, P < 0,001; F(8,81) = 15,966, P < 0,001; F(8,81) = 23,530, P < 0,001; F(8,81) = 5,909, P < 0,05). Ponadto, oprócz grupy dawkowania HAR-L, zauważalne tłumienie wzrostu poziomu NO stwierdzono u pozostałych myszy HAL, HAR i myszy leczonych donepezilem w porównaniu z myszami z amnezją indukowaną skopolaminą (Figura 5E, F(8,81) = 21.319, P < 0,001; F(8,81) = 12,996, P < 0,01; F(8,81) = 11,911, P < 0,01; F(8,81) = 5,227, P < 0,05; F(8,81) = 8,799, P < 0.01; F(8,81) = 17,349, P < 0,001), a hamujący wpływ HAL na TNF-α i NO był wyraźniejszy niż HAR.
Jak pokazano na Figurze 7, w porównaniu z myszami kontrolnymi, poziomy ekspresji białka korowej i hipokampalnej MPO u myszy indukowanych skopolaminą były podwyższone (Figura 7C, F(8,18) = 29,975, P < 0,01; Figura 7D, F(8,18) = 32,014, P < 0,01). Po podaniu donepezilu, HAL i HAR (dawki L, M i H), ekspresja białka MPO wyraźnie spadła w korze i hipokampie w porównaniu z grupą indukowaną skopolaminą. Poza tym, wyniki oznaczeń immunofluorescencyjnych również ujawniły, że zabiegi HAL i HAR mogły uderzająco zmniejszyć ekspresję MPO w korze mózgowej w sposób zależny od dawki, a zahamowania HAL i HAR były porównywalne (rysunek 8). Wszystkie te ustalenia sugerują, że HAL i HAR mogą zmniejszyć wywołane skopolaminą uszkodzenie zapalne poprzez hamowanie kory mózgowej i hipokampa przed zapaleniem.
Modulator Effects of HAL and HAR on the Neurotransmitters of Scopolamine-Treated Mice
Różne neuroprzekaźniki plazmatyczne i korowe zostały ocenione przy użyciu UPLC-ESI-MS/MS, a zmiany są przedstawione odpowiednio na Ryc. 9, 10. W oparciu o ustaloną wcześniej metodę oznaczania neuroprzekaźników, zawartość ACh, Ch, L-Trp, 5-HT, L-Glu, L-Phe, L-Tyr w osoczu oraz ACh, Ch, L-Trp, γ-GABA, L-Glu, L-Phe, L-Tyr w korze przekraczała dolną granicę oznaczalności, a następnie wszystkie z nich zostały z powodzeniem oznaczone ilościowo.
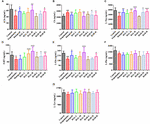
RYSUNEK 9. Wpływ HAL (2, 5, i 10 mg/kg, czyli dawki niskie: L, średnie: M, i wysokie: H) oraz HAR (10, 20, i 30 mg/kg, czyli dawki L, M, i H) na zawartość neuroprzekaźników w osoczu myszy z upośledzeniem funkcji poznawczych wywołanym skopolaminą. N = 10/grupa. ACh (A), Ch (B), L-Trp (C), 5-HT (D), L-Glu (E), L-Phe (F), L-Tyr (G). #P < 0,05; ##P < 0,01; ###P < 0,001, vs. grupa kontrolna. ∗P < 0,05; ∗∗P < 0,01; ∗∗∗P < 0,001, vs. grupa indukowana skopolaminą.
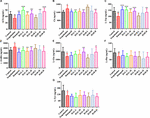
RYSUNEK 10. Wpływ HAL (2, 5, i 10 mg/kg, czyli dawki niskie: L, średnie: M, i wysokie: H) oraz HAR (10, 20, i 30 mg/kg, czyli dawki L, M, i H) na zawartość neuroprzekaźników w korze mózgowej myszy z zaburzeniami poznawczymi wywołanymi skopolaminą. N = 10/grupa. ACh (A), Ch (B), L-Trp (C), γ-GABA (D), L-Glu (E), L-Phe (F), L-Tyr (G). #P < 0,05; ##P < 0,01, vs. grupa kontrolna. ∗P < 0,05; ∗∗P < 0,01; ∗∗∗P < 0,001, vs. grupa indukowana skopolaminą.
Po indukcji skopolaminą w dawce 1 mg/kg, stężenia ACh, L-Trp, 5-HT, L-Glu i L-Phe były zmniejszone w osoczu (Figura 9A, F(8,81) = 11.453, P < 0,01; Figura 9C, F(8,81) = 23,137, P < 0,001; Figura 9D, F(8,81) = 7,359, P < 0,05; Figura 9E, F(8,81) = 55.531, P < 0,001; Figura 9F, F(8,81) = 6,330, P < 0,05), podczas gdy bez wpływu na L-Tyr (Figura 9G, F(8,81) = 2,091, P > 0,05). Jednakże, gdy leczenie HAL i HAR w wysokiej dawce, zawartość ACh i L-Glu były podwyższone (Figura 9A,E), a zawartość L-Trp były wyraźnie podniesione z HAL (L, M, i H dawki) i HAR (M i H dawki) administracji w sposób zależny od dawki (Figura 9C). Co więcej, myszy leczone HAL i HAR (dawki M i H) wykazywały znaczne podwyższenie poziomu 5-HT w porównaniu z myszami indukowanymi skopolaminą (Figura 9D). Jednak podawanie HAL i HAR nie modulowało zawartości L-Phe i L-Tyr (Ryc. 9F,G). Poza tym, HAL (dawka H), jak również HAR (dawki M i H) miały wpływ na zmniejszenie zawartości Ch w osoczu (rysunek 9B).
Ponadto, rysunek 10 pokazuje zmiany neuroprzekaźników w korze mózgowej. Po wywołaniu skopolaminy zawartość ACh, L-Trp, L-Glu, L-Phe i L-Tyr była oczywiście zmniejszona (Figura 10A, F(8,81) = 11,296, P < 0,01; Figura 10C, F(8,81) = 10,979, P < 0,01; Figura 10E, F(8,81) = 7,216, P < 0,05; Figura 10F, F(8,81) = 10.340, P < 0,01; Figura 10G, F(8,81) = 6,834, P < 0,05), podczas gdy zawartość Ch i γ-GABA była istotnie podwyższona w korze w porównaniu z grupą kontrolną (Figura 10B, F(8,81) = 7,377, P < 0,05; Figura 10D, F(8,81) = 5,580, P < 0,05). Niemniej jednak, zawartość ACh była obserwacyjnie podwyższona w grupach HAL (L, M, i H dawki) i HAR (M i H dawki), a zawartość L-Trp była wyraźnie podwyższona w grupach HAL (L, M, i H dawki) i HAR (H dawki), a ilości L-Glu były również podwyższone w wysokich dawkach grup HAL i HAR (Figury 10A,C,E). Ponadto, leczenie HAL (dawki L, M i H) i HAR (dawka H) spowodowało wyraźne obniżenie poziomu Ch i γ-GABA w porównaniu z grupą indukowaną skopolaminą (ryc. 10B, D). Jednakże różne dawki HAL i HAR wykazywały nieistotny wpływ na obniżenie poziomu L-Phe i L-Tyr indukowane skopolaminą (Ryc. 10F,G). Generalnie, wpływ HAL na ważne neuroprzekaźniki plazmatyczne i korowe był bardziej widoczny niż wpływ HAR (ryc. 9, 10).
Dyskusja
Choroba Alzheimera jest śmiertelnym, postępującym zaburzeniem neurodegeneracyjnym, z rosnącą liczbą starzejącej się populacji i długością życia, i pilne jest znalezienie nowych leków, które mogą skutecznie leczyć AD (Kouémou et al., 2017). Ogólnie wiadomo, że hipofunkcja cholinergiczna, stres oksydacyjny i neurozapalenie są jedną z głównych cech AD (Abd-El-Fattah i in., 2014; Demirci i in., 2017). Skopolamina jest nieselektywnym antagonistą muskarynowego receptora cholinergicznego (Jang i wsp., 2013; Kaur i wsp., 2017). Liczne badania wykazały, że skopolamina może upośledzać zdolność uczenia się i pamięci u ludzi i w modelach zwierzęcych, a model AD indukowany skopolaminą jest szeroko stosowany do badania deficytów poznawczych i badań przesiewowych leków anty-AD (Goverdhan i in., 2012). Skopolamina prowadzi do deficytów poznawczych związanych ze zmniejszeniem neurotransmisji cholinergicznej, zwiększonym stresem oksydacyjnym, jak również podwyższonym stanem zapalnym w mózgu (Lin i Beal, 2006). W związku z tym leki mogą skutecznie wzmocnić funkcję cholinergiczną i/lub złagodzić stres oksydacyjny i stan zapalny, a także mogą odwrócić zaburzenia uczenia się i pamięci u myszy z AD indukowaną skopolaminą, a ostatecznie będą cenne w leczeniu AD.
Poprzednio He i wsp. (2015a) udowodnili, że HAR może hamować aktywność AChE i znacznie poprawił uczenie się i pamięć przestrzenną myszy z zaburzeniami poznawczymi, w tym myszy z APP/PS1 transgenicznych i myszy z AD indukowaną skopolaminą. W obecnym badaniu porównano wpływ HAL (2, 5, i 10 mg/kg) i HAR (10, 20, i 30 mg/kg) na pamięć u myszy, którym podawano skopolaminę, stosując ocenę behawioralną MWM. Skopolamina (1 mg/kg) została zweryfikowana, aby uszkodzić zdolność przestrzennego uczenia się i pamięci myszy w zadaniu MWM, co było zgodne z naszymi wcześniejszymi badaniami (He i in., 2015a; Liu i in., 2017). Po leczeniu za pomocą HAL (dawki L, M i H) i HAR (dawki M i H), latencja ucieczki i długość ścieżki zostały zmniejszone, a częstotliwość przechodzenia została skutecznie zwiększona (ryc. 2, 3), wykazując, że podawanie HAL i HAR zauważalnie poprawiło uczenie się i pamięć przestrzenną myszy indukowanych skopolaminą, a poprawa HAL była bardziej znacząca niż poprawa HAR.
W celu dalszego wyjaśnienia mechanizmu leżącego u podstaw poprawy uczenia się i pamięci przez HAL i HAR u myszy indukowanych skopolaminą, oceniono zmiany w układzie cholinergicznym, stres oksydacyjny i stan zapalny. Jak donoszono we wcześniejszej literaturze (Abd-El-Fattah et al., 2014; Lin et al., 2016; Demirci et al., 2017), wstrzyknięcie skopolaminy i.p. prowadziło do osłabienia funkcji cholinergicznych, podwyższonego stresu oksydacyjnego i stanu zapalnego w obecnym badaniu. Donepezil jest reprezentatywną terapią objawową łagodnej i umiarkowanej AD jako inhibitor AChE (Bohnen et al., 2005), a ostatnie badania ujawniły, że może on również tłumić zapalenie i stres oksydacyjny (Saxena et al., 2008; Yoshiyama et al., 2010). W tym badaniu donepezil (kontrola pozytywna) skutecznie łagodził te zmiany u myszy indukowane skopolaminą i poprawiał ich uczenie się i pamięć. Podobnie jak ich aktywność in vitro (Zhao i in., 2013; Liu i in., 2014), HAL i HAR w różnych dawkach nie tylko odwracały indukowane skopolaminą podwyższenie aktywności AChE, ale także powodowały podwyższenie poziomu neuroprzekaźnika ACh i obniżenie Ch w korze mózgowej, hipokampie lub osoczu (ryc. 4, 9, 10). Ponadto, poziomy białka korowej AChE były wyraźnie hamowane przez HAL i HAR (Ryc. 6C,D). Jak donoszą Oh i wsp. (2009), neurony ChAT-pozytywne były znacząco zredukowane przez leczenie skopolaminą. Obecne wyniki wskazują, że HAL i HAR mogą odwrócić spadek aktywności ChAT wywołany przez skopolaminę (Ryc. 4B,E), natomiast nie mają wpływu na ekspresję białka ChAT (Ryc. 6E,F) i wymaga to dalszych badań. Hence, these confirmed that anti-amnesic effects of HAL and HAR on the cognition dysfunction induced by scopolamine probably associated with modification of cholinergic system (particularly AChE), and HAL demonstrated an obvious cholinergic improvement at low dosage (2 mg/kg).
Additionally, many studies have shown that increased oxidative stress is extensively considered as a prominent contributive risk factor in the development of AD (Ghumatkar et al., 2015; Lu et al., 2018). HAL i HAR mogą służyć jako endogenne przeciwutleniacze i stwierdzono, że posiadają zdolność przeciwutleniającą poprzez zmiatanie wolnych rodników (Tse-Susanna i in., 1991; Berrougui i in., 2006a,b). W tym badaniu, nadprodukcja ROS (produkt peroksydacji lipidów, MDA) i redukcja enzymów antyoksydacyjnych (SOD i GSH-px) były obserwowane u myszy indukowanych skopolaminą (rysunek 5). Jednak podawanie HAL i HAR wyraźnie aktywowało enzymy antyoksydacyjne SOD i GSH-px oraz hamowało powstawanie MDA w korze mózgowej myszy z demencją wywołaną skopolaminą (Figura 5), a następnie poprawiło zdolność obrony antyoksydacyjnej, wskazując na neuroprotekcyjne działanie HAL i HAR. Co warte podkreślenia, efekty antyoksydacyjne HAL i HAR były ogólnie porównywalne.
Co więcej, coraz więcej dowodów sugeruje, że upośledzenie pamięci jest związane ze zwiększonym neurozapaleniem (Abd-El-Fattah et al., 2014). Według badań Bensalem i wsp. (2014), HAL i HAR wykazywały znaczące hamowanie na MPO z IC50 wynoszącym odpowiednio 0,08 i 0,26 μM. Aktywność przeciwzapalną HAR uzyskano poprzez hamowanie TNF-α i NO w stymulowanych lipopolisacharydem mysich komórkach RAW264 i ludzkich komórkach THP-1 (Patel i in., 2012). Zwraca uwagę wysoki poziom cytokin prozapalnych (TNF-α i MPO) oraz mediatora zapalnego (NO) w mózgu myszy z amnezją indukowaną skopolaminą (ryc. 4, 5). Obecne badania potwierdziły, że leczenie HAL i HAR może jednocześnie hamować generowanie NO i wzrost TNF-α i MPO, a hamujące działanie HAL na TNF-α i NO było bardziej widoczne niż HAR (ryc. 4, 5). Ponadto, wyniki analizy western blotting i immunofluorescencji dodatkowo dowodzą, że poziomy ekspresji białka MPO były wyraźnie tłumione przez HAL i HAR (ryc. 7, 8), sugerując, że zdolność HAL i HAR do przeciwdziałania deficytom pamięci może być pośredniczona przez tłumienie markerów zapalnych TNF-α, MPO i NO.
Jak wiadomo, AD jest związana z nieodpowiednimi poziomami różnych neuroprzekaźników (Kumar i Singh, 2015; Svob Strac i in., 2015). Wcześniejsze badania donosiły, że myszy otrzymujące samą skopolaminę wykazywały znaczne obniżenie reaktywności układu cholinergicznego, na co wskazywał obniżony poziom ACh oraz zwiększona aktywność AChE wraz z obniżoną aktywnością ChAT (Lee i in., 2014). W transgenicznym modelu zwierzęcym AD wykazano obniżający się poziom Glu (Nilsen i in., 2012), a metabolomika surowicy i osocza również wskazywała na spadek Trp, 5-HT, Glu, Phe, Tyr w mysim modelu AD lub u pacjentów (Vermeiren i in., 2014; González-Domínguez i in., 2015; Weng i in., 2015; Corso i in., 2017; Li i in., 2018). Odpowiednio, nasze wyniki dowiodły, że otępieniu wywołanemu przez skopolaminę towarzyszyło obniżenie stężenia ACh, L-Trp, 5-HT, L-Glu, L-Phe, L-Tyr oraz podwyższenie stężenia Ch i γ-GABA, co jest zgodne z wcześniejszymi badaniami (Scali i in., 1999; Nilsen et al., 2012; Lee et al., 2014; Vermeiren et al., 2014; González-Domínguez et al., 2015; Kumar and Singh, 2015; Weng et al., 2015; Zhou et al., 2016; Corso et al., 2017; Liu et al., 2017). Neuroprzekaźniki odgrywają ważną rolę w obwodzie mózgowym zaangażowanym w wiele aspektów uczenia się i pamięci, szczególnie neuroprzekaźniki cholinergiczne, serotoninergiczne, glutametargiczne i GABAergiczne (Vermeiren i in., 2014; Kumar i Singh, 2015; Zhou i in., 2016). Warto zauważyć, że z wyjątkiem L-Phe i L-Tyr, pozostałe zmiany mogły być skutecznie odwrócone zarówno przez podawanie HAL, jak i HAR w osoczu i korze, a modulacje HAL były bardziej uderzające niż modulacje HAR (Ryc. 9, 10). W związku z tym, regulacje tych neuroprzekaźników przez HAL i HAR mogą być korzystne dla poprawy zdolności uczenia się i pamięci u myszy z demencją.
Ogólnie rzecz biorąc, HAL (2, 5, i 10 mg/kg) i HAR (20 i 30 mg/kg) wykazały wzmocnienie neurotransmisji cholinergicznej poprzez tłumienie AChE i indukowanie ChAT, wzmocnienie obrony antyoksydacyjnej poprzez zwiększenie aktywności SOD i GSH-px oraz zmniejszenie produkcji MDA, wzmocnienie działania przeciwzapalnego poprzez obniżenie TNF-α, MPO i NO oraz modulację poziomu kluczowych neuroprzekaźników (ACh, Ch, L-Trp, 5-HT, γ-GABA i L-Glu). Tak więc, HAL i HAR mogą działać na wiele celów jako terapeutyki dla AD. Ponadto, regulacje HAL na funkcję cholinergiczną, zapalenie i neuroprzekaźniki były bardziej zauważalne niż HAR, a HAL wykazywał podobną zdolność antyoksydacyjną jak HAR. W szczególności, skuteczna dawka HAL (2 mg/kg) była znacznie niższa niż HAR (20 mg/kg), co może wynikać głównie z różnic w biodostępności i stabilności metabolicznej tych dwóch leków (Li i in., 2017b). Łącznie, wszystkie te wyniki ujawniły, że w porównaniu z HAR, HAL może być lepszym związkiem kandydującym o lepszych właściwościach antyamnezyjnych i farmakokinetycznych w terapii AD.
Wnioski
Podsumowując, HAL i HAR mogły skutecznie złagodzić upośledzenie pamięci w modelu mysim indukowanym skopolaminą poprzez poprawę funkcji układu cholinergicznego, tłumienie stresu oksydacyjnego i uszkodzeń zapalnych oraz modulację istotnych neuroprzekaźników w otępieniu u myszy. Szczególnie w przypadku HAL, regulacje na funkcję cholinergiczną, stan zapalny i neuroprzekaźniki były bardziej znaczące niż w przypadku HAR i wykazywały porównywalne działanie antyoksydacyjne do HAR. Warto zauważyć, że skuteczna dawka HAL (2 mg/kg) była znacznie niższa niż HAR (20 mg/kg). Ogólne wyniki wskazują, że HAL może być lepszym kandydatem na lek w leczeniu dysfunkcji uczenia się i pamięci, takich jak AD. Dalsze oceny muszą być podjęte w zakresie działania antyamnezyjnego i mechanizmów molekularnych HAL, co dostarczy istotnych wstępnych dowodów na zapobieganie i leczenie AD.
Wkład autorów
S-PL i C-HW: uczestniczyli w projektowaniu badań, przeprowadzili analizę danych, napisali lub przyczynili się do napisania manuskryptu. S-PL, Y-WW, S-LQ, Y-PZ, GD, W-ZD, CM, Q-YL, H-DG, WL, and X-MC: conducted experiments.
Funding
This work was supported by the National Natural Science Foundation of China and the Xinjiang Uygur Autonomous Region of China (Grant No. U1130303), National Natural Science Foundation of China (Grant No. 81173119), the Key Project of Ministry of Science and Technology of China (Grant No. 2012ZX09103201-051), and the Technology Cooperation Projects of Science in Shanghai, China (Grant No. 14495800200) awarded to C-HW for financial support of this study.
Conflict of Interest Statement
Autorzy deklarują, że badania były prowadzone przy braku jakichkolwiek komercyjnych lub finansowych relacji, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Abd-El-Fattah, M. A., Abdelakader, N. F., and Zaki, H. F. (2014). Pyrrolidine dithiocarbamate protects against scopolamine-induced cognitive impairment in rats. Eur. J. Pharmacol. 723, 330-338. doi: 10.1016/j.ejphar.2013.11.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Aucoin, J. S., Jiang, P., Aznavour, N., Tong, X. K., Buttini, M., Descarries, L., et al. (2005). Selective cholinergic denervation, independent from oxidative stress, in a mouse model of Alzheimer’s disease. Neuroscience 132, 73-86. doi: 10.1016/j.neuroscience.2004.11.047
PubMed Abstract | CrossRef Full Text | Google Scholar
Bassani, T. B., Turnes, J. M., Moura, E. L., Bonato, J. M., Cóppola-Segovia, V., Zanata, S. M., et al. (2017). Effects of curcumin on short-term spatial and recognition memory, adult neurogenesis and neuroinflammation in a streptozotocin-induced rat model of dementia of Alzheimer’s type. Behav. Brain Res. 335, 41-54. doi: 10.1016/j.bbr.2017.08.014
PubMed Abstract | CrossRef Full Text | Google Scholar
Bensalem, S., Soubhye, J., Aldib, I., Bournine, L., Nguyen, A. T., Vanhaeverbeek, M., et al. (2014). Inhibition of myeloperoxidase activity by the alkaloids of Peganum harmala L. (Zygophyllaceae). J. Ethnopharmacol. 154, 361-369. doi: 10.1016/j.jep.2014.03.070
PubMed Abstract | CrossRef Full Text | Google Scholar
Berrougui, H., Isabelle, M., Cloutier, M., Hmamouchi, M., and Khalil, A. (2006a). Ochronne działanie Peganum harmala L. ekstraktu, harmina i harmalina przeciwko ludzkiej niskiej gęstości lipoprotein oksydacji. J. Pharm. Pharmacol. 58, 967-974. doi: 10.1211/jpp.58.7.0012
PubMed Abstract | CrossRef Full Text | Google Scholar
Berrougui, H., Martín-Cordero, C., Khalil, A., Hmamouchi, M., Ettaib, A., Marhuenda, E., et al. (2006b). Vasorelaxant effects of harmine and harmaline extracted from Peganum harmala L. seed’s in isolated rat aorta. Pharmacol. Res. 54, 150-157. doi: 10.1016/j.phrs.2006.04.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Bohnen, N. I., Kaufer, D. I., Hendrickson, R., Ivanco, L. S., Lopresti, B. J., Koeppe, R. A., et al. (2005). Degree of inhibition of cortical acetylcholinesterase activity and cognitive effects by donepezil treatment in Alzheimer’s disease. J. Neurol. Neurosurg. Psychiatry 76, 315-319. doi: 10.1136/jnnp.2004.038729
PubMed Abstract | CrossRef Full Text | Google Scholar
Bromley-Brits, K., Deng, Y., and Song, W. H. (2011). Morris water maze test for learning and memory deficits in Alzheimer’s disease model mice. J. Vis. Exp. 53, 1-5. doi: 10.3791/2920
PubMed Abstract | CrossRef Full Text | Google Scholar
Corso, G., Cristofano, A., Sapere, N., La Marca, G., Angiolillo, A., Vitale, M., et al. (2017). Serum amino acid profiles in normal subjects and in patients with or at risk of Alzheimer dementia. Dement. Geriatr. Cogn. Dis. Extra 7, 143-159. doi: 10.1159/000466688
PubMed Abstract | CrossRef Full Text | Google Scholar
Coyle, J. T., Price, D. L., and Delong, M. R. (1983). Alzheimer’s disease: a disorder of cortical cholinergic innervation. Science 219, 1184-1190. doi: 10.1126/science.6338589
CrossRef Full Text | Google Scholar
Demirci, K., Nazıroğlu, M., Övey,İ. S., and Balaban, H. (2017). Selen attenuates apoptosis, inflammation and oxidative stress in the blood and brain of aged rats with scopolamine-induced dementia. Metab. Brain Dis. 32, 321-329. doi: 10.1007/s11011-016-9903-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Fan, L. Y., and Chiu, M. J. (2014). Combotherapy i aktualne koncepcje, a także przyszłe strategie leczenia choroby Alzheimera. Neuropsychiatr. Dis. Treat. 10, 439-451. doi: 10.2147/NDT.S45143
PubMed Abstract | CrossRef Full Text | Google Scholar
Frison, G., Favretto, D., Zancanaro, F., Fazzin, G., and Ferrara, S. D. (2008). A case of beta-carboline alkaloid intoxication following ingestion of Peganum harmala seed extract. Forensic Sci. Int. 179, 37-43. doi: 10.1016/j.forsciint.2008.05.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Ghumatkar, P. J., Patil, S. P., Jain, P. D., Tambe, R. M., and Sathaye, S. (2015). Nootropowe, neuroprotekcyjne i neurotroficzne działanie phloretin w amnezji indukowanej skopolaminą u myszy. Pharmacol. Biochem. Behav. 135, 182-191. doi: 10.1016/j.pbb.2015.06.005
PubMed Abstract | CrossRef Full Text | Google Scholar
González-Domínguez, R., García-Barrera, T., and Gómez-Ariza, J. L. (2015). Metabolite profiling for the identification of altered metabolic pathways in Alzheimer’s disease (Profilowanie metabolitów w celu identyfikacji zmienionych szlaków metabolicznych w chorobie Alzheimera). J. Pharm. Biomed. Anal. 107, 75-81. doi: 10.1016/j.jpba.2014.10.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Goverdhan, P., Sravanthi, A., and Mamatha, T. (2012). Neuroprotekcyjne działanie meloksykamu i selegiliny w indukowanych skopolaminą zaburzeniach poznawczych i stresie oksydacyjnym. Int. J. Alzheimers Dis. 2012, 1-8. doi: 10.1155/2012/974013
PubMed Abstract | CrossRef Full Text | Google Scholar
Gray, E., Thomas, T. L., Betmouni, S., Betmouni, S., Scolding, N., and Love, S. (2008). Podwyższona aktywność i mikroglejowa ekspresja mieloperoksydazy w demielinizowanej korze mózgowej w stwardnieniu rozsianym. Brain Pathol. 18, 86-95. doi: 10.1111/j.1750-3639.2007.00110.x
PubMed Abstract | CrossRef Full Text | Google Scholar
He, D. D., Wu, H., Wei, Y., Liu, W., Huang, F., Shi, H. L., et al. (2015a). Effects of harmine, an acetylcholinesterase inhibitor, on spatial learning and memory of APP/PS1 transgenic mice and scopolamine-induced memory impairment mice. Eur. J. Pharmacol. 768, 96-107. doi: 10.1016/j.ejphar.2015.10.037
PubMed Abstract | CrossRef Full Text | Google Scholar
He, D. D., Zhang, L., Liu, L., Wu, X. J., Cheng, X. M., and Wang, C. H. (2015b). Total alkaloidy z nasion Peganum harmala ameliorating mice learning ability and memory. Chin. Tradit. Pat. Med. 37, 478-482.
Heneka, M. T., Carson, M. J., El Khoury, J., Landreth, G. E., Brosseron, F., Feinstein, D. L., et al. (2015). Neuroinflammation in Alzheimer’s disease (Neurozapalenie w chorobie Alzheimera). Lancet Neurol. 14, 388-405. doi: 10.1016/S1474-4422(15)70016-5
CrossRef Full Text | Google Scholar
Herraiz, T., Gonzalez, D., Ancin-Azpilicueta, C., Arán, V. J., and Guillén, H. (2010). Beta-karboline alkaloids in Peganum harmala and inhibition of human monoamine oxidase (MAO). Food Chem. Toxicol. 48, 839-845. doi: 10.1016/j.fct.2009.12.019
PubMed Abstract | CrossRef Full Text | Google Scholar
Jang, Y. J., Kim, J., Shim, J., Kim, C. Y., Jang, J. H., Lee, K. W., et al. (2013). Decaffeinated coffee prevents scopolamine-induced memory impairment in rats. Behav. Brain Res. 245, 113-119. doi: 10.1016/j.bbr.2013.02.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Jeon, S. J., Kim, B., Park, H. J., Zhang, J. B., Kwon, Y., Kim, D. H., et al. (2017). The ameliorating effect of 1-palmitoyl-2-linoleoyl-3-acetylglycerol on scopolamine-induced memory impairment via acetylcholinesterase inhibition and LTP activation. Behav. Brain Res. 324, 58-65. doi: 10.1016/j.bbr.2017.01.040
PubMed Abstract | CrossRef Full Text | Google Scholar
Jiang, B. (2016). Study on the Transportation of Alkaloids from Peganum harmala through the Blood Brain Barrier and the Mechanism of Their Effect on the Neurotransmitters in Rats Brain. Doctor dissertation, Shanghai University of Traditional Chinese Medicine, Shanghai.
Jiménez, J., Riveron-Negrete, L., Abdullaev, F., Espinosa-Aguirrec, J., and Rodríguez-Arnaiza, R. (2008). Cytotoksyczność alkaloidów β-karbolinowych harminy i harmaliny w testach na komórkach ludzkich in vitro. Exp. Toxicol. Pathol. 60, 381-389. doi: 10.1016/j.etp.2007.12.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Kaur, R., Singh, V., and Shri, R. (2017). Antyamnezowe działanie gatunków Ganoderma: możliwy mechanizm cholinergiczny i antyoksydacyjny. Biomed. Pharmacother. 92, 1055-1061. doi: 10.1016/j.biopha.2017.06.029
PubMed Abstract | CrossRef Full Text | Google Scholar
Kouémou, N. E., Taiwe, G. S., Moto, F. C. O., Pale, S., Gwladys, N. T., Njapdounke, J. S. K., et al. (2017). Nootropic and neuroprotective effects of dichrocephala integrifolia on scopolamine mouse model of Alzheimer’s disease. Front. Pharmacol. 8:847. doi: 10.3389/fphar.2017.00847
CrossRef Full Text | Google Scholar
Kumar, A., and Singh, A. (2015). Przegląd na temat patofizjologii choroby Alzheimera i jej zarządzania: aktualizacja. Pharmacol. Rep. 67, 195-203. doi: 10.1016/j.pharep.2014.09.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Kwon, S. H., Lee, H. K., Kim, J. A., Hong, S. I., Kim, H. C., Jo, T. H., et al. (2010). Neuroprotective effects of chlorogenic acid on scopolamine-induced amnesia via anti-acetylcholinesterase and anti-oxidative activities in mice. Eur. J. Pharmacol. 649, 210-217. doi: 10.1016/j.ejphar.2010.09.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Lee, H. E., Jeon, S. J., Ryu, B., Park, S. J., Ko, S. Y., Lee, Y., et al. (2016). Swertisin, a C-glucosylflavone, ameliorates scopolamine-induced memory impairment in mice with its adenosine A1 receptor antagonistic property. Behav. Brain Res. 306, 137-145. doi: 10.1016/j.bbr.2016.03.030
PubMed Abstract | CrossRef Full Text | Google Scholar
Lee, S., Kim, J., Seo, S. G., Choi, B. R., Han, J. S., Lee, K. W., et al. (2014). Sulforaphane alleviates scopolamine-induced memory impairment in mice. Pharmacol. Res. 85, 23-32. doi: 10.1016/j.phrs.2014.05.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, J., Liu, Y., Li, W., Wang, Z., Guo, P., Li, L., et al. (2018). Metaboliczne profilowanie efektów działania ginsenozydu Re w mysim modelu choroby Alzheimera. Behav. Brain Res. 337, 160-172. doi: 10.1016/j.bbr.2017.09.027
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, S. P., Cheng, X. M., and Wang, C. H. (2017a). A review on traditional uses, phytochemistry, pharmacology, pharmacokinetics and toxicology of the genus Peganum. J. Ethnopharmacol. 203, 127-162. doi: 10.1016/j.jep.2017.03.049
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, S. P., Zhang, Y. P., Deng, G., Wang, Y. W., Qi, S. L., Cheng, X. M., et al. (2017b). Charakterystyka ekspozycji analogicznych alkaloidów β-karbolinowych harmaliny i harminy w oparciu o transporter efflux białka oporności wielolekowej 2. Front. Pharmacol. 8:541. doi: 10.3389/fphar.2017.00541
CrossRef Full Text | Google Scholar
Lin, J. J., Huang, L., Yu, J., Xiang, S. Y., Wang, J. L., Zhang, J. R., et al. (2016). Fukoksantyna, morski karotenoid, odwraca wywołane skopolaminą zaburzenia poznawcze u myszy i hamuje acetylocholinoesterazę in vitro. Mar. Drugs 14:67. doi: 10.3390/md14040067
PubMed Abstract | CrossRef Full Text | Google Scholar
Lin, M. T., and Beal, M. F. (2006). Mitochondrial dysfunction and oxidative stress in neurodegenerative diseases. Nature 443, 787-795. doi: 10.1038/nature05292
PubMed Abstract | CrossRef Full Text | Google Scholar
Liu, W., Yang, Y. D., Cheng, X. M., Gong, C., Li, S. P., He, D. D., et al. (2014). Rapid and sensitive detection of the inhibitive activities of acetyl- and butyryl-cholinesterases inhibitors by UPLC-ESIMS/MS. J. Pharm. Biomed. Anal. 94, 215-220. doi: 10.1016/j.jpba.2014.02.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Liu, W., Zhu, Y. D., Wang, Y. L., Qi, S. L., Wang, Y. W., Ma, C., et al. (2017). Anti-amnesic effect of extract and alkaloid fraction from aerial parts of Peganum harmala on scopolamine-induced memory deficits in mice. J. Ethnopharmacol. 204, 95-106. doi: 10.1016/j.jep.2017.04.019
PubMed Abstract | CrossRef Full Text | Google Scholar
Louis, E. D., Jiang, W., Gerbin, M., Mullaney, M. M., and Zheng, W. (2010). Relationship between blood harmane and harmine concentrations in familial essential tremor, sporadic essential tremor and controls. Neurotoxicology 31, 674-679. doi: 10.1016/j.neuro.2010.08.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Lu, C., Dong, L. M., Lv, J. W., Wang, Y., Fan, B., Wang, F., et al. (2018). 20(S)-protopanaksadiol (PPD) łagodzi wywołane skopolaminą upośledzenie pamięci poprzez regulację układów cholinergicznego i antyoksydacyjnego oraz ekspresję Egr-1, c-Fos i c-Jun u myszy. Chem. Biol. Interact. 279, 64-72. doi: 10.1016/j.cbi.2017.11.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Mahmoudian, M., Jalipour, H., and Dardashti, P. S. (2002). Toksyczność Peganum harmala: przegląd i opis przypadku. Iran. J. Pharmacol. Ther. 1, 1-4.
Google Scholar
Malik, J., Kaur, J., and Choudhary, S. (2017). Standaryzowany ekstrakt Lactuca sativa Linn. i jego frakcje uchylają amnezję wywołaną skopolaminą u myszy: możliwy mechanizm cholinergiczny i antyoksydacyjny. Nutr. Neurosci. 1-12. doi: 10.1080/1028415X.2017.1291166 .
PubMed Abstract | CrossRef Full Text | Google Scholar
Morris, R. G., Garrud, P., Rawlins, J. A., and O’Keefe, J. (1982). Place navigation impaired in rats with hippocampal lesions. Nature 297, 681-683. doi: 10.1038/297681a0
CrossRef Full Text | Google Scholar
Nilsen, L. H., Melø, T. M., Sæther, O., Witter, M. P., and Sonnewald, U. (2012). Altered neurochemical profile in the McGill-R-Thy1-APP rat model of Alzheimer’s disease: a longitudinal in vivo 1H MRS study. J. Neurochem. 123, 532-541. doi: 10.1111/jnc.12003
PubMed Abstract | CrossRef Full Text | Google Scholar
Oh, J. H., Choi, B. J., Chang, M. S., and Park, S. K. (2009). Nelumbo nucifera semen extract improves memory in rats with scopolamine-induced amnesia through the induction of choline acetyltransferase expression. Neurosci. Lett. 461, 41-44. doi: 10.1016/j.neulet.2009.05.045
PubMed Abstract | CrossRef Full Text | Google Scholar
Patel, K., Gadewar, M., Tripathi, R., Prasad, S. K., and Patel, D. K. (2012). A review on medicinal importance, pharmacological activity and bioanalytical aspects of beta-carboline alkaloid „Harmine”. Asian Pac. J. Trop. Biomed. 2, 660-664. doi: 10.1016/S2221-1691(12)60116-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Rijpma, A., Meulenbroek, O., and Rikkert, M. O. (2014). Inhibitory cholinesterazy i suplementy diety add-on w chorobie Alzheimera: przegląd systematyczny randomizowanych badań kontrolowanych. Ageing Res. Rev. 16, 105-112. doi: 10.1016/j.arr.2014.06.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Saxena, G., Singh, S. P., Agrawal, R., and Nath, C. (2008). Effect of donepezil and tacrine on oxidative stress in intracerebral streptozotocin-induced model of dementia in mice. Eur. J. Pharmacol. 581, 283-289. doi: 10.1016/j.ejphar.2007.12.009
PubMed Abstract | CrossRef Full Text | Google Scholar
Scali, C., Prosperi, C., Giovannelli, L., Bianchi, L., Pepeu, G., and Casamenti, F. (1999). β (1-40) Peptyd amyloidu wstrzyknięty do jądra podstawy szczurów wywołuje reakcję mikrogleju i zwiększa korowe uwalnianie kwasu γ-aminomasłowego in vivo. Brain Res. 831, 319-321. doi: 10.1016/S0006-8993(99)01492-4
CrossRef Full Text | Google Scholar
Shi, X. Y., Liu, W., Zhang, L., Li, S. P., Cheng, X. M., Xi, Y., et al. (2014). Pharmacokinetics of harmaline, harmine and their metabolites in rats administered with total alkaloid extracts from Peganum harmala L. Chin. Tradit. Pat. Med. 36, 1169-1175. doi: 10.3969/j.issn.1001-1528.2014.06.013
CrossRef Full Text | Google Scholar
Singh, S., Kaur, H., and Sandhir, R. (2016). Wymiary fraktalne: nowy paradygmat do oceny pamięci przestrzennej i uczenia się przy użyciu labiryntu wodnego Morrisa. Behav. Brain Res. 299, 141-146. doi: 10.1016/j.bbr.2015.11.023
PubMed Abstract | CrossRef Full Text | Google Scholar
Svob Strac, D., Muck-Seler, D., and Pivac, N. (2015). Pomiary neuroprzekaźników w płynie mózgowo-rdzeniowym u pacjentów z chorobą Alzheimera: przegląd. Psychiatr. Danub. 27, 14-24.
Google Scholar
Tse-Susanna, Y. H., Mak, I. T., and Dickens, B. F. (1991). Antioxidative properties of harmane and β-carboline alkaloids. Biochem. Pharmacol. 42, 459-464. doi: 10.1016/0006-2952(91)90305-O
CrossRef Full Text | Google Scholar
Vermeiren, Y., Van Dam, D., Aerts, T., Engelborghs, S., and De De Deyn, P. P. (2014). Monoaminergic neurotransmitter alterations in postmortem brain regions of depressed and aggressive patients with Alzheimer’s disease. Neurobiol. Aging 35, 2691-2700. doi: 10.1016/j.neurobiolaging.2014.05.031
PubMed Abstract | CrossRef Full Text | Google Scholar
Verri, M., Pastoris, O., Dossena, M., Aquilani, R., Guerriero, F., Cuzzoni, G., et al. (2012). Mitochondrial alterations, oxidative stress and neuroinflammation in Alzheimer’s disease. Int. J. Immunopathol. Pharmacol. 25, 345-353. doi: 10.1177/039463201202500204
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, C. H., Zhang, Z. X., Wang, Y. H., and He, X. J. (2015). Cytotoksyczne alkaloidy indolowe przeciwko liniom komórkowym ludzkiej białaczki z rośliny toksycznej Peganum harmala. Toxins 7, 4507-4518. doi: 10.3390/toxins7114507
PubMed Abstract | CrossRef Full Text | Google Scholar
Weng, R., Shen, S. S., Tian, Y. L., Burton, C., Xu, X. Y., Liu, Y., et al. (2015). Metabolomics approach reveals integrated metabolic network associated with serotonin deficiency. Sci. Rep. 5:11864. doi: 10.1038/srep11864
PubMed Abstract | CrossRef Full Text | Google Scholar
Yoshiyama, Y., Kojima, A., Ishikawa, C., and Arai, K. (2010). Przeciwzapalne działanie donepezilu poprawia patologię tau, utratę synaptyczną i neurodegenerację w trybie myszy z tauopatią. J. Alzheimers Dis. 22, 295-306. doi: 10.3233/JAD-2010-100681
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhang, L. (2013). Study on the Film Coating Tablets of Total Alkaloids from Peganum harmala. Master Dissertation, Shanghai University of Traditional Chinese Medicine, Shanghai.
Zhao, T., Ding, K. M., Zhang, L., Cheng, X. M., Wang, C. H., and Wang, Z. T. (2013). Acetylocholinesterase and butyrylcholinesterase inhibitory activities of β-carboline and quinoline alkaloids derivatives from the plants of genus Peganum. J. Chem. 2013:717232. doi: 10.1155/2013/717232
CrossRef Full Text | Google Scholar
Zhou, X. L., Li, Y. F., Shi, X. Z., and Ma, C. (2016). An overview on therapeutics attenuating amyloid β level in Alzheimer’s disease: targeting neurotransmission, inflammation, oxidative stress and enhanced cholesterol levels. Am. J. Transl. Res. 8, 246-269.
PubMed Abstract | Google Scholar
.
Leave a Reply