Frontiers in Oncology
Background
Osteoporoza wywołana napromienianiem i wynikające z niej złamania z niewydolności (IF) są bardzo częste. Częstość występowania IF po napromienianiu jamy brzusznej lub miednicy waha się od 7 do 45% (1-8). W niektórych sytuacjach onkologicznych, takich jak hormonalne leczenie raka piersi i prostaty, klinicyści są zaznajomieni z osteoporozą związaną z leczeniem i ryzykiem złamań (9-13). Rutynowo zlecana jest absorpcjometria dwuenergetycznego promieniowania rentgenowskiego (DEXA), a środki zapobiegające osteoporozie, takie jak wapń, witamina D lub bifosfoniany, są przyjmowane profilaktycznie podczas obserwacji pacjentów. Brak jest jednak rutynowej oceny stanu kości, a także świadomości wśród onkologów radioterapeutów na temat toksyczności kostnej związanej z promieniowaniem oraz IF. Mimo że IF są często spotykane w obserwacji chorych po napromienianiu jamy brzusznej lub miednicy, a obecnie obserwuje się je z bardzo dużą częstością po napromienianiu stereotaktycznym, w praktyce onkologii radiacyjnej nie rozważa się wykonywania DEXA lub innych alternatywnych pomiarów gęstości mineralnej kości (BMD) (1-8, 14-16). Ze względu na nieznajomość IF przez onkologów radioterapeutów, często nie są one rozpoznawane lub czasami mogą być uważane za przerzuty do kości pierwotnego nowotworu, co prowadzi do błędów w sztuce, niepotrzebnych badań i stresu psychologicznego u pacjentów.
Ostatnio wykazaliśmy 9,6% ryzyko złamań kręgów u pacjentów leczonych napromienianiem jamy brzusznej (8). Uważamy, że kość powinna być traktowana jako narząd narażony na ryzyko przy planowaniu radioterapii, a BMD powinno być mierzone i śledzone regularnie u tych pacjentów przed i po napromienianiu. Onkolodzy radioterapii mogą określić stan zdrowia kości swoich pacjentów i nierozpoznane IF, używając swojego najważniejszego narzędzia: systemu planowania leczenia radioterapią.
BMD jest miarą gęstości mineralnej kości i wapnia i jest określana za pomocą DEXA (17, 18). DEXA jest obecnie uważana za złoty standard w ilościowym określaniu BMD i wykazano, że koreluje z ryzykiem złamań i skutecznością leczenia (17, 18). Kilka badań wykazało, że jednostki Hounsfielda (HUs) uzyskane w tomografii komputerowej (CT) wykazują silną korelację z BMD uzyskaną w DEXA (19-22). Wartości HU mogą dostarczyć wiarygodnej oceny regionalnej wytrzymałości kości i BMD, i mogą być wykorzystane do wykluczenia osteoporozy z dużą dokładnością (19-22). Ponadto, tomografia komputerowa w porównaniu z DEXA pozwala na dokładniejszą identyfikację złamań kręgów (23). Diagnostyczna i planowa tomografia komputerowa jest zlecana w celu ustalenia stopnia zaawansowania choroby, zaplanowania radioterapii lub w celu rutynowej obserwacji pacjentów. U tych pacjentów możemy wykorzystać HUs uzyskane z tomografii komputerowej do określenia i monitorowania BMD, a tym samym uniknąć dodatkowych kosztów i dodatkowej ekspozycji na promieniowanie z pomiaru DEXA. Oprócz tych zalet, widoki strzałkowe kręgów zrekonstruowane w prosty sposób z tomografii komputerowej mogą być wykorzystane do oceny nierozpoznanych i bezobjawowych złamań kości.
Celem niniejszego badania jest wykazanie utraty gęstości mineralnej kości i nierozpoznanych złamań kręgów poprzez pomiar HUs i rekonstrukcję strzałkową kręgów z tomografii komputerowej zaimportowanej do systemu planowania leczenia u pacjentów leczonych radioterapią jamy brzusznej.
Metody
Do grupy badanej włączono 57 kolejnych chorych operowanych z powodu gruczolakoraka żołądka, u których zastosowano adjuwantową radioterapię jamy brzusznej. Trzydziestu czterech kolejnych chorych z wczesnym stadium choroby, którzy nie wymagali leczenia adjuwantowego po operacji, stanowiło grupę kontrolną.
W grupie chorych napromienianych stosowano napromienianie fotonami 6 lub 15 MV metodą konformalną, z modulacją intensywności lub z modulacją objętościową (volumetric modulated arc). Przepisana dawka promieniowania wynosiła 46 Gy w 23 frakcjach po 2 Gy dziennie lub 45 Gy w 25 frakcjach po 1, 8 Gy dziennie, 5 dni w tygodniu, przez 5 tygodni. Wszyscy chorzy otrzymywali 5-fluorouracil w bolusie lub w infuzji, jeden cykl przed, dwa cykle równocześnie z i jeden cykl po radioterapii. Od wszystkich pacjentów uzyskano świadomą zgodę, a badanie zostało zatwierdzone przez lokalną komisję etyczną szpitala.
Tomografie planistyczne i diagnostyczne uzyskano za pomocą wielorzędowych skanerów CT (LightSpeed 16 slice lub VCT 64 slice; GE Healthcare, Waukesha, WI) o grubości 3 lub 5 mm. Tomografie jamy brzusznej importowano z radiologicznego systemu archiwizacji i komunikacji obrazów do systemu planowania leczenia Eclipse (TPS) (Varian Medical Systems, Palo Alto, CA). W grupie badanej pierwsza tomografia była już w systemie planowania leczenia w celu planowania napromieniania. Druga została wykonana 1 rok po radioterapii i zaimportowana do systemu planowania leczenia. W grupie kontrolnej tomografie jamy brzusznej uzyskane tuż po operacji i 1 rok później zostały zaimportowane do systemu planowania. Trzony kręgów T12-L1-L2 były obrysowywane w celu określenia średniej dawki promieniowania dla każdego trzonu kręgu u napromienianych chorych przez onkologa radioterapeutę. Następnie doświadczony radiolog przy użyciu TPS określił średnie wartości HU dla tych samych kręgów dla wszystkich chorych. Średnie wartości HU dla obu grup pacjentów zostały ponownie zmierzone 1 rok później.
Wartości HU na początku badania i te uzyskane 1 rok później zostały obliczone dla każdego trzonu kręgowego w każdej grupie i określono procentową zmianę w HU (Δ%HU). Chociaż czas trwania pomiarów HU został zaplanowany na początku i 1 rok później, kontynuowaliśmy regularną obserwację pacjentów przez co najmniej 5 lat po leczeniu pod kątem wyników onkologicznych. Złamania kompresyjne kręgów, jeśli się rozwinęły, określano na podstawie strzałkowej rekonstrukcji kręgów z tomografii komputerowej w trakcie obserwacji.
Technika pomiaruHU
HU były mierzone w osiowych przekrojach poprzecznych obszarów trabekularnych trzonów kręgów T12, L1, L2. Każdy trzon kręgowy został podzielony na trzy segmenty osiowe i HUs zostały obliczone przez umieszczenie prostokątnego obszaru zainteresowania (ROI) nad obszarem kości trabekularnej na trzonie kręgowym. Staraliśmy się unikać splotu żylnego w tylnej części kręgu i sklerotycznej kości podchrzęstnej. Pomiary zostały wyszczególnione w Supplemental Figure 1. Średnie wartości HU z trzech segmentów osiowych w każdym kręgu były uśrednione by określić ostateczną wartość HU dla każdego trzonu kręgu. HUpre reprezentuje wartość HU mierzoną w początkowym CT zarówno dla grupy badanej jak i kontrolnej, podczas gdy HUpost definiuje wartość HU mierzoną po 1 roku.
Analizy statystyczne
Procentowy spadek tłumienia kości (Δ%HU) dla każdego kręgu obliczono za pomocą następującego równania:
Analizy chi kwadratowe przeprowadzono w celu wykazania różnic między wiekiem, płcią i charakterystyką guza w grupach. Test t-Studenta został użyty do określenia różnic pomiędzy wartościami HU przed i po w każdej grupie oraz pomiędzy dwoma grupami, a także dla trzech poziomów dawki promieniowania (<20 Gy, 20-40 Gy i >40 Gy) w grupie badanej. Aby bezpośrednio ocenić wpływ dawki promieniowania na zmianę Δ%HU, przeprowadzono analizę korelacji Pearsona dla Δ%HU i dawki promieniowania. Za istotną uznawaliśmy wartość p < 0,05. Analizę statystyczną przeprowadzono przy użyciu oprogramowania Statistical Package for Social Sciences (SPSS) 17.0.
Wyniki
Dane dotyczące pacjentów i leczenia przedstawiono w tabeli 1. Nie stwierdzono istotnych statystycznie różnic między grupami pod względem wieku, płci, typu resekcji chirurgicznej i lokalizacji guza. W obu grupach zmierzono średnie wartości HU dla kręgów T12, L1 i L2. Na początku badania nie było istotnej statystycznie różnicy w wartościach HU mierzonych dla wszystkich kręgów pomiędzy grupą badaną i kontrolną. Podczas gdy średnie wartości HU kręgów T12, L1, L2 zmniejszyły się istotnie w grupie badanej (p < 0,001 dla każdego kręgu) po 1 roku, w tym samym okresie nie stwierdzono istotnych zmian wartości HU w grupie kontrolnej (odpowiednio p: 0,09-0,08-0,24). Tabela 2 podsumowuje zmiany wartości HU w grupie badanej i kontrolnej.
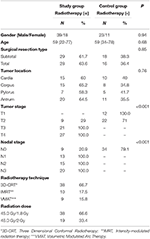
Tabela 1. Charakterystyka pacjentów i leczenia.

Tabela 2. Comparison of HUs in both groups themselves and in between the two groups for each vertebra.
Średnie dawki promieniowania dla kręgów T12, L1, i L2 w badanej grupie wynosiły odpowiednio 34,55 ± 11,1; 31,82 ± 12,4; 30,37 ± 13,6 Gy. Stwierdzono ujemną i istotną korelację pomiędzy Δ%HU a dawką promieniowania otrzymaną przez każdy z kręgów. W miarę wzrostu dawki promieniowania HUs zmniejszały się w każdym kręgu. Zostało to podsumowane na rysunkach 1-3.
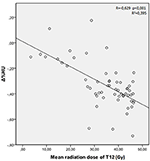
Rysunek 1. Korelacja pomiędzy Δ%HU a dawką promieniowania otrzymaną przez kręg T12.
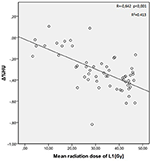
Rysunek 2. Korelacja pomiędzy Δ%HU a dawką promieniowania otrzymaną przez kręg L1.
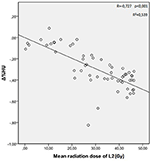
Rysunek 3. Korelacja pomiędzy Δ%HU a dawką promieniowania otrzymaną przez kręgi L2.
Zależność pomiędzy dawką promieniowania otrzymaną przez kręgi a zmianą HU została podsumowana w tabeli 3. Chociaż spadek wartości HU był statystycznie istotny przy dawkach promieniowania powyżej 20 Gy, wartości HU nie uległy istotnej zmianie przy dawkach promieniowania poniżej 20 Gy, z wyjątkiem kręgów L2.

Tabela 3. Zmiana w HUs w odniesieniu do grup dawki promieniowania.
Złamania
Podczas gdy żaden pacjent w grupie kontrolnej nie miał złamań, u 4 z 57 pacjentów (%7) w grupie napromienianej rozwinęły się złamania kręgów w trakcie trwania badania. Podczas gdy dwa ze złamań kręgów zaobserwowano u kobiet, dwa z nich zaobserwowano u mężczyzn. Złamania stwierdzono w 16, 18, 20 i 26 miesiącu po napromienianiu, z medianą czasu obserwacji wynoszącą 24 miesiące (zakres: 12-36 miesięcy). U trzech chorych stwierdzono złamania w obrębie kręgu L1, a u jednego chorego w obrębie kręgu L2. Średnie dawki promieniowania otrzymane przez każdy złamany kręg wynosiły odpowiednio: 39, 28,5, 22,3, 31 Gy. Charakterystykę chorych ze złamaniami kręgów przedstawiono w Tabeli 1 i na Rycinie 2.
Dyskusja
Radioterapia prowadzi do osteoporozy na drodze mechanizmów bezpośrednich i pośrednich, a IF rozwijają się często po napromienianiu miednicy lub jamy brzusznej w praktyce klinicznej (1-8). IF w kręgosłupie i miednicy są powszechne i stanowią ważny późny efekt uboczny radioterapii. Jednakże, onkolodzy radioterapeuci nie są świadomi istnienia osteoporozy i toksyczności kostnej spowodowanej napromienianiem. Z tego powodu nie zwraca się szczególnej uwagi na zapobieganie temu ważnemu późnemu powikłaniu. W naszej poprzedniej pracy (8) staraliśmy się podkreślić wagę tego problemu i odnotowaliśmy bardzo wysoką częstość złamań kręgów po napromienianiu jamy brzusznej, podobnie jak u chorych napromienianych z powodu guzów miednicy (1-7).
Onkolodzy radioterapii podczas planowania leczenia napromienianiem zwracają dużą uwagę na dawkę promieniowania otrzymywaną przez każdy zagrożony narząd. Chociaż wskaźniki późnej toksyczności stopnia III/IV dla tych bardzo ściśle przestrzeganych powikłań nie przekraczają pewnych wartości procentowych, toksyczność kostna związana z radioterapią jamy brzusznej lub miednicy i wynikające z niej złamania są rzeczywiście wyższe niż dobrze znane późne toksyczności stopnia III/IV. Podczas gdy ograniczenia dawki są dobrze zdefiniowane dla narządów znanych jako zagrożone i są wyznacznikiem ostatecznego zatwierdzenia planu, nie dotyczy to tkanki kostnej.
Nawet w najnowszej wersji Common Terminology Criteria for Adverse Events (CTCAE) Version 5.0 nie ma specyficznej definicji toksyczności kostnej wynikającej z napromieniania (24). W praktyce onkologii radiacyjnej nie ma kryteriów oceny toksyczności dla kości. Ani w tabelach punktacji późnej toksyczności LENT-SOMA, ani w raporcie Quantitative Analyses of Normal Tissue Effects in the Clinic (QUANTEC) kość nie została zdefiniowana jako narząd zagrożony, nie określono też ograniczeń dawki i objętości dla tej tkanki (25, 26). Poprzednie badania oraz nasze niedawno opublikowane badanie wykazały jednak, że osteoporoza i ryzyko złamań powinny być poważnie brane pod uwagę, a podczas obserwacji napromienianych pacjentów należy podjąć niezbędne środki ostrożności, aby zapobiec złamaniom związanym z napromienianiem (1-8).
DEXA jest metodą złotego standardu w ilościowym określaniu BMD i rutynowym badaniu przesiewowym w kierunku osteoporozy. Onkolodzy radiacyjni nie zamawiają DEXA dla swoich pacjentów, którzy otrzymują napromienianie miednicy lub jamy brzusznej. Nie konsultują tych pacjentów z endokrynologiem w celu oceny ryzyka złamań i obecności osteoporozy przed jakimkolwiek leczeniem napromienianiem. Jednak jako onkolodzy radioterapeuci możemy wykorzystać nasz system planowania w celu określenia BMD i ryzyka osteoporozy. Oceny te można łatwo przeprowadzić za pomocą tomografii komputerowej, zleconej w celu oceny zaawansowania choroby, planowania radioterapii i obserwacji pacjentów. Możemy określić obniżenie BMD, osteoporozę i niezauważone złamania poprzez pomiar wartości HU kości z tomografii komputerowej pacjentów zaimportowanych do systemu planowania oraz poprzez konstrukcję strzałkowych obrazów napromienianych obszarów kostnych.
Ostatnio sugerowano, że wartości HU kości pochodzące z tomografii komputerowej mogą być wykorzystane do identyfikacji pacjentów z obniżoną BMD i osteoporozą (19-22, 27-30). Pickhardt i wsp. (22) jasno określili, w jaki sposób można mierzyć wartości HU kości i stosować je jako alternatywę dla DEXA w celu ustalenia BMD i rozpoznania osteoporozy. W tych badaniach, podczas gdy wartości HU kości poniżej 100 są uważane za wskazujące na osteoporozę, wartości HU pomiędzy 100 a 160 są uważane za wskazujące na osteopenię, a wartości HU powyżej 160 świadczą o prawidłowej gęstości mineralnej kości (19-22). Pacjenci z wartościami HU powyżej 160 mają prawidłową gęstość kości, a zatem nie ma potrzeby wykonywania pomiaru DEXA i dbania o zdrowie kości. Pacjenci z wartościami HU pomiędzy 100 a 160 mogą być uważani za osteopenicznych i wymagają wczesnej interwencji w celu zapobiegania osteoporozie i ryzyku złamań w przyszłości. Pacjenci z wartościami HU poniżej 100 powinni być uważani za osteoporotycznych. Niskie wartości HU powinny ostrzegać onkologa radioterapeutę o ukrytym ryzyku złamań w obszarach kostnych, które będą narażone na promieniowanie. Pacjenci ci powinni być konsultowani z endokrynologiem przed rozpoczęciem radioterapii. W badaniach porównujących HUs z DEXA do oznaczania gęstości mineralnej kości i określania osteoporozy, u niektórych chorych zaliczanych do grupy bez osteoporozy na podstawie DEXA wykrywano złamania kręgów podczas oznaczania HUs na podstawie tomografii komputerowej (22, 29-31).
W naszym badaniu staraliśmy się znaleźć łatwy sposób dla onkologów radioterapeutów na rozpoznawanie osteoporozy i określanie ryzyka złamań. Jeśli wdrożymy te pomiary do codziennej rutyny podczas planowania radioterapii, będziemy mogli określić osteopenię, osteoporozę i ryzyko złamań u pacjentów, którzy otrzymają radioterapię jamy brzusznej lub miednicy i interweniować wcześnie, aby zapobiec późnej radiotoksyczności kości.
Podczas gdy nie było statystycznie istotnej różnicy w wartościach HU kręgów T12, L1, L2 uzyskanych na poziomie wyjściowym i 1 rok później w grupie kontrolnej, wartości HU zmniejszyły się znacząco u napromienianych pacjentów. Złamania kręgów stwierdzono tylko u chorych napromienianych. Czterech pacjentów z 57 miało złamania kręgów po medianie obserwacji wynoszącej 24 miesiące, z 7% skumulowaną częstością występowania złamań. Chociaż czas obserwacji był krótki, a większość złamań była bezobjawowa, w naszym poprzednim badaniu, przy dłuższym czasie obserwacji, odnotowaliśmy 9,6% częstość złamań, a większość z tych złamań była objawowa (8). Wysokie ryzyko złamań kości u tych pacjentów zasługuje na uwagę, a kość powinna być traktowana jako narząd zagrożony. Odnotowany czas do wystąpienia złamań po radioterapii wahał się od 2 do 63 miesięcy (2, 14). Co ciekawe, złamania jako późna toksyczność popromienna stopnia IV są obserwowane z większą częstością niż inne dobrze znane późne toksyczności popromienne, takie jak zwłóknienie popromienne, zapalenie pęcherza moczowego, zapalenie odbytnicy itp.
Zmniejszenie HU było zależne od dawki. Istniało większe ryzyko spadku wartości HU kości przy wyższych dawkach promieniowania otrzymywanych przez kręgi. Stwierdziliśmy jednak, że spadek wartości HU nie był znaczący dla trzonów kręgów, które były narażone na dawki promieniowania poniżej 20 Gy.
W literaturze istnieją sprzeczne ustalenia w zakresie dawki promieniowania, przy której obserwuje się utratę BMD. Podczas gdy w jednym z badań wykazano utratę BMD u pacjentów leczonych napromienianiem miednicy dawką 22,5 Gy, w innym badaniu nie wykazano korelacji między dawką promieniowania a ryzykiem złamań z powodu niewydolności (32, 33). Wei i wsp. (33) stwierdzili, że nawet dawka promieniowania 5 Gy na kręgi powoduje znaczną redukcję BMD i IF u chorych leczonych radioterapią jamy brzusznej. Zalecają oni również ograniczenie dawki promieniowania na trzony kręgów szczególnie u chorych z niskimi wartościami HU wykrytymi podczas planowania radioterapii. Należy więc określić limit dawki dla kręgów znajdujących się w polu napromieniania. Ograniczenia dawki mogą się różnić w zależności od wartości HU mierzonych podczas planowania radioterapii. Należy dążyć do zmniejszenia średnich dawek promieniowania dla kości kręgów znajdujących się w polu napromieniania, szczególnie u osób starszych i u pacjentów z już istniejącą osteoporozą.
Wnioski
Osteoporoza wywołana napromienianiem i wynikające z niej złamania niewydolności (IF) są bardzo częste. Obniżenie BMD, osteoporoza i niezauważone złamania mogą być wykryte przez pomiar wartości HU kości z tomografii komputerowej pacjentów importowanych do systemu planowania i przez rekonstrukcję obrazów strzałkowych napromienianych obszarów kostnych. U pacjentów z już niskimi wartościami HU kości wykrytymi podczas planowania radioterapii można wcześnie interweniować, aby przywrócić zdrowie kości i zapobiec przyszłym złamaniom związanym z promieniowaniem. Aby zapobiec toksyczności kostnej związanej z promieniowaniem, dawka promieniowania na kości kręgów z już niskimi wartościami HU w czasie planowania leczenia powinna być ograniczona poniżej 20 Gy.
Oświadczenie o dostępności danych
Materiały opisane w artykule, w tym wszystkie istotne surowe dane, mogą być swobodnie dostępne dla każdego naukowca pragnącego wykorzystać je do celów niekomercyjnych, bez naruszania poufności uczestników i można je uzyskać od odpowiedniego autora.
Oświadczenie o etyce
Nasze badanie zostało przeprowadzone zgodnie z Deklaracją Helsińską. Badanie zostało zatwierdzone przez komisję etyczną Szpitala Edukacyjno-Badawczego im. dr Lutfi Kirdar Kartal (2017/514/109/2). Uzyskano pisemną świadomą zgodę od wszystkich uczestników badania.
Wkład autorów
GY: gwarant integralności całego badania. GY i CG: koncepcja i projekt badania. NC: poszukiwanie literatury. GY, CG, IK, OS, i NC: badania kliniczne. GY: analiza statystyczna. OS: przygotowanie manuskryptu. CG: edycja manuskryptu. Wszyscy autorzy przeczytali i zatwierdzili ostateczną wersję manuskryptu.
Konflikt interesów
Autorzy oświadczają, że badania były prowadzone przy braku jakichkolwiek komercyjnych lub finansowych powiązań, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Materiały uzupełniające
Materiały uzupełniające do tego artykułu można znaleźć online pod adresem: https://www.frontiersin.org/articles/10.3389/fonc.2020.00742/full#supplementary-material
Skróty
IFs, Insufficiency fractures; DEXA, Dual energy x-ray absorptiometry; BMD, Bone mineral density; CT, Computerized tomography; HU, Hounsfield unit; Δ%HU, Percent change in HU; ROI, region zainteresowania; SPSS, pakiet statystyczny dla nauk społecznych; CTCAE, wspólne kryteria terminologiczne dla zdarzeń niepożądanych; QUANTEC, ilościowe analizy efektów tkanki normalnej w klinice.
1. Oh D, Huh SJ. Niewydolność złamań po radioterapii. Radiat Oncol J. (2014) 32:213-20. doi: 10.3857/roj.2014.32.4.213
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Higham CE, Faithfull SJ. Zdrowie kości i radioterapia miednicy. Clin Oncol. (2015) 11:668-78. doi: 10.1016/j.clon.2015..07.006
CrossRef Full Text | Google Scholar
3. Shih KK, Folkert MR, Kollmeier MA, Abu-Rustum NR, Sonoda Y, Leitao MM Jr, et al. Pelvic insufficiency fractures in patients with cervical and endometrial cancer treated with postoperative pelvic radiation. Gynecol Oncol. (2013) 128:540-3. doi: 10.1016/j.ygyno.2012.12.021
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Uezono H, Tsujino K, Moriki K, Nagano F, Ota Y, Sasaki R, et al. Pelvic insufficiency fracture after definitive radiotherapy for uterine cervical cancer: retrospective analysis of risk factors. J Radiat Res. (2013) 54:1102-9. doi: 10.1093/jrr/rrt055
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Igdem S, Alco G, Ercan T, Barlan M, Ganiyusufoglu K, Unalan B, et al. Złamania niewydolności po radioterapii miednicy u pacjentów z rakiem prostaty. Int J Radiat Oncol Biol Phys. (2010) 77:818-23. doi: 10.1016/j.ijrobp.2009.05.059
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Schmeler KM, Jhingram A, Iyer RB, Sun CC, Eifel PJ, Soliman PT, et al. Złamania miednicy po radioterapii z powodu raka szyjki macicy: implikacje dla osób, które przeżyły. Cancer. (2010) 116:625-30. doi: 10.1002/cncr.24811
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Kim HJ, Boland PJ, Meredith DS, Lis E, Zhang Z, Shi W, et al. Fractures of the sacrum after chemoradiation for rectal carcinoma: incidence, risk factors, and radiographic evaluation. Int J Radiat Oncol. (2012) 84:694-9. doi: 10.1016/j.ijrobp.2012.01.021
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Yaprak G, Gemici C, Temizkan S, Ozdemir S, Dogan BC, Seseogullari OO. Osteoporosis development and vertebral fractures after abdominal irradiation in patients with gastric cancer. BMC Cancer. (2018) 18:972. doi: 10.1186/s12885-018-4899-z
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Lustberg MB, Reinbolt RE, Shapiro CL. Bone health in adult cancer survivorship. J Clin Oncol. (2012) 30:3665-74. doi: 10.1200/JCO.2012.42.2097
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Coleman R, Body JJ, Aapro M, Hadji P, Herrstedt J, ESMO Guidelines Working Group. Bone health in cancer patients: ESMO clinical practice guidelines. Ann Oncol. (2014) 25:124-37. doi: 10.1093/annonc/mdu103
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Pfeilschifter J, Diel IJ. Osteoporoza spowodowana leczeniem przeciwnowotworowym: patogeneza i postępowanie. J Clin Oncol. (2000) 18:1570-93. doi: 10.1200/JCO.2000.18.7.1570
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Hadji P, Gnant M, Body JJ, Bundred NJ, Brufsky A, Coleman RE, et al. Cancer treatment-induced bone loss in premenopausal women: a need for therapeutic intervention? Cancer Treat Rev. (2012) 38:798-806. doi: 10.1016/j.ctrv.2012.02.008
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Skolarus TA, Caram MV, Shahinian VB. Androgen-deprivation-associated bone disease. Curr Opin Urol. (2014) 24:601-7. doi: 10.1097/MOU.000000000101
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Boehling NS, Grosshans DR, Allen PK, McAleer MF, Burton AW, Azeem S, et al. Vertebral compression fracture risk after stereotactic body radiotherapy for spinal metastases. J Neurosurg Spine. (2012) 16:379-86. doi: 10.3171/2011.11.SPINE116
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Cunha MV, Al-Omair A, Atenafu EG, Masucci GL, Letourneau D, Korol R, et al. Vertebral compression fracture (VCF) after spine stereotactic body radiation therapy (SBRT): analysis of predictive factors. Int J Radiat Oncol Biol Phys. (2012) 84:343-9. doi: 10.1016/j.ijrobp.2012.04.034
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Jawad MS, Fahim DK, Gerszten PC, Flickinger JC, Sahgal A, Grills IS, et al. Vertebral compression fractures after stereotactic body radiation therapy: a large, multi-institutional, multinational evaluation. J Neurosurg Spine. (2016) 24:928-36. doi: 10.3171/2015.10.SPINE141261
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Marshall D, Johnell O, Wedel H. Meta-analysis of how well measures of bone mineral density predicting occurrence of osteoporotic fractures. BMJ. (1996) 312:1254-9. doi: 10.1136/bmj.312.7041.1254
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Kanis JA, McCloskey EV, Johansson H, Oden A, Melton LJ 3rd, Khaltaev N. A reference standard for the description of osteoporosis. Bone. (2008) 42:467-75. doi: 10.1016/j.bone.2007.11.001
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Schreiber JJ, Anderson PA, Rosas HG, Buchholz AL, Au AG. Hounsfield units for assessing bone mineral density and strength: a tool for osteoporosis management. J Bone Joint Surg Am. (2011) 93:1057-63. doi: 10.2106/JBJS.J.00160
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Schreiber JJ, Anderson PA, Hsu WK. Zastosowanie tomografii komputerowej do oceny gęstości mineralnej kości. Neurosurg Focus. (2014) 37:E4. doi: 10.3171/2014.5.FOCUS1483
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Batawil N, Sabiq S. Hounsfield unit for the diagnosis of bone mineral density disease: a proof of concept study. Radiography. (2016) 22:93-8. doi: 10.1016/j.radi.2015.11.004
CrossRef Full Text | Google Scholar
22. Pickhardt PJ, Pooler BD, Lauder T, del Rio AM, Bruce RJ, Binkley N. Opportunistyczne badania przesiewowe w kierunku osteoporozy przy użyciu skanów tomografii komputerowej jamy brzusznej uzyskanych z innych wskazań. Ann Intern Med. (2013) 158:588-95. doi: 10.7326/0003-4819-158-8-201304160-00003
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Lenchik L, Shi R, Register TC, Beck SR, Beck SR, Langefeld CD, et al. Measurement of trabecular bone mineral density in the thoracic spine using cardiac gated quantitative computed tomography. J Comput Assist Tomogr. (2004) 28:134-9. doi: 10.1097/00004728-200401000-00023
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Common Terminology Criteria for Adverse Events (CTCAE). Wersja 5.0. U.S. Department of Health and Human Services, National Institutes of Health National Cancer Institute. Maryland (2017).
25. Overgaard J, Bartelink H. Late effects Consensus Conference: RTOG/EORTC. Radiother Oncol. (1995) 35:1-82. doi: 10.1016/0167-8140(95)01548-U
CrossRef Full Text | Google Scholar
26. Bentzen SM, Constine LS, Deasy JO, Eisbruch A, Jackson A, Marks LB. Quantitative analyses of normal tissue effect in the clinic (QUANTEC): an introduction to the scientific issues. Int J Radiat Oncol Biol. Phys. (2010) 76(3 Suppl):S3-S9. doi: 10.1016/j.ijrobp.2009.09.040
CrossRef Full Text | Google Scholar
27. Buckens CF, Dijkhuis G, de Keizer B, Verhaar HJ, de Jong PA. Opportunistic screening for osteoporosis on routine computed tomography? An external validation study. Eur Radiol. (2015) 25:2074-9. doi: 10.1007/s00330-014-3584-0
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Emohare O, Cagan A, Morgan R, Davis R, Asis M, Switzer J, et al. The use of computed tomography attenuation to evaluate osteoporosis following acute fractures of the thoracic and lumbar vertebra. Geriatr Orthop Surg Rehabil. (2014) 5:50-5. doi: 10.1177/2151458514525042
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Alacreu E, Moratal D, Arana E. Opportunistic screening for osteoporosis by routine CT in Southern Europe. Osteoporos Int. (2017) 28:983-90. doi: 10.1007/s00198-016-3804-3
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Lee S, Chung CK, Oh SH, Park SB. Correlation between bone mineral density measured by dual-energy X-ray absorptiometry and hounsfield units measured by diagnostic CT in lumbar spine. Korean Neurosurg Soc. (2013) 54:384-9. doi: 10.3340/jkns.2013.54.5.384
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Miyabara Y, Holmes D, Camp J, Miller VM, Kearns AE. Comparison of calibrated and uncalibrated bone mineral density by CT to DEXA in menopausal women. Climacteric. (2012) 15:374-81. doi: 10.3109/13697137.2011.618566
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Park SH, Kim JC, Lee JE, Park IK. Złamanie niewydolności miednicy po radioterapii u chorych na raka szyjki macicy w dobie PET/CT. Radiat Oncol J. (2011) 29:269-76. doi: 10.3857/roj.2011.29.4.269
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Wei RL, Jung BC, Manzano W, Sehgal V, Klempner SJ, Lee SP, et al. Bone mineral density loss in thoracic and lumbar vertebrae following radiation for abdominal cancers. Radiother Oncol. (2016) 118:430-6. doi: 10.1016/j.radonc.2016.03.002
PubMed Abstract | CrossRef Full Text | Google Scholar
.
Leave a Reply