Dlaczego #”HF „# ma niższą temperaturę wrzenia niż woda, mimo że #”F „# jest bardziej elektroujemny niż #”O „#?
Jest wiele skomplikowanych czynników. Oto, co udało mi się znaleźć:
- Woda może tworzyć bardziej zrównoważoną sieć wiązań wodorowych (dwa akceptory i dwa donory, zamiast jednego donora i trzech akceptorów), dzięki czemu system masowy jest bardziej równomiernie oddziałujący, a zatem silniejszy jako całość.
- Woda tworzy bardziej rozległą sieć wiązań wodorowych (trójwymiarowe tetraedryczne środowisko lokalne, a nie dwuwymiarowe środowisko zygzakowate), dzięki czemu system masowy jest mniej podatny na parowanie.
- Woda ogólnie ma bardziej optymalny kąt interakcji, ponieważ bardziej pasuje do geometrii elektronowej cząsteczki i wyrównuje oddziaływania wzdłuż dipola molekularnego, podczas gdy #”HF „# miałby silniejsze wiązania wodorowe (w kategoriach surowych liczb), gdyby oddziaływania były liniowe.
DISCLAIMER: DŁUGA ODPOWIEDŹ! Również bardzo wizualne.
Wiązanie wodorowe jest najsilniejszą siłą międzycząsteczkową zarówno w #”HF „# jak i #”H”_2 „O „#. Siła interakcji zależy od odległości interakcji, kąta interakcji i ekstensywności sieci.
Gdy wyciągniemy wszystkie oddziaływania wiązań wodorowych i założymy czystą wodę i czysty #”HF „#, otrzymamy (wyodrębniając wybrany zestaw cząsteczek z nieskończonej macierzy)#””^()##””^()#:
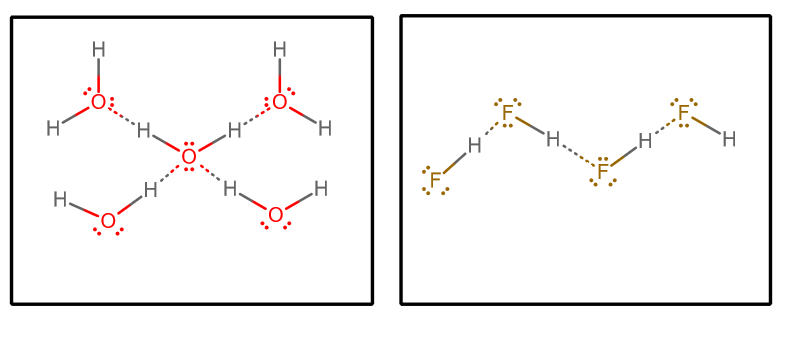
Możemy wtedy rozważyć kilka czynników:
- Liczba donorów i akceptorów wiązań wodorowych
Każda cząsteczka wody może zaakceptować dwa oddziaływania wiązania wodorowego (poprzez pary samotne) i oddać dwa oddziaływania wiązania wodorowego (poprzez hydrogeny).
Z drugiej strony, każda cząsteczka #”HF „# akceptuje trzy wiązania wodorowe (przez samotne pary) i oddaje tylko jedno (przez wodór).
Można by argumentować, że woda ma bardziej zrównoważoną sieć wiązań wodorowych, co sprawia, że system masowy jest mniej zdolny do ogólnego odparowania. To wspierałoby wyższą temperaturę wrzenia wody w stosunku do #”HF „#.
- Elektronegatywności #bb(„F”)# i #bb(„O”)#
#”F „# jest bardziej elektronegatywny, więc łatwiej utrzymuje swoją gęstość elektronową; dlatego oczekuje się, że samotne pary będą słabszymi donorami oddziaływań wiązania wodorowego niż samotne pary na #”O „#.
To wydaje się przewidywać, że każda indywidualna interakcja wiązania wodorowego jest słabsza, co wspierałoby wyższą temperaturę wrzenia wody ponad #”HF „#, ALE jest to sprzeczne z następującym punktem.
- Average raw hydrogen-bonding strengths in #bb(„HF”)# vs. woda
#”O”-„H „cdotcdotcdot: „O”-#, #DeltaH_(„H”-„wiązanie”) ~~ „21 kJ/mol „#
#”F”-„H „cdotcdot: „F”-#, #DeltaH_(„H”-„wiązanie”) ~~ „161.5 kJ/mol „#
Te dane z Wikipedii sugerują, że #”HF „# ma silniejsze oddziaływania wiązań wodorowych wśród cząsteczek #”HF „# niż w wodzie.
To nie wspierałoby eksperymentalnego dowodu, że #”HF „# ma znacznie niższą temperaturę wrzenia, ale to również jest tylko surowa liczba i nie uwzględnia, powiedzmy, kątów interakcji w systemie masowym.
- Obserwowane kąty wiązań wodorowych i wymiary oddziaływań
#”HF „#, będąc cząsteczką liniową, zaobserwowano, że ma zygzakowate oddziaływania wiązań wodorowych, w dwóch wymiarach, z kątami #116^@#. Bardziej optymalny kąt byłby na #180^@#, ponieważ dałoby to bardziej bezpośrednie interakcje dipolowe. To ogranicza siłę wiązania wodorowego #”HF „#.
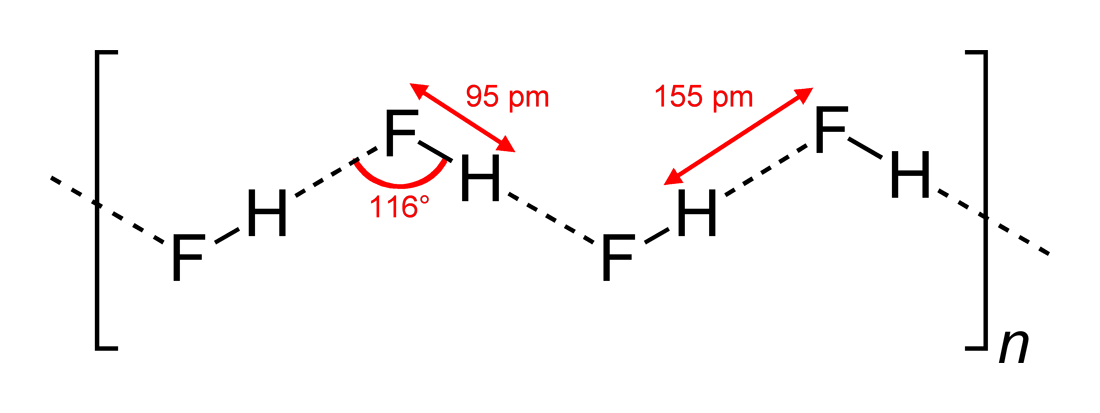
Woda, będąc cząsteczką wygiętą o tetraedrycznej geometrii elektronów, może wiązać wodór w trzech wymiarach.
Oto przykład tetraedrycznego klastra znalezionego w lokalnym środowisku interakcji wiązania wodorowego w wodzie:
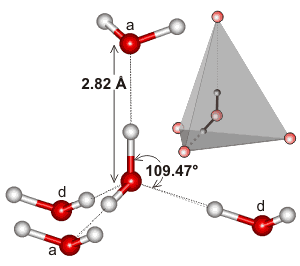
Może być tak, że ekstensywność sieci wiązania wodorowego i jak ma tendencję do dopasowania geometrii elektronowej wody, jest tym, co sprawia, że temperatura wrzenia wody jest tak wysoka. This would support the higher boiling point of water over #”HF „#.
Overall, these are the least-challenged factors I could think of:
- Water can make a more-balanced hydrogen-bonding network (two acceptors and two donors, instead of one donor and three acceptors), making the bulk system more uniformly interacting and thus stronger as a whole.
- Woda tworzy bardziej rozległą sieć wiązań wodorowych (trójwymiarowe tetraedryczne środowisko lokalne, a nie dwuwymiarowe środowisko zygzakowate), czyniąc system masowy mniej łatwym do odparowania.
- Woda ogólnie ma bardziej optymalny kąt oddziaływania, ponieważ bardziej pasuje do geometrii elektronowej cząsteczki i wyrównuje oddziaływania wzdłuż dipola molekularnego, podczas gdy #”HF „# miałby silniejsze wiązanie wodorowe (w kategoriach liczb surowych), gdyby oddziaływania były liniowe.
.
Leave a Reply