Czy poziom FT3 może ułatwić wykrycie zapalenia, katabolizmu i niedożywienia u pacjentów dializowanych? | Nefrologia
WPROWADZENIE
Zaburzenia czynności tarczycy występujące u pacjentów z eutyreozą i ciężkimi schorzeniami są związane z mniejszą przeżywalnością. Mówimy o zespole niskiego T3, aby opisać zmiany funkcji tarczycy, które dotyczą dużego odsetka populacji (do 75% hospitalizowanych pacjentów)1 i wiążą się z obniżeniem FT3, prawidłowym lub nieznacznie obniżonym poziomem wolnego T4 (FT4) i prawidłowym poziomem tyreotropiny (TSH). Zmiany te są interpretowane jako mechanizm adaptacyjny organizmu w obliczu choroby i występują, gdy dochodzi do zmniejszenia obwodowej konwersji T4 i FT3, bez obecności jakiejkolwiek choroby tarczycy. Opisano również dużą częstość występowania niskiego stężenia FT3 u pacjentów z przewlekłą chorobą nerek (CKD) bez chorób tarczycy w wywiadzie,2 a stężenie FT3 uznano za niezależny czynnik predykcyjny śmiertelności zarówno u pacjentów hemodializowanych (HD)3 , jak i dializowanych otrzewnowo (PD)4. Nie wiadomo, czy przyczyną obniżenia FT3 jest tylko fizjologiczny mechanizm adaptacyjny, który zmniejsza podstawową przemianę materii, gdy obecna jest choroba, czy też jest to zmiana związana z CKD lub dializoterapią, a jej korekta mogłaby przyczynić się do poprawy przeżywalności tych pacjentów. Poziom FT3 może być niski u pacjentów z CKD z powodu różnych mechanizmów, takich jak: 1) niedożywienie: Zmniejszenie spożycia pokarmu może prowadzić do zmniejszenia konwersji T4 do FT3 i ostatecznie do zmniejszenia wydatku energetycznego i zatrzymania katabolizmu białek; 2) stan zapalny: W CKD dochodzi do przewlekłego stanu zapalnego, który może być również związany ze spadkiem FT3 podczas dializy;4,5 3) niewydolność nerek per se: Jest to spowodowane nagromadzeniem toksyn mocznicowych, które zmieniają funkcję tarczycy, takich jak kwasica metaboliczna lub zmniejszenie wydalania jodu; lub zmiany związane z technikami dializy, takimi jak stosowanie heparyny podczas HD lub niewielkie straty T4 lub T3 w wypływie otrzewnowym.2 Dlatego zmniejszona czynność tarczycy u pacjentów dializowanych może być markerem niedożywienia-zapalenia lub być wtórna do przewlekłej niewydolności nerek lub konkretnej techniki dializy.
Głównym celem tego badania była ocena częstości występowania zespołu niskiej T3 u stabilnych pacjentów poddawanych dializie (HD i PD) i jego związku z różnymi markerami niedożywienia i zapalenia.
MATERIAŁ I METODA
Jest to badanie opisowe, przekrojowe, obejmujące pacjentów przewlekle dializowanych (32 w HD i 11 w PD) w Szpitalu Ogólnym w Segowii w miesiącu kwietniu 2008 roku. Wszyscy pacjenci byli przewlekle dializowani przez co najmniej 3 miesiące i byli stabilni z klinicznego punktu widzenia. „Stabilność” definiowano jako brak hospitalizacji, współistniejących infekcji lub chorób odnotowanych w ciągu miesiąca poprzedzającego badanie. Jedenastu pacjentów zostało później wykluczonych z badania: Czterech z powodu wcześniej rozpoznanej choroby tarczycy i siedmiu, którzy przyjmowali leki mogące wpływać na czynność tarczycy.
TSH, FT4 i FT3 w przekroju mierzono metodą immunoanalizy opartej na elektrochemiluminescencji (ECLIA), przy użyciu analizatora E170 (Roche Diagnostics, Mannheim, Niemcy). Czułość dla testów TSH, FT4 i FT3 wynosiła odpowiednio 0,005mcU/l, 0,3pmol/l i 0,4pmol/l. Wartości referencyjne wynosiły: TSH 0,4-5mcU/l, FT4 11-23pmol/l i FT3 3,9-6,8pmol/l. W celu wykluczenia chorób autoimmunologicznych oznaczono przeciwciała przeciwtarczycowe (anty-TPO i anty-TG) za pomocą testu immunoabsorpcyjnego (Aeskulisa Aesku Diagnostics, Niemcy) (wartości powyżej 150U/ml dla anty-TPO lub 50U/ml dla TG uznawano za dodatnie). Równocześnie badano parametry biochemiczne i hematologiczne związane z odżywianiem i stanem zapalnym: albuminy, prealbuminy, transferynę, cholesterol, hematokryt, kreatyninę, pH, wodorowęglany i białko C-reaktywne (CRP), stosując rutynowe metody laboratoryjne obowiązujące w naszym szpitalu. Poziom hormonu wzrostu (GH) i insulinopodobnego czynnika wzrostu (IGF-1) oznaczono również metodą radioimmunologiczną w laboratorium referencyjnym. Wartości wyrażono w ng/ml. Badania przeprowadzono przed pierwszą sesją dializy w tygodniu; pacjenci, którzy mieli być poddani dializie po południu, zostali poinstruowani, aby pościć przez co najmniej cztery godziny wcześniej.
Średnie spożycie kalorii i dzienne spożycie białka ustalono za pomocą trzydniowej ankiety żywieniowej (program Dietsource 3.0 NovartisÆ) i skorygowano zgodnie z idealną wagą pacjenta. Odnotowywano procentowy udział lipidów i węglowodanów, a także spożycie sodu, potasu i fosforu.
Stan odżywienia pacjenta oceniano za pomocą pomiarów antropometrycznych, które przeprowadzono w połowie tygodnia po dializie przy użyciu standardowych technik6 i obejmowały: wzrost, masę ciała, wskaźnik masy ciała (BMI), triceps skinfold (TSF), obwód ramienia (AC) i obwód mięśni ramienia (AMC). Wyniki zostały znormalizowane przez obliczenie procentu dla każdego przypadku w stosunku do 50 percentyla danych uzyskanych z populacji normalnych hiszpańskich dorosłych w tym samym wieku i płci,7,8 uznając za umiarkowanie-ciężkie deficyty te przypadki, które były powyżej 80% normalnej populacji.
W celu uzyskania dokładniejszej oceny stanu odżywienia i składu ciała, w połowie tygodnia po dializie przeprowadzono analizę wektorową bioimpedancji (BIVA) (Vectorial BIA 101; Akern, Florencia, Włochy), która mierzyła opór (R), reaktancję (Xc), kąt fazowy (PA), wymianę sodowo-potasową (I Na/K), całkowitą wodę w organizmie (TBW), wodę zewnątrzkomórkową (ECW), wodę wewnątrzkomórkową (ICW), masę komórkową, wskaźnik masy komórkowej (masa komórkowa/wysokość2) (BCMI), masę tłuszczową (FM), masę beztłuszczową (FFM) i masę mięśniową. Dane te porównywano z wartościami osób zdrowych w tym samym wieku i o tej samej masie ciała.9
Zachorowalność oceniano za pomocą wskaźnika Charlsona, zmodyfikowanego przez Beddhu.10 Dawkę dializacyjną mierzono, obliczając KT/V, a spożycie białka szacowano na podstawie znormalizowanego wskaźnika katabolizmu białka dla aktualnej masy ciała (nPCR).
Analiza statystyczna
Analizę statystyczną przeprowadzono za pomocą pakietu oprogramowania SPSS, wersja 11.0 dla Windows. Wartości wyrażono jako procenty lub średnie ± SD; wartość p
WYNIKI
Charakterystykę kliniczną 32 pacjentów przedstawiono w tabeli 1. Średnia KT/V w HD wynosiła1,6 ± 0,27, a w PD średnia tygodniowa KT/V wynosiła 2,07 ± 0,27.
Średnie wartości hormonów tarczycy przedstawiały się następująco: TSH 2,2 ± 1,5 mcU/ml, FT4 14,7 ± 2,3pmol/l i FT3 4,0 ± 0,71pmol/l. Tylko dwóch pacjentów (6,3%) prezentowało niskie wartości FT4, a dwóch podwyższone TSH, natomiast 17 pacjentów (53,1%) prezentowało niskie poziomy FT3. Nie stwierdzono korelacji pomiędzy stężeniami FT3, FT4 i TSH. U żadnego pacjenta nie stwierdzono obecności przeciwciał przeciwtarczycowych. Nie stwierdzono istotnych różnic między poziomami FT3 w zależności od płci (4,2 ± 0,7 u mężczyzn vs. 3,8 ± 0,6 u kobiet; ns); poziomy FT3 były istotnie wyższe w PD niż w HD (4,5 ± 0,4 vs. 3,8 ± 0,7; p = 0,016). Nie stwierdzono różnic w stężeniach FT3 w zależności od rodzaju dializy. U chorych z PD stwierdzono natomiast wyższe stężenie TSH (3,5 ± 1,3 vs. 1,7 ± 1,3mcU/ml; p = 0,002), a BMI był również wyższy u chorych z PD (30,6 ± 3,3 vs. 24,8 ± 4,4; p = 0,002) w porównaniu z chorymi z HD.
W celu ustalenia, z czym wiązał się spadek FT3 u dializowanych, porównaliśmy dane kliniczne, socjodemograficzne, analityczne, antropometryczne i BIVA pacjentów z niskim FT3 z wartościami prawidłowymi uzyskanymi w naszym laboratorium (
DISCUSSION
Ostatnio, niski poziom FT32-4, który nie jest spowodowany chorobą tarczycy, ale jest wynikiem pogorszenia obwodowej konwersji FT4 do FT3, został opisany u dużego odsetka pacjentów dializowanych. Zjawisko to może być porównywalne z innymi opisywanymi w przypadku różnych chorób przewlekłych lub ostrych,1 i jest znane jako zespół chorej eutyreozy lub zespół niskiego T3. CKD różni się jednak od pozostałych przypadków zespołu chorej eutyreozy, ponieważ nie towarzyszy mu wzrost stężenia odwrotnej T3 (rT3).11 Dzieje się tak dlatego, że mimo iż klirens rT3 u chorych na nerki jest niższy, wydaje się, że dochodzi do redystrybucji rT3 z przestrzeni naczyniowej do pozanaczyniowej i wzrostu wychwytu komórkowego rT3.
Nasze dane potwierdzają wysoką częstość występowania pacjentów z niskimi poziomami FT3 (53%) poddawanych dializie i bez żadnej znanej choroby tarczycy, co prawdopodobnie wynika z niedoboru obwodowej konwersji T4 i FT3, biorąc pod uwagę, że poziomy FT3 nie korelowały z poziomami FT4 lub TSH. Sugerowano, że akumulacja toksyn mocznicowych lub kwasica metaboliczna może przyczynić się do spadku FT3.12 Nie znaleźliśmy związku między poziomami pH i wodorowęglanów a poziomami FT3. Nie znaleźliśmy również korelacji z dawką dializy mierzoną za pomocą KT/V lub z czasem, jaki pacjenci spędzili w dializie. Warto wziąć pod uwagę, że generalnie dawki dializ u naszych pacjentów były wysokie (średnia KT/V pacjentów HD wynosiła 1,6 ± 0,27, a średnia tygodniowa KT/V w PD wynosiła 2,07 ± 0,27), a kwasica była korygowana stosunkowo dobrze (pH 7,34 ± 0,6, a wodorowęglany 22,7 ± 2,8). W odniesieniu do rodzaju dializy stwierdzono, że pacjenci dializowani w PD mieli wyższe poziomy FT3, co nieco przeczy oczekiwanym wynikom, biorąc pod uwagę, że w PD można spodziewać się większych strat T4 i T3 w wypływie.13 Wykazano jednak również, że straty te są minimalne: Mniej niż 10μg T4 i mniej niż 0,1μg T3 na dobę, co stanowi odpowiednio mniej niż 10% i 1% w odniesieniu do szybkości produkcji T4 i T3. W rezultacie, nasze wyniki potwierdzają, że brak konwersji obwodowej jako odpowiedź na niedożywienie jest znacznie ważniejszy niż utrata otrzewnowa, a w przypadku tego badania pacjenci z PD odnotowali lepsze wyniki żywieniowe, w tym wyższy BMI. Zgadzamy się z ustaleniami innych autorów i uważamy, że spadek FT3 u pacjentów dializowanych jest głównie odpowiedzią adaptacyjną organizmu na chorobę, mającą na celu zmniejszenie metabolizmu podstawowego i uniknięcie katabolizmu.2 W przypadku chorób przewlekłych czasami trudno jest ustalić, czy spadek FT3 jest spowodowany aktywnością choroby, czy niedożywieniem związanym z aktywnością choroby. Na czynność tarczycy wpływa nie tylko post, ale także skład diety, dlatego zmniejszenie spożycia węglowodanów powoduje większe obniżenie FT3 niż zmniejszenie spożycia białka. Niedostateczne spożycie kalorii, nawet przy odpowiednim spożyciu białka, może powodować „zespół chorej eutyreozy”.14 Nie stwierdzono korelacji między poziomem FT3 a całkowitym spożyciem kalorii (kcal/dzień) lub skorygowanym spożyciem kalorii zgodnie z idealną lub rzeczywistą wagą. Nie znaleźliśmy również różnic w składzie diety między pacjentami z prawidłowym i obniżonym FT3 i z tego powodu niechętnie popieramy hipotezę, że spadek FT3 u pacjentów dializowanych jest spowodowany niewystarczającym spożyciem. Stwierdzono jednak związek między poziomem FT3 a niektórymi biochemicznymi i antropometrycznymi parametrami niedożywienia, takimi jak: prealbumina, transferyna, BMI, AC, AMC czy masa mięśniowa mierzona metodą bioimpedancji. Wydaje się więc, że poziom FT3 jest związany z niedożywieniem, ale nie z brakiem spożycia kalorii. Ponadto stwierdzono odwrotną korelację z poziomem CRP. Podczas infekcji lub sepsy dochodzi do obniżenia stężenia hormonów tarczycy na drodze różnych mechanizmów, jednak zasadniczo dzieje się tak z powodu zmniejszenia obwodowej konwersji FT4 do T3. Zmniejszenie stężenia hormonów tarczycy jest związane z ciężkością procesu15 i wydaje się, że przynajmniej częściowo jest mediowane przez cytokiny.16,17 Przewlekły stan zapalny występujący w CKF wydaje się być również związany z obniżeniem FT3 w HD.4,5 W badaniach Zocalli i wsp. stwierdzono obniżenie stężenia FT3 u obu typów pacjentów dializowanych w porównaniu z osobami zdrowymi; wskazują oni również, że stężenie FT3 koreluje odwrotnie ze stężeniem interleukiny 6 i CRP. Należy również brać pod uwagę możliwość, że spadek FT3 jest wynikiem choroby lub wieku, który wiąże się z obniżeniem wyjściowego metabolizmu energetycznego, jednak w naszym badaniu nie stwierdzono korelacji między FT3 a wiekiem i ogólnie chorobami współistniejącymi, natomiast istniała korelacja z parametrami stanu zapalnego.
Ostatnio International Society of Renal Nutrition and Metabolism (ISRNM)18 zaproponowało zastąpienie terminu „niedożywienie” terminem „białkowo-energetyczne marnotrawstwo” (protein-energy wasting, PEW), aby zdefiniować tę sytuację dotyczącą pacjentów dializowanych, Biorąc pod uwagę, że „niedożywienie” w najściślejszym znaczeniu tego słowa oznacza „niewystarczające spożycie”, a sytuacja, która jest często obserwowana u tych pacjentów, to zmieniony metabolizm (nadmierny metabolizm lub brak anabolizmu), promowany przez cytokiny zapalne, co prowadzi do utraty białka lub zapasów energii. Uważamy, że spadek FT3 jest mechanizmem adaptacyjnym organizmu broniącym się przed utratą białka, która nie jest spowodowana brakiem spożycia, ale raczej stanem zapalnym lub brakiem substancji anabolizujących, które są związane z CKF. Biorąc to pod uwagę, wyniki badania przeprowadzonego przez Lim i wsp.2 są interesujące, ponieważ chociaż dawki FT3 podawane osobom zdrowym nie zmieniały bilansu białkowego, u pacjentów z HD z niskim poziomem FT3 obserwowano zwiększony katabolizm. Dane te sugerują, że pacjenci, u których dochodzi do zmniejszenia obwodowej konwersji T4 do FT3, bronią się przed sytuacją kataboliczną i że T3 pogorszyłoby niedożywienie białkowe poprzez zwiększenie katabolizmu.
Obecnie nadal nie ma wiarygodnego markera masy mięśniowej i katabolizmu białek u pacjentów dializowanych, biorąc pod uwagę, że na wytwarzanie kreatyniny lub mocznika w surowicy może wpływać dawka dializy. Zgodnie z zaleceniami ISRNM,18 utrata masy mięśniowej powinna być włączona do kryteriów PEW, ponieważ może mieć duże znaczenie zarówno kliniczne, jak i prognostyczne. Biorąc pod uwagę dobrą korelację stwierdzoną w naszym badaniu między poziomem FT3 a masą mięśniową, a także uwzględniając fakt, że FT3 prawdopodobnie szybko zmienia się w chorobach katabolicznych, sugerujemy, że poziom FT3 powinien być stosowany jako wczesny wskaźnik katabolizmu i jako marker do pomiaru odpowiedzi na niektóre terapie, które mają na celu leczenie tego, na przykład, aby ocenić odpowiedź na suplementy diety lub substancje anabolizujące.
Podsumowanie
Połowa naszych pacjentów dializowanych prezentowała obniżone poziomy FT3 w surowicy bez zmienionego TSH lub FT4 (zespół niskiego FT3). Obniżenie to wydaje się być spowodowane upośledzoną obwodową konwersją FT4 do FT3. Poziomy te zasadniczo korelują z parametrami niedożywienia i zapalenia i mogą być uważane za wczesny marker katabolizmu lub PEW.
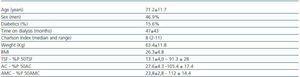
Tabela 1. Charakterystyka socjodemograficzna i antropometryczna
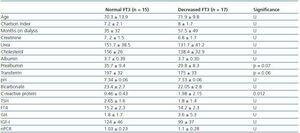
Tabela 2. Różnice socjodemograficzne i analityczne między pacjentami z prawidłowym FT3 (>3,95) a pacjentami z obniżonym FT3
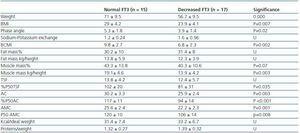
Tabela 3. Różnice antropometryczne i BIVA między pacjentami z prawidłowym FT3 (> 3,95) a pacjentami z obniżonym FT3
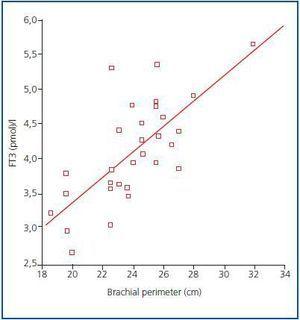
Rycina 1.
Leave a Reply