Co to jest elektronegatywność?
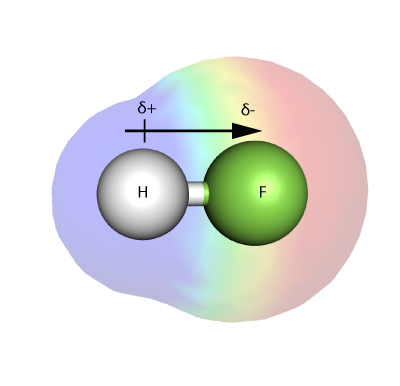
ELEKTRONEGATYWNOŚĆ
Elektronegatywność jest miarą tego, jak silnie atom – w cząsteczce – jest w stanie przyciągnąć do siebie elektrony w wiązaniu.
Faktory wpływające na elektronegatywność:
1) Liczba atomowa
Liczba atomowa to liczba protonów w jądrze atomu.
Określa ona właściwości chemiczne pierwiastka i jego miejsce w układzie okresowym.
Im wyższa liczba atomowa, tym silniejsza elektronegatywność.
2) Promień atomowy
Promień atomowy pierwiastka chemicznego jest zwykle mierzony odległością od środka jądra do granicy najbardziej zewnętrznej warstwy elektronów.
Im większy promień atomowy, tym słabsza elektroujemność.
Przykładowy promień atomowy atomu tlenu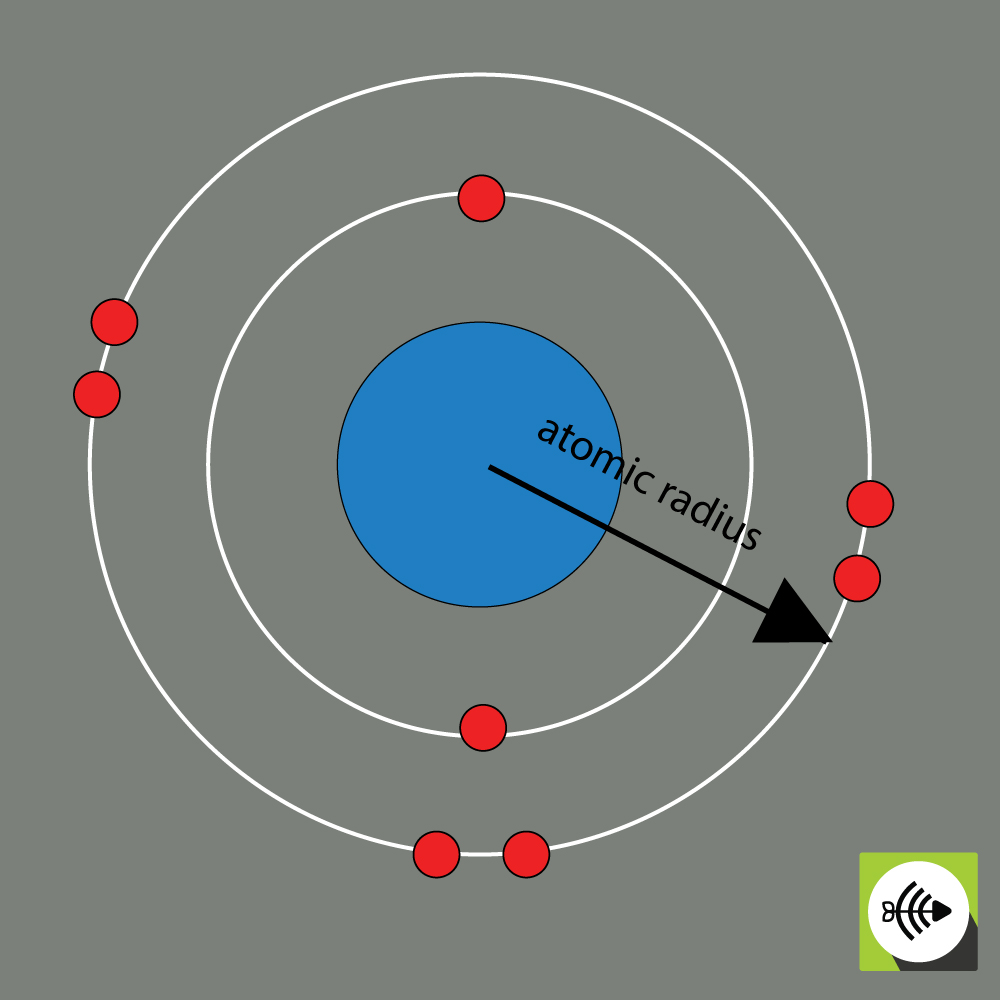
W czym mierzy się elektroujemność?
Najczęściej stosowaną miarą elektroujemności jest skala Paulinga, zaprojektowana przez dwukrotnego laureata nagrody Nobla Linusa Paulinga. Electronegativity skali dla elementów powiedzieć, jak silny każdy element (w stosunku do siebie) może przyciągnąć elektrony wiązania do siebie. Im wyższa liczba elektronegatywności, tym bardziej atom będzie próbował przyciągnąć elektrony do siebie.
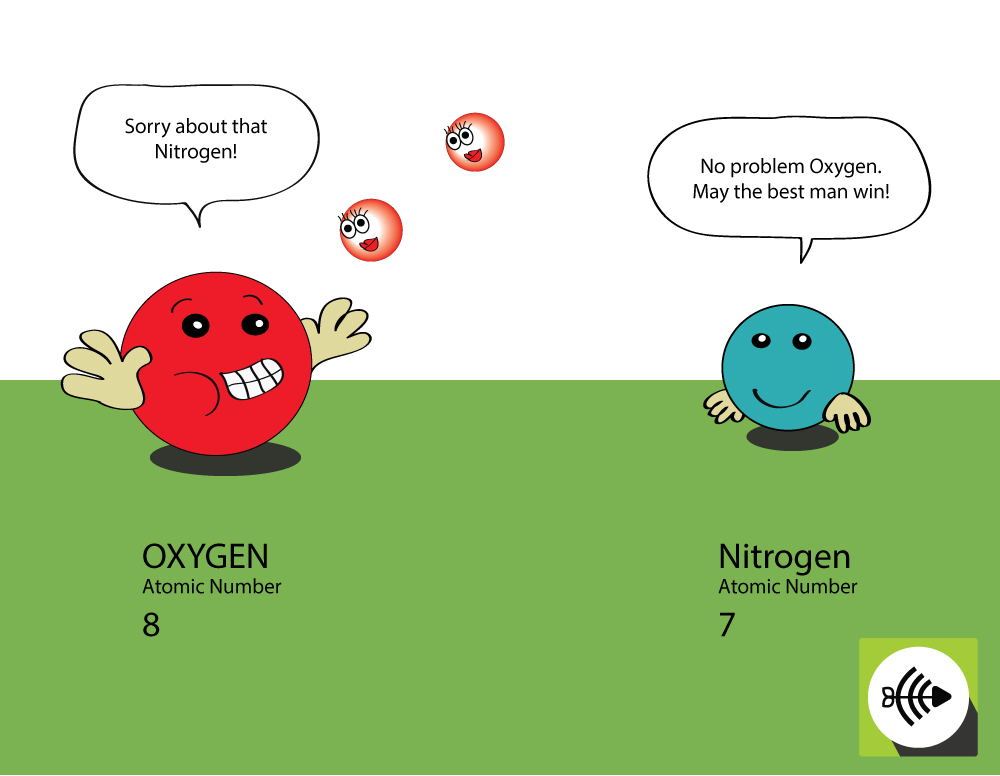
Dlaczego tlen jest bardziej elektronegatywny niż azot?
Tlen ma wyższą liczbę atomową
- Tlen ma 8 protonów w jądrze, podczas gdy azot ma tylko 7.
- Wiązanie pary elektronów będzie doświadczać większego przyciągania z jądra tlenu niż z jądra azotu, dlatego elektronegatywność tlenu jest większa.
Dlaczego siarka jest mniej elektronegatywna niż tlen?
Przyczyny, dla których tlen jest bardziej elektroujemny niż siarka:
- Tlen ma 2 poziomy energetyczne, siarka ma 3
- Elektrony wiążące w siarce są dalej od jądra atomu
- Gdy elektrony wiążące są dalej od jądra atomu, jest mniejsze przyciąganie od jądra
- Wiązanie pary elektronów w tlenie doświadczy większego przyciągania od jego jądra niż wiązanie elektronów siarki
- Więc tlen jest bardziej elektronegatywnym atomem
Proszę przeczytać o elektronach walencyjnych zanim przejdziesz dalej. Elektrony walencyjne

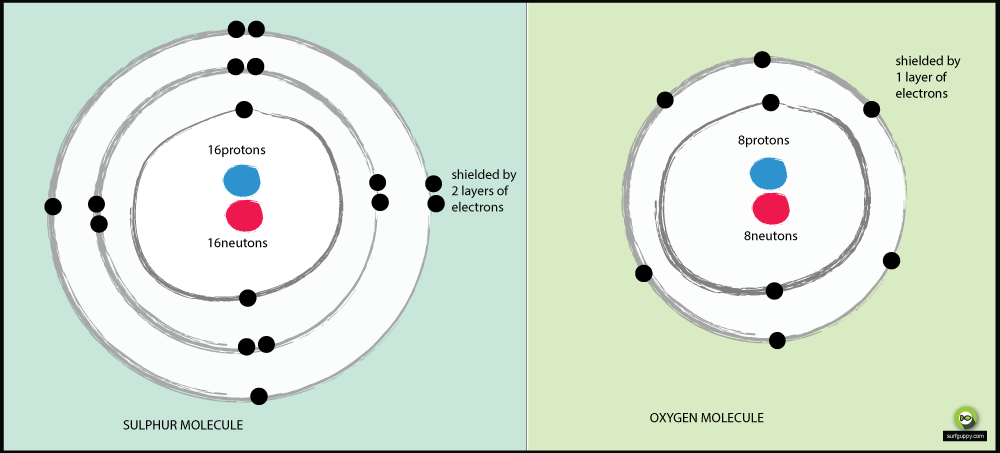
Mniejszy atom ma większą elektroujemność
Tendencje w zakresie elektroujemności obecne w układzie okresowym
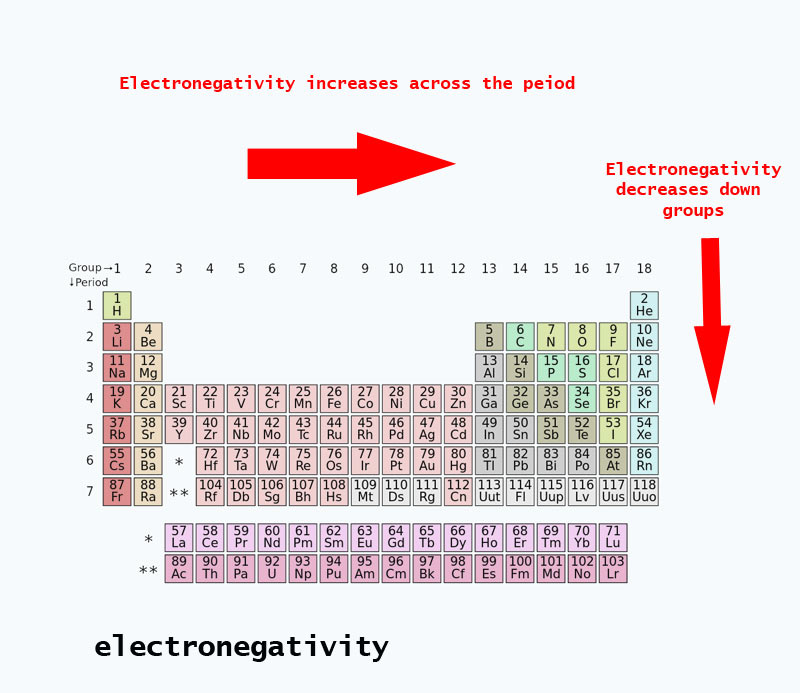
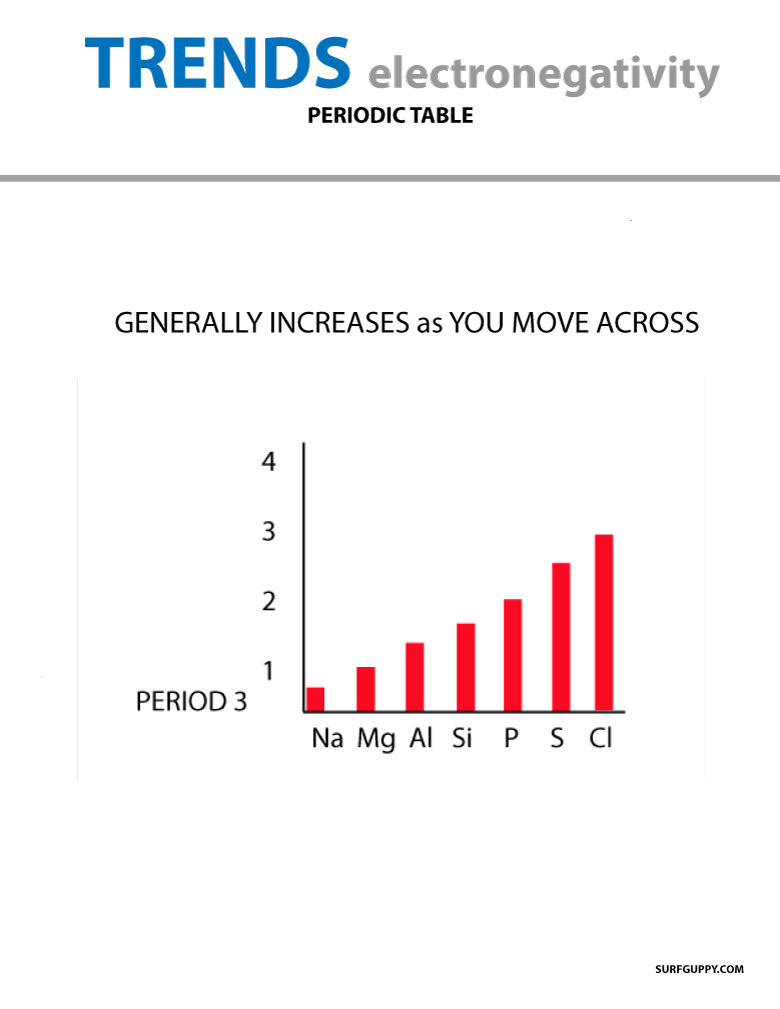
Podczas poruszania się po układzie okresowym liczba protonów w jądrze wzrasta (bez wzrostu poziomu energetycznego), dlatego też wzrasta elektroujemność.
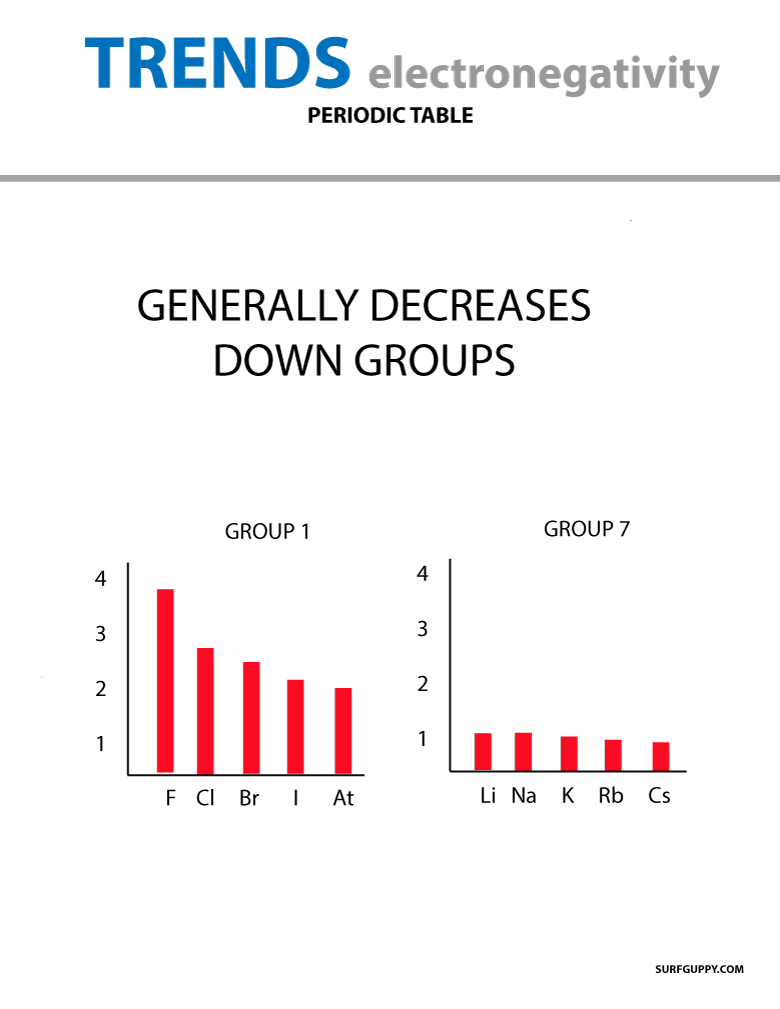
Gdy liczba atomowa wzrasta w dół grupy, wzrasta również poziom energii. Promień atomowy jest większy, dlatego zmniejsza się elektronoegatywność.
PERIODYCZNA TABLICA ELEKTRONEGATYWNOŚCI
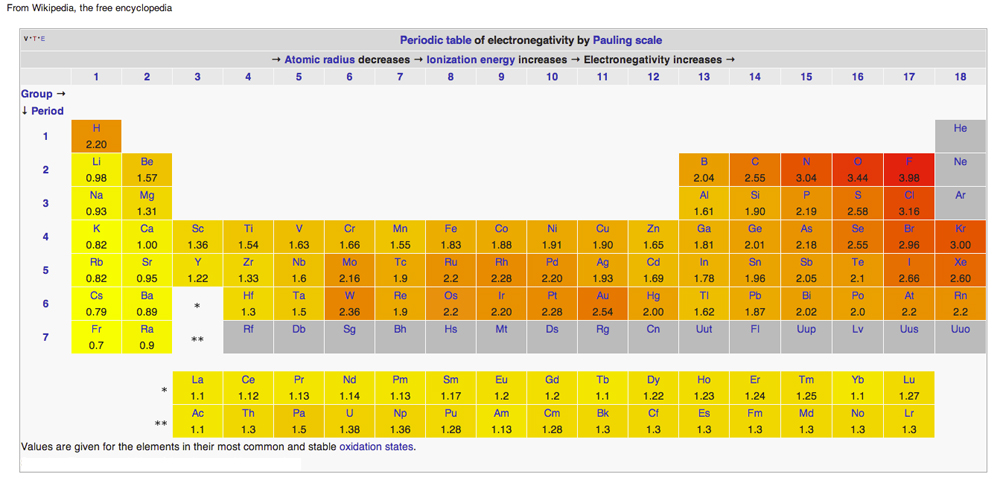 Diagram z Wikipedii wydany na licencji Creative Common Licenses
Diagram z Wikipedii wydany na licencji Creative Common Licenses
.
Leave a Reply