8.3: Gazy i ciśnienie
Cele nauczania
- Opisać fazę gazową.
Faza gazowa jest wyjątkowa wśród trzech stanów materii w tym, że istnieją pewne proste modele, które możemy wykorzystać do przewidywania zachowania fizycznego wszystkich gazów-niezależnie od ich tożsamości. Nie możemy tego zrobić dla stanów stałych i ciekłych. W rzeczywistości, rozwój zrozumienia zachowania gazów stanowi historyczny punkt podziału pomiędzy alchemią a nowoczesną chemią. Początkowe postępy w zrozumieniu zachowania gazów zostały dokonane w połowie 1600 roku przez Roberta Boyle’a, angielskiego naukowca, który założył Royal Society (jedną z najstarszych na świecie organizacji naukowych).
Jak to jest, że możemy modelować wszystkie gazy niezależnie od ich tożsamości chemicznej? Odpowiedź znajduje się w grupie twierdzeń zwanych kinetyczną teorią gazów:
- Gazy składają się z maleńkich cząsteczek, które są oddzielone od siebie dużymi odległościami.
- Cząsteczki gazu są w ciągłym ruchu, doświadczając zderzeń z innymi cząsteczkami gazu i ściankami ich pojemnika.
- Prędkość cząsteczek gazu jest związana z temperaturą gazu.
- Cząsteczki gazu nie doświadczają żadnej siły przyciągania ani odpychania między sobą.
Czy zauważyłeś, że żadne z tych stwierdzeń nie odnosi się do tożsamości gazu? Oznacza to, że wszystkie gazy powinny zachowywać się podobnie. Gaz, który jest idealnie zgodny z tymi stwierdzeniami nazywamy gazem idealnym. Większość gazów wykazuje niewielkie odchylenia od tych stwierdzeń i nazywa się je gazami rzeczywistymi. Istnienie gazów rzeczywistych nie umniejsza jednak znaczenia kinetycznej teorii gazów.
Jedno z twierdzeń teorii kinetycznej wspomina o zderzeniach. Ponieważ cząsteczki gazu są w ciągłym ruchu, stale zderzają się ze sobą i ze ściankami pojemnika, w którym się znajdują. Ponieważ cząsteczki gazu odbijają się od ścianek pojemnika, działają na nie siły (rysunek). Siła generowana przez cząsteczki gazu podzielona przez powierzchnię ścianek pojemnika daje ciśnienie. Ciśnienie jest właściwością, którą możemy zmierzyć dla gazu, ale zazwyczaj nie bierzemy pod uwagę ciśnienia dla ciał stałych lub cieczy.
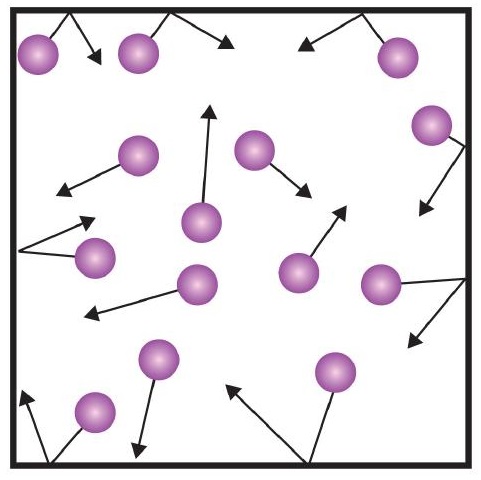
Podstawową jednostką ciśnienia jest niuton na metr kwadratowy (N/m2). Ta połączona jednostka jest ponownie zdefiniowana jako paskal (Pa). Jeden paskal nie jest bardzo dużą wartością ciśnienia. Bardziej użyteczną jednostką ciśnienia jest bar, który wynosi 100 000 Pa (1 bar = 100 000 Pa). Inne popularne jednostki ciśnienia to atmosfera (atm), która została pierwotnie zdefiniowana jako średnie ciśnienie atmosfery ziemskiej na poziomie morza oraz mmHg (milimetry rtęci), czyli ciśnienie wytwarzane przez słup rtęci o wysokości 1 mm. Jednostka milimetrów rtęci jest również nazywana torr, nazwana na cześć włoskiego naukowca Evangelisty Torricelli, który wynalazł barometr w połowie 1600 roku. Bardziej precyzyjna definicja atmosfery, w przeliczeniu na torr, mówi, że w 1 atm jest dokładnie 760 torr. Jeden bar równa się 1,01325 atm. Biorąc pod uwagę wszystkie zależności między tymi jednostkami ciśnienia, umiejętność konwersji z jednej jednostki ciśnienia na inną jest przydatną umiejętnością.
Przykład: Przeliczanie ciśnień
Zapisz współczynnik przeliczeniowy, aby określić, ile atmosfer mieści się w 1,547 mmHg.
Rozwiązanie
Ponieważ 1 mmHg równa się 1 torr, podane ciśnienie jest również równe 1,547 torr. Ponieważ w 1 atm jest 760 torr, możemy użyć tego współczynnika konwersji do przeprowadzenia matematycznej konwersji:
(∗mathrm{1,547: torr} razy ∗dfrac{1: atm}{760: torr}=2.04: atm}})
Zauważ jak jednostki torr anulują się algebraicznie.
Ćwiczenie \(\PageIndex{1}}): Chociaż wiemy, że w rzeczywistości w gazach występują oddziaływania międzycząsteczkowe, teoria kinetyczna zakłada, że cząsteczki gazu są od siebie tak oddalone, że poszczególne cząsteczki nie „czują” siebie nawzajem. Dlatego możemy traktować cząsteczki gazu jako maleńkie kawałki materii, których tożsamość nie jest ważna dla pewnych właściwości fizycznych.
Ćwiczenie sprawdzające pojęcia
-
Co to jest ciśnienie i jakich jednostek używamy do jego wyrażania?
Odpowiedź
-
Ciśnienie to siła przypadająca na jednostkę powierzchni; jego jednostkami mogą być paskal, torr, milimetr rtęci lub atmosfera.
Key Takeaway
- Faza gazowa ma pewne ogólne właściwości charakterystyczne dla tej fazy.
Ćwiczenia
-
Co to jest kinetyczna teoria gazów?
-
Zgodnie z kinetyczną teorią gazów, poszczególne cząsteczki gazu są (zawsze, często, nigdy) w ruchu.
-
Dlaczego gaz wywiera ciśnienie?
-
Dlaczego kinetyczna teoria gazów pozwala nam przypuszczać, że wszystkie gazy będą wykazywać podobne zachowanie?
-
Uszereguj następujące wielkości ciśnienia w kolejności od najmniejszej do największej: 1 mmHg, 1 Pa i 1 atm.
-
Która jednostka ciśnienia jest większa- torr czy atmosfera?
-
Ile torr jest w 1.56 atm?
-
Przelicz 760 torr na paskale.
-
Ciśnienie krwi jest wyrażane w milimetrach rtęci. Jakie będzie ciśnienie krwi w atmosferach, jeśli skurczowe ciśnienie krwi u pacjenta wynosi 120 mmHg, a rozkurczowe ciśnienie krwi 82 mmHg? (W medycynie takie ciśnienie krwi byłoby podawane jako „120/82”, czyli „sto dwadzieścia na osiemdziesiąt dwa”.)
-
W prognozowaniu pogody ciśnienie barometryczne jest wyrażane w calach rtęci (in. Hg), gdzie na każdy 1 cal Hg przypada dokładnie 25,4 mmHg. Jakie jest ciśnienie barometryczne w milimetrach rtęci, jeśli ciśnienie barometryczne jest podawane jako 30,21 cali Hg?
Odpowiedzi
-
Gazy składają się z maleńkich cząsteczek, które są oddzielone od siebie dużymi odległościami. Cząsteczki gazu są w ciągłym ruchu, doświadczając zderzeń z innymi cząsteczkami gazu i ściankami swojego zbiornika. Prędkość cząsteczek gazu jest związana z jego temperaturą. Cząsteczki gazu nie doświadczają żadnej siły przyciągania ani odpychania między sobą.
-
Gaz wywiera ciśnienie, ponieważ jego cząsteczki odbijają się od ścian swojego pojemnika.
-
1 Pa, 1 mmHg i 1 atm
-
1,190 torr
9. 0,158 atm; 0,108 atm
10. 767,3 mm Hg
.
Leave a Reply