Pharmakologie von unfraktioniertem Heparin
Dieses Medikament ist ein Grundbestandteil der Antikoagulation auf der Intensivstation, und man tut gut daran, sich mit seinen Eigenschaften vertraut zu machen.
Chemische Eigenschaften und Molekularstruktur
Heparin ist ein heterogenes Gemisch von Mucopolysacchariden, die als Glykosaminoglykane bezeichnet werden.
Es ist im Wesentlichen ein polymerisiertes Disaccharid, eine Stärke.
Jedes wiederholte Disaccharid ist unterschiedlich sulfatiert. Hier ist ein Bild, das ich aus Wikipedia entnommen habe:
Da die Disaccharidpolymere unterschiedlich lang sind, hat Heparin ein durchschnittliches Molekulargewicht von 3 bis 30 kDa. Es sei denn, es ist fraktioniert, in diesem Fall kann man kontrollieren, dass nur die Version mit niedrigem Molekulargewicht vorhanden ist.
Die Polymerlänge ist wirklich sehr zufällig, vor allem weil das Heparin in Ihrem Krankenhaus aus Rinderlunge oder Schweinedarm gewonnen wird, und diese Tiere sind an der Qualitätskontrolle der industriellen Chemie weitgehend uninteressiert. Das erste Heparin wurde 1916 von einem Medizinstudenten im zweiten Jahr aus Hundeleberzellen gewonnen.
Was zum Teufel ist eine „Einheit“ Heparin?
Eine Einheit Heparin ist die Menge, die erforderlich ist, um 1 ml Katzenblut 24 Stunden lang bei 0 Grad Celsius flüssig zu halten. Diese ungewöhnlich tierfeindliche Definition stammt von einem WH Howell, der Katzenblut über Nacht im Kühlschrank aufbewahrt hat. Es gerann nicht – es war halb geronnen – aber es blieb trotzdem flüssig. Heutzutage verwendet der Internationale Heparinstandard Schafsplasma, vermutlich weil Schafe leichter zu fangen und auszubluten sind.
Chemische Verwandte
Ich nehme an, das wären die fraktionierten Heparine (z.B. Enoxaparin).
Funktionelle Verwandte sind alle anderen indirekten Thrombininhibitoren, zu denen auch Fondaparinux gehört
Verabreichung und Resorption
Es wird in der Regel intravenös oder subkutan verabreicht (wobei es allmählich dissoziiert).
-
- Bei der subkutanen Verabreichung dauert es 1 bis 2 Stunden, bis die maximale Wirkung erreicht ist.
Danach beträgt das Verteilungsvolumen 40-70 ml/kg und ist im Wesentlichen auf das intravasale Volumen beschränkt.
Es durchdringt die Plazenta nicht, was es in der Schwangerschaft besonders nützlich macht.
Was ist, wenn ich es trinke?
Orales Heparin hat eine sehr schlechte Bioverfügbarkeit. Es ist ein zu großes Molekül, und seine Ladung ist zu negativ, um leicht absorbiert zu werden. Aus diesem Grund verteilt es sich fast ausschließlich im Kreislaufvolumen. Mutige Männer haben versucht, Heparin zu kochen, um seine orale Bioverfügbarkeit zu verbessern. Außerdem haben 45 mutige Menschen 20.000 Einheiten Heparin getrunken und dann ihre APTT testen lassen – es stellte sich heraus, dass sie sich im Durchschnitt um 2,3 Sekunden erhöht, was nicht viel ist, aber zeigt, dass es eine gewisse Absorption gibt. Die Studie liegt mir nicht vor, aber ich würde gerne von einem Freiwilligen hören, wie das Heparin geschmeckt hat.
Metabolismus und Clearance
Es gibt 2 Mechanismen: schnelle sättigbare Clearance und langsame Clearance erster Ordnung.
Die Halbwertszeit hängt von der Dosis ab.
Halbwertszeit von 25 Einheiten pro Kg = 30 Minuten
Halbwertszeit von 100 Einheiten pro Kg = 60 Minuten
Halbwertszeit von 400 Einheiten pro Kg = 150 Minuten
Bei niedrigeren Dosen, ist die Halbwertszeit sehr kurz (weil der größte Teil des infundierten Heparins direkt an Makrophagen und Endothelzellen gebunden wird, wo es depolymerisiert wird). Dieser Mechanismus wird bei höheren Dosen gesättigt, und die Eliminierung wird langsamer, mit einer Rate, die von der Dosis abhängt.
Rapid Saturable Zero-Order Clearance:
- Durch die Bindung an Heparin-bindende Proteine, Makrophagen und Endothelzellen.
- Durch die Bindung wird Heparin nutzlos und wird schließlich depolymerisiert.
- Dies ist die lineare Elimination nullter Ordnung, die bei niedrigen Dosen zu beobachten ist.
Slow First-Order Clearance:
- Nierenausscheidung… vielleicht? Um ehrlich zu sein, es ist wahrscheinlich nicht renal. Nach hohen Dosen wird eine kleine Menge über den Urin ausgeschieden.
- Das MIMS räumt ein, dass „das metabolische Schicksal von Heparin schlecht verstanden wird“, erwähnt aber, dass das retikuloendotheliale System eine Rolle bei der Sequestrierung und dem Abbau von Heparin spielen könnte.
Wirkungsmechanismus
Heparin ist im Körper in den sekretorischen Granula der Mastzellen vorhanden. Es kommt auch in zahlreichen Tieren vor, einschließlich verschiedener Wirbelloser, die nichts haben, was der menschlichen Gerinnungskaskade auch nur im Entferntesten ähnelt. Was seltsam ist.
Niemand weiß also wirklich genau, wozu es dient.
Aber beim Menschen…
Heparin erhöht die Aktivität von Antithrombin-III um den Faktor 1000.
Es tut dies, indem es an Antithrombin III bindet und eine Konformationsänderung der aktiven Stelle bewirkt.
In meinem kindlichen Diagramm stellt das Wegschnipsen des Antithrombin-III-Molekülschwanzes die erhöhte Verfügbarkeit der aktiven Stelle dar.
Auf diese Weise aktiviert, inaktiviert Antithrombin III mehrere Faktoren – aber vor allem Xa und IIa (Thrombin).
Nun kommen wir zu einem wichtigen Punkt.
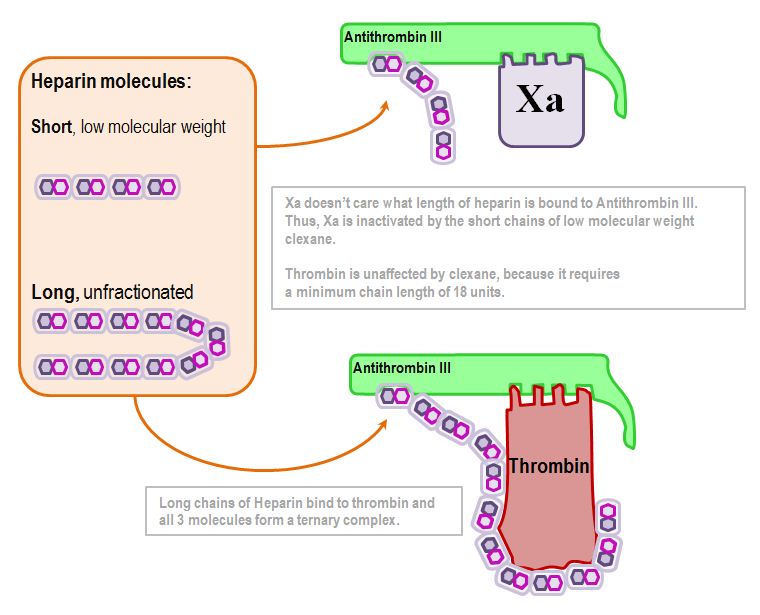
Die Inaktivierung von Thrombin hängt von der Länge des Heparinmoleküls ab:
18 Disaccharideinheiten sind die Schlüsselzahl (etwa 5kDa)
Die Inaktivierung von Xa ist unabhängig von der Länge: Solange irgendeine Art von Heparin daran gebunden ist, wird Antithrombin-III Xa inaktivieren.
Dies liegt dem Unterschied in der Pharmakokinetik von niedermolekularem Heparin und unfraktioniertem Heparin zugrunde.
Zusammenfassend lässt sich also sagen, dass unfraktioniertes Heparin das Thrombin beeinflusst, während niedermolekulares Heparin nur das Xa beeinflusst.
Das erklärt auch, warum die Messung der APTT nicht aussagt, ob die Clexan-Dosis therapeutisch ist.
Das unfraktionierte Heparin beeinflusst auch die Aktivität von Faktor 9, nicht aber die Aktivität von Faktor 7. Somit sind der intrinsische und der gemeinsame Weg betroffen, was die APTT erhöht. Der extrinsische Weg wird nicht beeinträchtigt, und der PT steigt nicht sehr stark an. Da Thrombin durch niedermolekulares Heparin nicht beeinflusst wird, bleibt die APTT im Wesentlichen unverändert.
Anwendungsgebiete
- Nun ja, die Antikoagulation ist ein viel größeres Thema. Die APTT-Überwachung ist das wichtigste Thema.
- Kurz gesagt, Heparin wird zur Thromboseprophylaxe, zur Behandlung von Thrombosen und Thromboembolien, bei akuten Koronarsyndromen und zur Aufrechterhaltung langsam fließender Dialysekreisläufe eingesetzt.
- Die pharmakologische Behandlung von Thrombosen in der Schwangerschaft beruhte bisher auf unfraktioniertem Heparin. In der PROTECT-Studie, in der unfraktioniertes Heparin mit LMWH verglichen wurde, wurde kein großer Unterschied in der TVT-Rate festgestellt (immer noch etwa 5,6 %), aber in der LMWH-Gruppe traten weniger PEs auf und es gab einen Trend zu weniger HITS.
Kontraindikationen
- Wenn es zu Blutungen kommt, sollte man Heparin überdenken. Damit sind die Kontraindikationen aus praktischer Sicht grob zusammengefasst. Drohende invasive Eingriffe sind die Hauptkontraindikation.
- Die einzige absolute Kontraindikation ist eine HIT oder HITT in der Vorgeschichte.
Wechselwirkungen
Abgesehen von der dummerweise offensichtlichen Tendenz, das Blutungsrisiko bei Personen zu erhöhen, die auch mit anderen gerinnungshemmenden Medikamenten antikoaguliert sind, hat Heparin nur wenige echte pharmakologische Wechselwirkungen:
| Wirkungen von Heparin werden potenziert durch | Wirkungen von Heparin werden antagonisiert durch |
| Hydroxycholoroquin | Antihistaminika |
| Probenecid | Digoxin |
| Natriumvalproat | Tetrazykline |
| Vitamin C | |
| Nikotin |
chronische Komplikationen
Heparin-Induziertes Thrombozytopenie-Syndrom (HITS) plus Heparin-induziertes Thrombozytopenie- und Thrombose-Syndrom (HITTS)
-
- Immun-vermittelte Thrombozytopenie gut diskutiert von Franchini 2005
-
-
- Häufiger in Verbindung mit unfraktioniertem Heparin
- Häufiger bei älteren Menschen; bei Kindern nicht bekannt
- Herz- und orthopädische Patienten haben ein höheres Risiko
- Typischerweise tritt es 5-10 Tage nach Beginn der Heparineinnahme auf
-
-
- Immun-vermittelte Thrombozytopenie gut diskutiert von Franchini 2005
-
- Es gibt 2 Arten: Typ 1 und Typ 2.
Hits Typ 1:
- Milde vorübergehende Thrombozytopenie, Thrombozytenzahl über 100
- Wird durch Absetzen von Heparin vollständig rückgängig gemacht
- Tritt bei bis zu 10 % der Patente auf
- NICHT mit einem erhöhten Thromboserisiko verbunden
- Wahrscheinlich nicht einmal immunologisch bedingt
HITS Typ 2:
- Schwere Thrombozytopenie, die Thrombozytenzahl kann bis auf Null sinken
- Tritt in etwa 1 % der Fälle auf
- In 30 % der Fälle mit Thrombose assoziiert
- Aufgrund der Bildung von Antikörpern gegen den Komplex aus Thrombozytenfaktor 4 (PF4) und Heparin; dieser Komplex bildet sich auf der Oberfläche der Thrombozyten.
- Wenn der HIT-Antikörper an diesen Komplex bindet, führt er zu einer Aktivierung und Aggregation der Thrombozyten und damit zu einer Gerinnungstendenz (weil alle Thrombozyten aktiviert sind) sowie zu einer gleichzeitigen Blutungstendenz (weil es zu einer Zerstörung der antikörperbeschichteten Thrombozyten im retikuloendothelialen System kommt)
Wenn Ihr Patient HIT hat, sollte er weiterhin antikoaguliert werden.
Direkte Thrombininhibitoren sind die Behandlung der Wahl.
Andere Wirkungen der chronischen Heparineinnahme
- Osteopenie
- Heparin aktiviert aus irgendeinem Grund die Osteoklasten, und der Knochenabbau nimmt zu.
- Mineralokortikoidmangel
- Heparin scheint die Wirkung von ACTH zu hemmen
- Seltsame Nebenwirkungen
- Alopezie- wer weiß wie.
- Erhöhung von AST und ALT – wer weiß warum.
Akute Toxizität und Überdosierung
- Die wichtigste akute Nebenwirkung sind Blutungen. Nur sehr wenige Menschen reagieren wirklich allergisch auf Heparin.
- An den subkutanen Injektionsstellen können Hautnekrosen aufgrund von Thrombosen kleiner Gefäße auftreten.
Management der akuten Toxizität
Wenn man die Heparinisierung überdosiert hat, wird die APTT dramatisch ansteigen, und es kann zu Blutungskomplikationen kommen. Man kann sich dabei ertappen, wie man denkt: „Ich wünschte, ich könnte die Gerinnungskaskade wieder in Gang bringen“. Dies kann mit Protamin erreicht werden.
Umkehr der Gerinnung mit Protaminsulfat
- 1mg kehrt 100 Einheiten um
- Nicht mehr als 50mg auf einmal
- Es wird LANGSAM als IV-Infusion gegeben
Die Gefahren von Protamin
Protaminsulfat ist alles andere als harmlos. Es ist eine fremde, ungewöhnliche Substanz – ein stark alkalisches Polypeptid, das sich irreversibel an stark saures Heparin bindet und dadurch dessen gerinnungshemmende Wirkung auf Antithrombin-3 abschwächt. In lächerlichen Dosen wirkt Protamin jedoch selbst als Gerinnungshemmer.
Zu seinen zahlreichen unerwünschten Wirkungen gehören die folgenden:
- Katastrophische Hypotonie aufgrund der Vasodilatation, die glücklicherweise nur von kurzer Dauer ist (nur ca. 3-4 min) – dies scheint das Ergebnis einer systemischen Histaminfreisetzung zu sein, die in einer Art direkt-komplementärer Aktivierung durch die zirkulierenden Heparin-Protamin-Komplexe ausgelöst wird
- Pulmonale Hypertonie aufgrund der lokalisierten vasokonstriktorischen Aktivität von Thromboxan, aktiviert durch eine anaphylaktoide Reaktion auf Protamin
- Anaphylaxie (schließlich handelt es sich um ein Fischprodukt)
Resistenz gegen Heparintherapie
Es gibt Situationen, in denen große Mengen an intravenös verabreichtem Heparin trotz aller Bemühungen nicht zu einer Erhöhung der APTT führen. Man könnte dies als „Heparin-Resistenz“ oder „Heparin-Insensitivität“ bezeichnen.
Es gibt mehrere Gründe für eine Heparin-Resistenz:
- Erhöhte Heparin-bindende Proteinspiegel (alle sind Akute-Phase-Reaktanten)
- Niedrige Antithrombin-III-Spiegel (d.d. h. nichts, was Heparin binden könnte)
- Erhöhte Heparin-Clearance (z. B. bei Lebererkrankungen)
- Erhöhte Faktor-VIII-Spiegel
UpToDate bietet einen guten Artikel über Antithrombin-III-Mangel. Entweder kann man erblich bedingt nicht genug davon synthetisieren, oder die Leber ist so geschädigt, dass sie nicht genug produzieren kann. Oder es wurde auf irgendeine Weise verbraucht, z. B. im Zusammenhang mit DIC, MAHA oder in einem Bypass-Kreislauf. Schließlich ist es möglich, dass Sie ihn zusammen mit anderen Proteinen über Ihre undichten nephrotischen Nieren verlieren.
Die Behandlung des AT-III-Mangels besteht vorhersehbar in der Supplementierung mit AT-III.
Wenn der teure gereinigte Faktor nicht verfügbar ist, reicht FFP aus.
Effektive Gerinnung bei heparinresistenten Patienten
Es gibt mehrere Strategien, die man anwenden kann. Die spezifische Wahl hängt davon ab, was genau die Ursache der Heparinresistenz ist.
Es gibt einige gute Artikel zu diesem Thema. Die meisten von ihnen gehen nicht auf die routinemäßige Antikoagulation eines beliebigen Patienten ein, der zufällig steigende Heparindosen erhält; ich nehme an, dass man im Allgemeinen davon ausgeht, dass man die Dosis so lange steigert, bis die Therapieziele erreicht sind. Es gibt jedoch Situationen, in denen die Antikoagulation von entscheidender Bedeutung ist, und ein solches Szenario ist der kardiopulmonale Bypass-Kreislauf.
– Wechsel zu niedermolekularem Heparin anstelle von unfraktioniertem Heparin
– Verabreichung von Kryopräzipitat und/oder gefrorenem Frischplasma (bei bestätigtem ATIII-Mangel)
– Verabreichung von Antithrombin-III-Konzentrat
Oder man könnte die Verwendung eines anderen Mittels in Betracht ziehen, z. B. eines direkten Thrombininhibitors (Hirudin oder Argobatran)




Leave a Reply