Zelfvernietigende muggen en gesteriliseerde knaagdieren: de belofte van gene drives
Austin Burt en Andrea Crisanti probeerden al acht jaar het genoom van de mug te kapen. Ze wilden de natuurlijke selectie omzeilen en een gen toevoegen dat sneller in de populatie zou doordringen dan een mutatie die via het gebruikelijke overervingsproces wordt doorgegeven. In hun achterhoofd zat een manier om malaria te voorkomen door een gen te verspreiden dat muggenpopulaties uitschakelt, zodat ze de ziekte niet kunnen overbrengen.
Crisanti herinnert zich dat ze keer op keer faalden. Maar uiteindelijk, in 2011, kregen de twee genetici aan het Imperial College in Londen de DNA-resultaten waarop ze hadden gehoopt: een gen dat ze in het genoom van de mug hadden ingebracht, had zich door de populatie verspreid en bereikte meer dan 85% van de nakomelingen van de insecten1.
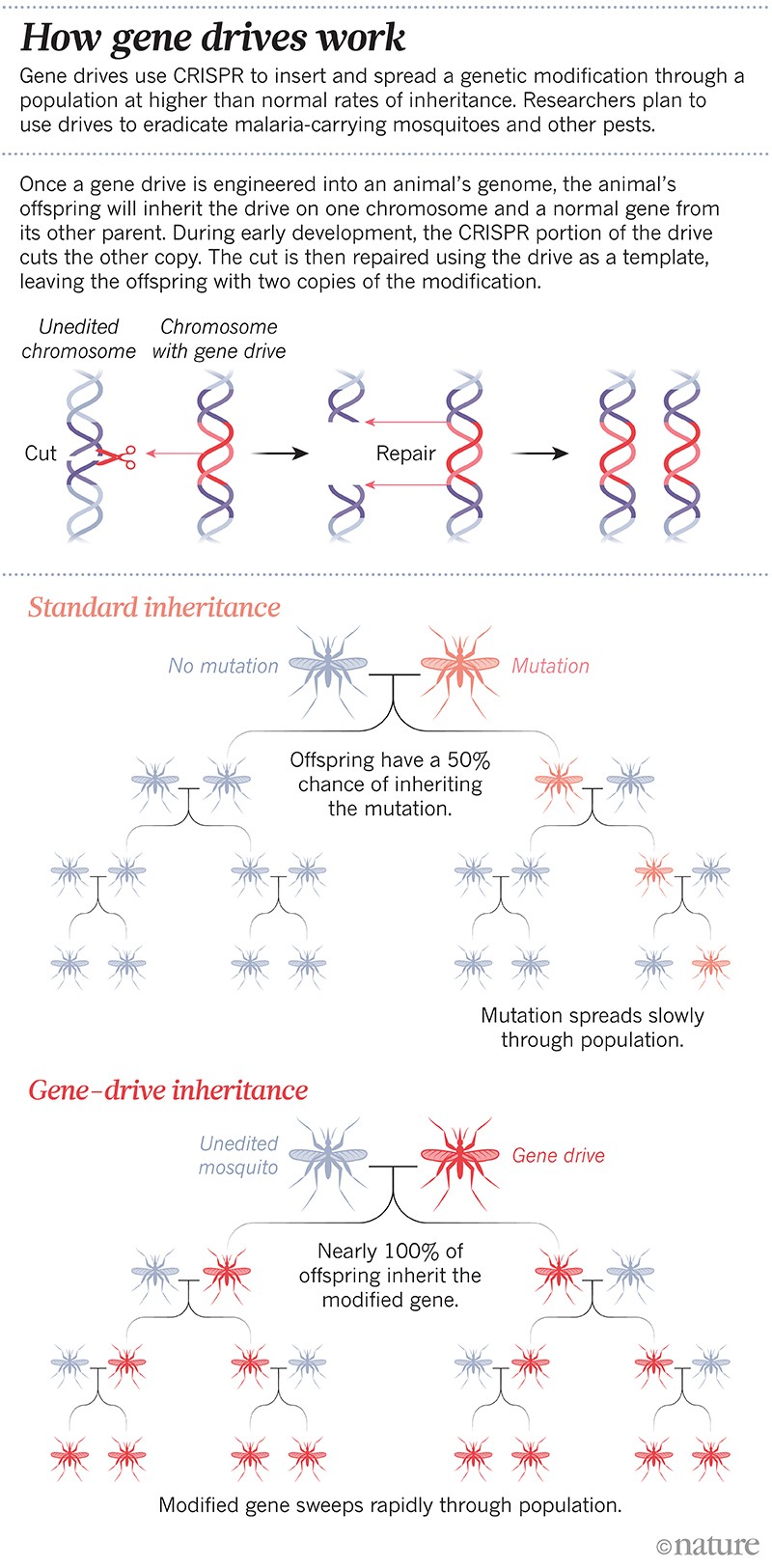
Het was de eerste gemanipuleerde ‘gene drive’: een genetische modificatie die is ontworpen om zich door een populatie te verspreiden met een hoger dan normaal overervingspercentage. Gene drives zijn in sommige laboratoria snel een routinetechnologie geworden; wetenschappers kunnen nu in enkele maanden een “gene drive” in elkaar flansen. De techniek berust op het gen-editing-gereedschap CRISPR en enkele stukjes RNA om een specifiek gen te wijzigen of het zwijgen op te leggen, of een nieuw gen in te voegen. In de volgende generatie kopieert de hele “drive” zichzelf naar zijn partnerchromosoom, zodat het genoom niet langer de natuurlijke versie van het gekozen gen heeft, maar in plaats daarvan twee kopieën van de “gene drive”. Op deze manier wordt de verandering doorgegeven aan maximaal 100% van de nakomelingen, in plaats van ongeveer 50% (zie ‘Hoe gene drives werken’).
Sinds 2014 hebben wetenschappers op CRISPR gebaseerde gene-drive systemen ontwikkeld in muggen, fruitvliegen en schimmels, en momenteel zijn ze bezig ze te ontwikkelen in muizen. Maar dat is nog maar het begin van het verhaal. Vragen over of een gene drive mogelijk is, zijn verdrongen door andere onbekenden: hoe goed zullen ze werken, hoe ze te testen en wie moet de technologie reguleren. Genaandrijving is voorgesteld als een manier om door insecten overgedragen ziekten te verminderen of te elimineren, invasieve soorten te controleren en zelfs de resistentie tegen insecticiden bij ongedierte om te keren. Er is nog geen gemanipuleerde gene drive in de natuur vrijgelaten, maar de technologie zou in principe al over drie jaar klaar kunnen zijn, zegt Crisanti. Hij werkt samen met Target Malaria, een non-profit internationaal onderzoeksconsortium dat gen-gestuurde muggen wil gebruiken voor malariacontrole in Afrika. Op 1 juli heeft de groep een testpartij muggen – genetisch gemanipuleerd maar nog niet uitgerust met gene drives – losgelaten in een dorp in Burkina Faso.
Gene drives zijn anders dan alle ecologische fixaties die ooit eerder zijn getest, zegt Fredros Okumu, wetenschappelijk directeur van het Ifakara Health Institute in Dar es Salaam, Tanzania. “Gene drives zullen zich vanzelf verspreiden,” zegt hij. “We moeten mensen voorbereiden en informatie openlijk delen met alle betrokken landen.”
De technische uitdagingen zijn niet zo ontmoedigend als de sociale en diplomatieke, zegt bio-ingenieur Kevin Esvelt van het Massachusetts Institute of Technology (MIT) Media Lab in Cambridge, die een van de eersten was om een op CRISPR gebaseerde gene drive te bouwen. “Technologieën zoals deze hebben reële gevolgen voor het leven van mensen die bijna onmiddellijk kunnen zijn.”
Gezien de potentiële bezorgdheid over gene drives, verkent Nature vijf belangrijke vragen over de technologie en haar toepassingen.
Wil gene drives zelfs werken?
Het bouwen van een gene drive om een populatie te manipuleren of uit te roeien is als het aangaan van een gevecht met natuurlijke selectie, en dat gevecht is misschien niet gemakkelijk te winnen.
Zodra onderzoekers begonnen met het regelmatig maken van gene drives in laboratoria, ontwikkelden dieren resistentie ertegen – het ophopen van mutaties die de verspreiding van de drives verhinderden. In tests van twee aandrijvingen die in fruitvliegen werden ingebracht, bijvoorbeeld, ontstonden vaak genetische varianten die resistentie opleverden2. Meestal veranderen mutaties een sequentie die CRISPR moet herkennen, waardoor het gen niet kan worden bewerkt. In experimenten met gekooide muggen zagen Crisanti en Tony Nolan, onderzoeker voor Target Malaria, hoe een gene drive geleidelijk in frequentie afnam over meerdere generaties als gevolg van resistente mutaties in het doelgen3. De resultaten deden het veld opschrikken. Zou resistentie gene drives impotent maken?
Niet noodzakelijk – als onderzoekers het juiste doelwit kiezen. Sommige genen zijn zeer geconserveerd, wat betekent dat elke verandering waarschijnlijk hun eigenaars zal doden. Het kiezen van deze genen als een aandrijfdoel betekent minder mutaties en minder resistentie. In september 2018 verpletterden Crisanti en zijn team een populatie gekooide Anopheles gambiae-muggen met 100% efficiëntie4 door een drive te maken die een vruchtbaarheidsgen genaamd doublesex verstoort. Met de drive op zijn plaats kunnen vrouwelijke muggen niet bijten en leggen ze geen eieren; binnen 8-12 generaties produceerden de gekooide populaties helemaal geen eieren meer. En omdat het van cruciaal belang is voor de voortplanting, is doublesex resistent tegen mutaties, met inbegrip van die welke resistentie zouden verlenen aan een drive construct.
Het team heeft negen kooi-experimenten uitgevoerd van meer dan een miljoen drive inserties gericht op doublesex en heeft geen resistentie gezien, zegt Crisanti. Nu past het team de aandrijving aan om niet één maar twee loci op het doublesex-gen te snijden, alsof een ziekte wordt behandeld met een combinatie van geneesmiddelen. “Ik wil er zeker van zijn dat de kans op het ontwikkelen van resistentie zeer, zeer klein is voordat ik zeg dat de technologie klaar is voor het veld,” zegt Crisanti.
In zoogdieren, hebben wetenschappers veel meer fundamentele uitdagingen dan resistentie om mee om te gaan. Vorig jaar hebben Kim Cooper en haar collega’s aan de Universiteit van Californië, San Diego (UCSD), het begin van een genaandrijving in een zoogdier gemaakt – een aandrijving die een muizengen, Tyr, onderbreekt en de vacht van de dieren wit maakt5. De aandrijving was slechts 72% efficiënt bij het kopiëren van zichzelf in het genoom en werkte niet goed in de mannelijke kiemlijn, zegt Cooper. Ze vermoedt dat dit komt doordat celdeling op verschillende momenten gebeurt bij de vorming van eicellen en sperma, wat van invloed lijkt te zijn op het vermogen van de aandrijving om succesvol van het ene chromosoom naar het andere te kopiëren.
In dat experiment plantte de aandrijving zich niet zelf voort en Cooper volgde de eigenschap niet over meerdere generaties, dus benadrukt ze dat het technisch gezien niet als een genaandrijving kan worden beschouwd. “Er is nog zoveel werk te doen om aan te tonen dat zoiets zelfs haalbaar is,” voegt ze eraan toe.
Waar zijn gene drives nog meer goed voor?
Hoewel toepassingen voor muggen het veld domineren, omvatten voorgestelde toepassingen van gene drives ook het behoud van kwetsbare ecosystemen en het versnellen van laboratoriumwerk.
Sommige organismen hebben genomen die uitdagend zijn om te manipuleren, maar dit zou onderzoekers kunnen helpen om ze te bestuderen. Neem Candida albicans, een vaak resistente menselijke schimmelziekteverwekker. Als postdoctoraal onderzoeker aan het Broad Institute en het MIT in Cambridge, Massachusetts, ontwikkelde Rebecca Shapiro een systeem6 om mutaties in de schimmel aan te brengen met een efficiëntie van bijna 100%. Ze kan nu de schimmel kweken om twee onafhankelijke genen het zwijgen op te leggen en die mutaties aan het nageslacht doorgeven. “Het werkt waanzinnig efficiënt”, zegt Shapiro, die nu aan de universiteit van Guelph in Canada werkt. Aan de UCSD gebruikt Cooper gene drives voor een soortgelijk doel, om complexe eigenschappen in muizen te creëren en te bestuderen.
Het Genetic Biocontrol of Invasive Rodents (GBIRd) programma wil meer doen met gene-drive muizen dan ze in een laboratorium bestuderen. GBIRd, een samenwerkingsverband van universiteiten, regeringen en niet-gouvernementele organisaties onder leiding van de non-profit groep Island Conservation, wil de technologie gebruiken om invasieve knaagdieren uit te roeien van eilanden, waar zij een ravage aanrichten aan de inheemse fauna. Momenteel worden hiervoor bestrijdingsmiddelen gebruikt, maar deze zijn duur en moeilijk toe te passen op grotere eilanden met menselijke populaties. Ze zijn haalbaar op slechts ongeveer 15% van de eilanden, zegt Royden Saah, programmamanager van GBIRd. “We proberen te kijken naar technologieën die voor de andere 85% zouden zorgen.”
GBIRd-leden David Threadgill van de Texas A&M University in College Station en Paul Thomas van de University of Adelaide in Australië ontwikkelen gen-aandrijvingstechnologieën bij muizen, hoewel Saah schat dat het enkele jaren zal duren voordat die aandrijvingen met succes werken.
Ondertussen hopen sommige muggenonderzoekers iets subtielers te proberen dan het volledig wegvagen van insectenpopulaties als een middel om ziekten te voorkomen. In een voorpublicatie van mei7 hebben Omar Akbari en zijn collega’s van UCSD Aedes aegypti muggen zo gemanipuleerd dat ze een antilichaam tot expressie brengen dat de insecten beschermt tegen alle vier de belangrijkste stammen van dengue. Zij zijn nu bezig dat antilichaam te koppelen aan een aandrijving om te zien of het zich zal verspreiden. Akbari is ook bezig met het bouwen van een all-purpose gene drive die een toxine activeert wanneer een virus, niet alleen dengue, A. aegypti infecteert. “We willen een Trojaans paard in de mug bouwen,” zegt Akbari. “Wanneer een mug wordt geïnfecteerd door een virus – of het nu dengue, Zika, chikungunya, gele koorts, wat dan ook is – activeert het ons systeem, dat de mug doodt.”
Kan gene drive worden gecontroleerd?
Voordat Kevin Esvelt ooit een enkele CRISPR-gebaseerde gene drive bouwde, werd hij wakker in het koude zweet nadenkend over de vertakkingen. “Ik realiseerde me, oh hey, dit gaat niet alleen over malaria, dit is potentieel iets dat elk individu dat een transgene fruitvlieg kan maken, zou kunnen bouwen om alle fruitvliegen te bewerken.”
Het is dan ook geen verrassing dat in 2014, toen Esvelt en geneticus George Church hun eerste genaandrijving bouwden aan de Harvard Medical School in Boston, Massachusetts, ze tegelijkertijd een omkeringsaandrijving bouwden om de oorspronkelijke aandrijving op commando te overschrijven8.
De rest van het veld heeft dit voorbeeld gevolgd en genaandrijvingen ontwikkeld met ingebouwde controles, externe omkeringen of beide. Het grootste deel van die inspanning wordt gefinancierd door het Amerikaanse Defense Advanced Research Projects Agency (DARPA), de onderzoekstak van het Amerikaanse ministerie van Defensie. In 2017 kondigde DARPA’s Safe Genes-programma aan dat het 65 miljoen dollar uitgaf aan zeven Amerikaanse onderzoeksteams die bestuderen hoe genaandrives kunnen worden gecontroleerd, tegengegaan en teruggedraaid. “We beperken het potentieel voor misbruik, of het nu per ongeluk of snode is,” zegt Renee Wegrzyn, de programmamanager voor Safe Genes.
Esvelt, gefinancierd in de beginfase van het programma, bedacht een zelfuitputtende aandrijving die bekend staat als een daisy-drive. De aandrijving is ontworpen om een schakel per keer te verliezen, zoals het plukken van een bloem van een ketting die van hoofd tot steel is verbonden, totdat deze over verschillende generaties is uitgeput.
Aan UCSD ontwikkelt Akbari’s door DARPA gefinancierde team genaandrijvingen die niet in staat zouden moeten zijn zich te verspreiden buiten een doelpopulatie van muggen of vliegen. Eén zo’n aandrijving vereist voortdurende vrijlating gedurende vele generaties. Wanneer die vrijlating stopt, wordt het verdund met wild-type versies van het gen en dooft het zichzelf uit binnen vier jaar. Dat zou lang genoeg kunnen zijn om een virus als Zika of dengue uit een muggenpopulatie te elimineren, zegt Akbari. “Het is iets dat, naar mijn mening, een beetje veiliger is en nog steeds behoorlijk effectief.” Het team heeft al verschillende versies van deze drives geproduceerd voor A. aegypti, de belangrijkste vector voor het dengue-virus10.
Het Target Malaria-team ontwikkelt ook een tegenmaatregel, gefinancierd door DARPA, om de verspreiding van de doublesex drive in een populatie te stoppen.
Hoe kunnen gene drives worden uitgeprobeerd?
In plaats van een veldtest – die het DARPA Safe Genes-contract uitdrukkelijk verbiedt en waarvoor de onderzoekers het erover eens zijn dat de technologie niet klaar is – zijn teams bezig met het opschalen van kooi-experimenten en het bouwen van ecologische modellen om de voordelen en risico’s van een veilige vrijlating in het wild te onderzoeken.
In de stad Terni in Midden-Italië hebben Crisanti en Nolan hun muggenkooien verrijkt met veranderende omgevingsomstandigheden. “We willen het opschalen om het te testen met verschillende genetische achtergronden, onder meer realistische scenario’s,” zegt Nolan, die nu een lab runt aan de Liverpool School of Tropical Medicine in het Verenigd Koninkrijk. Hij en Crisanti willen natuurlijk paringsgedrag nabootsen – zoals mannetjes die zwermen vormen om vrouwtjes aan te trekken – om te zien hoe dit de verspreiding van een genaandrijving beïnvloedt.
De dynamiek van de verspreiding van de aandrijving in die kooien is tot nu toe “veelbelovend”, zegt Crisanti – de aandrijving wordt efficiënt doorgegeven zonder tekenen van weerstand. Als er geen problemen ontstaan in de grotere kooi-experimenten, zal het team de technologie overdragen aan onafhankelijke groepen om te testen, met het oog op het verkrijgen van wettelijke goedkeuring in ongeveer drie jaar, zegt hij.
Het Target Malaria-team bouwt ook ecologische modellen van toekomstige vrijlatingslocaties om de dynamiek op de grond uit te werken. De meest recente studie11 modelleert muggenpopulaties in meer dan 40.000 nederzettingen in Burkina Faso en omringende landen. Het houdt rekening met rivieren, meren en regenval, en ook met veldgegevens over muggenverplaatsingen. De resultaten11 tonen aan dat een herhaalde introductie, in plaats van een eenmalige introductie, van gemodificeerde muggen over een paar jaar in dorpen nodig zal zijn om het totale aantal insecten te verminderen.
“De theorie zegt dat, in principe, als je één keer loslaat, het zich over het hele continent zou verspreiden. De realiteit is dat dat heel langzaam zou gebeuren,” zegt populatiebioloog Charles Godfray van de Universiteit van Oxford, VK, een medewerker van Target Malaria en de hoofdonderzoeker van de studie.
Een ander punt van zorg is dat gene drives het potentieel hebben om hele populaties en dus hele ecosystemen te veranderen. Ze zouden in theorie ook een negatieve invloed kunnen hebben op de menselijke gezondheid door de malariaparasiet te laten evolueren om meer virulent te zijn of om door een andere gastheer te worden gedragen, zegt moleculair bioloog en bio-ethicus Natalie Kofler. Zij is de oprichtster van de “Editing Nature” groep aan de Yale Universiteit in New Haven, Connecticut, die zich richt op genetische milieutechnologieën wereldwijd. “Deze technologie heeft het potentieel om enorm krachtig te zijn en de loop der dingen te veranderen die we misschien niet kunnen voorspellen,” zegt Kofler.
Wie beslist wanneer een gene drive te gebruiken?
Voor medicijnproeven kan een bedrijf slechts een jaar of twee van tevoren beginnen met de voorbereiding van een veldtest. Gene drives zullen meer tijd nodig hebben, zegt Okumu. Vorig jaar maakte hij deel uit van een 15 leden tellende wetenschappelijke werkgroep, georganiseerd door de Foundation for the National Institutes of Health, die een reeks aanbevelingen12 deed voor het gebruik van gen-aangedreven muggen in Afrika ten zuiden van de Sahara.
In het rapport wordt benadrukt dat regeringen, gemeenschappen en lokale wetenschappers tijd nodig zullen hebben om de wetenschap in zich op te nemen en in staat te worden gesteld om de technologie te reguleren. “Ik zeg dit met alle overtuiging – uiteindelijk zijn de landen zelf de beste mensen om deze beslissingen te nemen,” zegt Okumu.
In 2017 verzamelde Kofler een groep wetenschappers en ethici om te worstelen met de maatschappelijke vragen rond gene drives13. “De belangrijkste vragen draaien om rechtvaardigheid,” zegt Kofler. In discussies over het vrijlaten van een genetisch gemanipuleerd organisme in een Afrikaanse omgeving, hebben groepen die historisch zijn gemarginaliseerd het recht om deel uit te maken van het besluitvormingsproces, zegt ze.
Okumu wil dat Afrikaanse wetenschappers gen-drive-technologie lokaal ontwikkelen en testen, wat respect en bereidheid van financiers zal vereisen om dergelijke inspanningen te ondersteunen. “Mensen zijn bang voor het onbekende, en het onbekende wordt op dit moment gepresenteerd vanuit een westers perspectief,” zegt Okumu. “Ik kijk uit naar een dag dat we deze constructen in onze eigen laboratoria kunnen bouwen, en op deze manier lokaal vertrouwen kunnen opbouwen.”
In augustus 2018 gaf het National Biosafety Agency van Burkina Faso toestemming aan Target Malaria om een stam genetisch gemodificeerde steriele mannelijke mug vrij te geven, de eerste in zijn soort op het Afrikaanse continent. Vorige week heeft het team ongeveer 6 400 muggen vrijgelaten die genetisch gemanipuleerd zijn maar geen gene drives bevatten. De wetenschappers hopen dat de vrijlating de perceptie van het onderzoek zal verbeteren en gegevens zal opleveren voor toekomstige vrijlatingen.
En hoewel de gene-drive muizen nog lang niet klaar zijn voor vrijlating, werkt GBIRd al samen met risicobeoordelaars, ethici en ecologen om een eiland te identificeren voor een eerste veldproef. “We willen er zeker van zijn dat we dit goed doen,” zegt Saah. “Hoe snel de technologieën ook gaan, we kunnen de sociale wetenschappen en de ethiek nu vooruit helpen.”
Leave a Reply