Wat is elektronegativiteit?
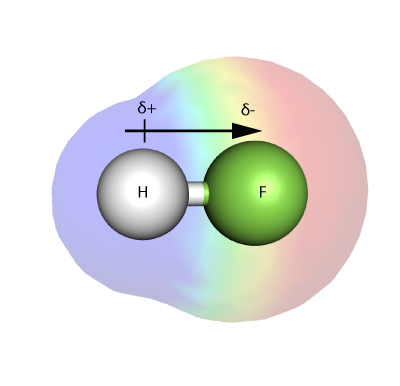
ELECTRONEGATIVITEIT
Elektronegativiteit is een maat voor hoe sterk een atoom – in een molecuul – in staat is om elektronen in een binding met zichzelf aan te trekken.
Factoren die de elektronegativiteit beïnvloeden:
1) Het atoomnummer
Het atoomnummer is het aantal protonen in de kern van een atoom.
Het bepaalt de chemische eigenschappen van een element en zijn plaats in het periodiek systeem.
Hoe hoger het atoomnummer, des te sterker de elektronegativiteit.
2) De atoomstraal
De atoomstraal van een chemisch element wordt gewoonlijk gemeten aan de hand van de afstand van het middelpunt van de kern tot de grens van de buitenste laag elektronen.
Hoe groter de atoomstraal, des te zwakker de elektronegativiteit.
Voorbeeld van atomaire straal van een zuurstofatoom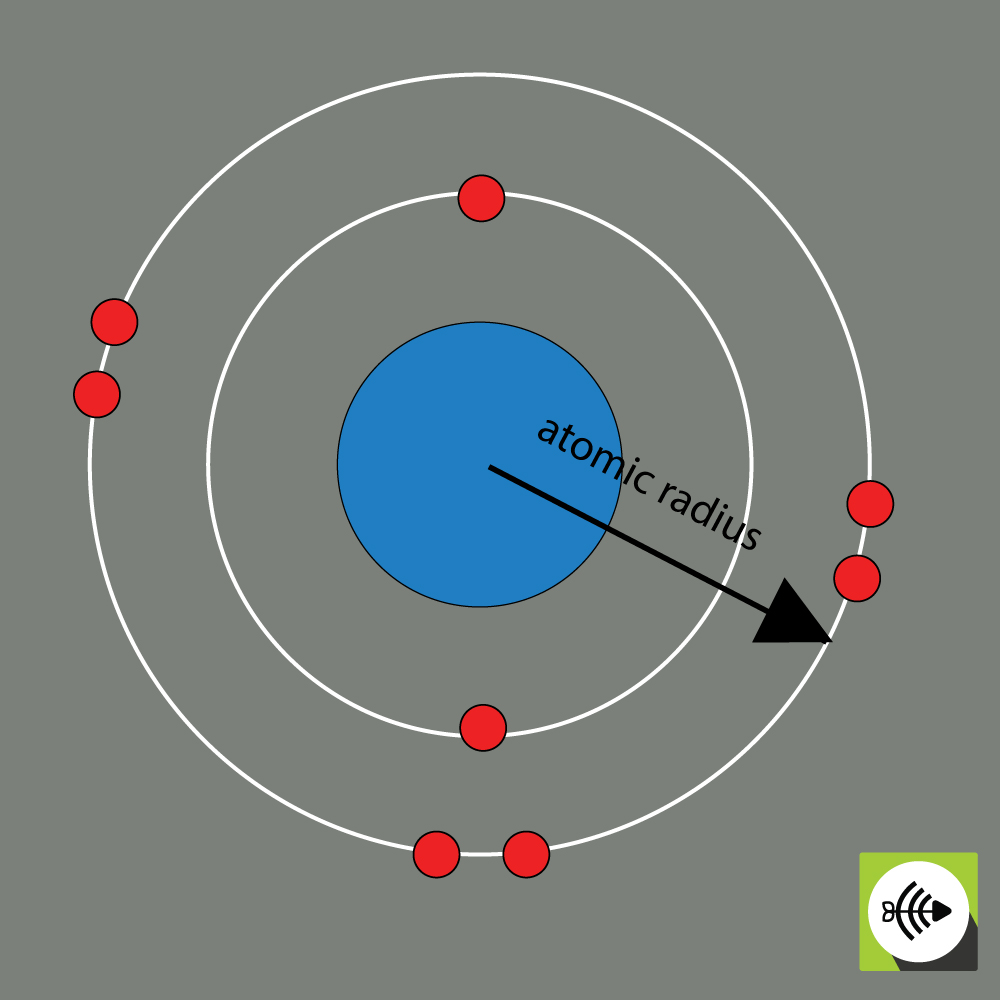
Waarin wordt elektronegativiteit gemeten?
De meest gebruikelijke maat voor elektronegativiteit is de Pauling-schaal, ontworpen door tweevoudig Nobelprijswinnaar Linus Pauling. De elektronegativiteitsschaal voor elementen geeft aan hoe sterk elk element (ten opzichte van elkaar) de bindende elektronen naar zich toe kan trekken. Hoe hoger het getal van de elektronegativiteit, hoe meer het atoom zal proberen elektronen naar zich toe te trekken.
Waarom is zuurstof elektronegatiever dan stikstof?
Zuurstof heeft een hoger atoomnummer
- Zuurstof heeft 8 protonen in de kern, terwijl stikstof er slechts 7 heeft.
- Een bindingspaar elektronen zal meer aantrekkingskracht ondervinden van de kern van zuurstof dan van die van stikstof, zodat de elektronegativiteit van zuurstof groter is.
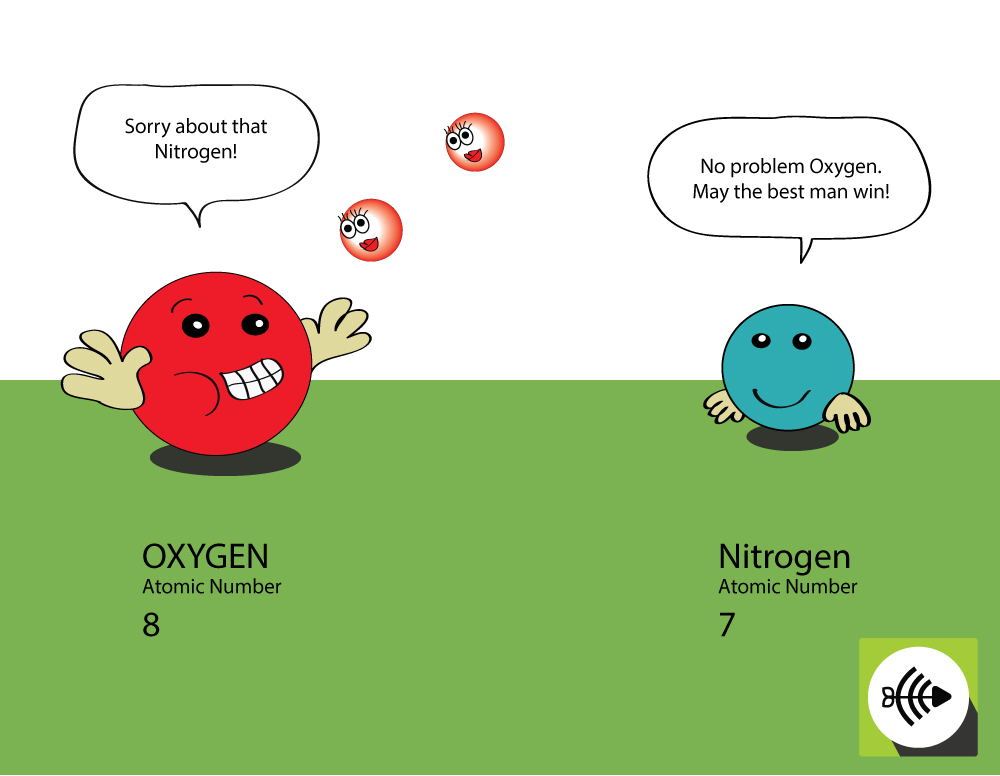
Waarom is zwavel minder elektronegatief dan zuurstof?
Redenen waarom zuurstof elektronegatiever is dan zwavel:
- Zuurstof heeft 2 energieniveaus, zwavel heeft er 3
- De bindingselektronen in zwavel staan verder weg van de atoomkern
- Wanneer bindingselektronen verder van de atoomkern staan, is er minder aantrekkingskracht van de kern
- Het bindingspaar elektronen in zuurstof ondervindt meer aantrekkingskracht van de kern dan de bindingselektronen van zwavel
- Zodat zuurstof een elektronegatiever atoom is
Lees je eerst in over valentie-elektronen voordat je verder gaat. Valentie-elektronen

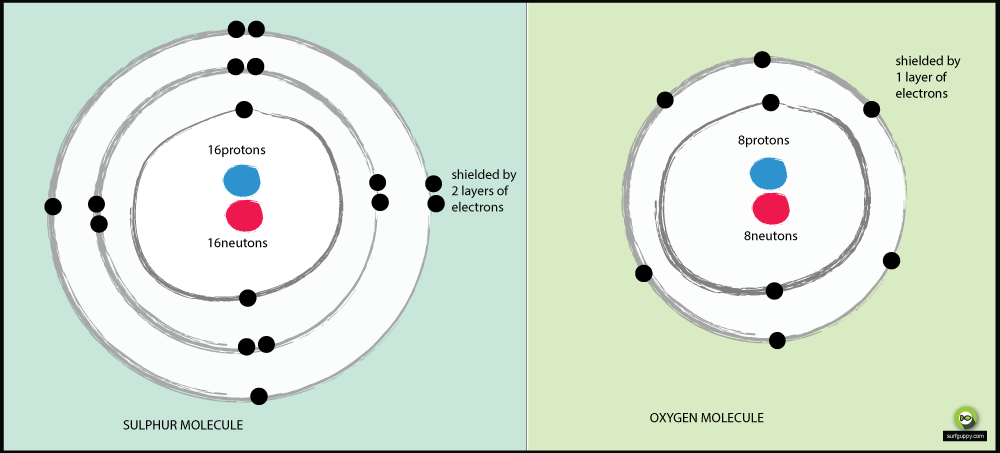
Het kleinere atoom heeft een hogere elektronegativiteit
Elektronegativiteitstrends in het periodiek systeem
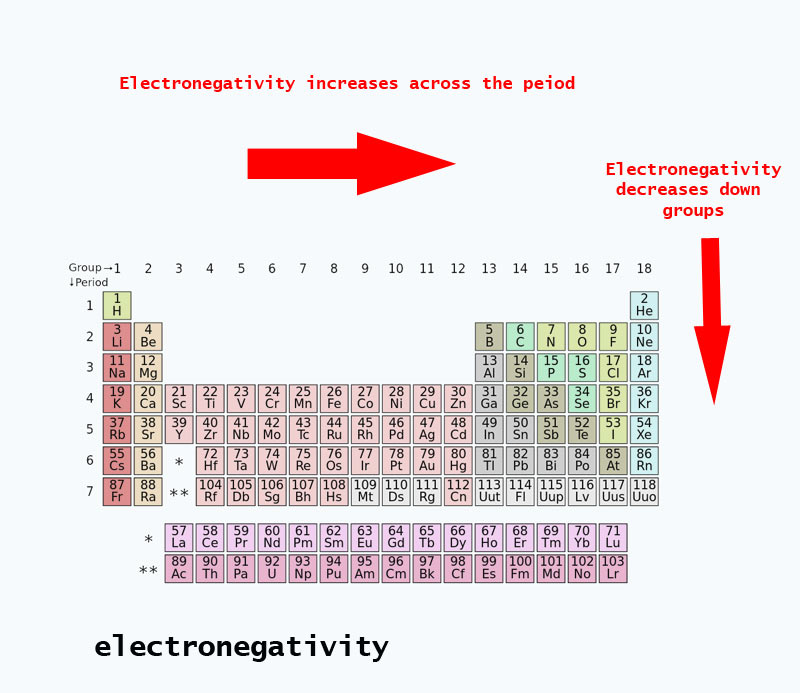
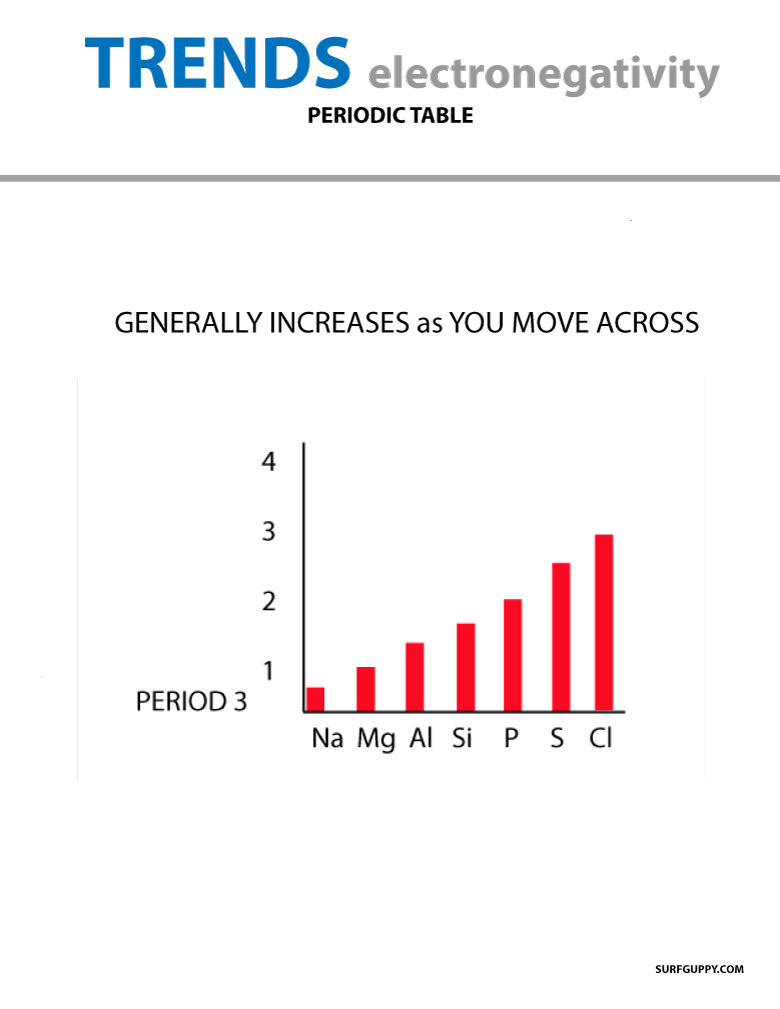
Als je door het periodiek systeem beweegt, neemt het aantal protonen in de kern toe (zonder dat het energieniveau toeneemt), waardoor de elektronegativiteit toeneemt.
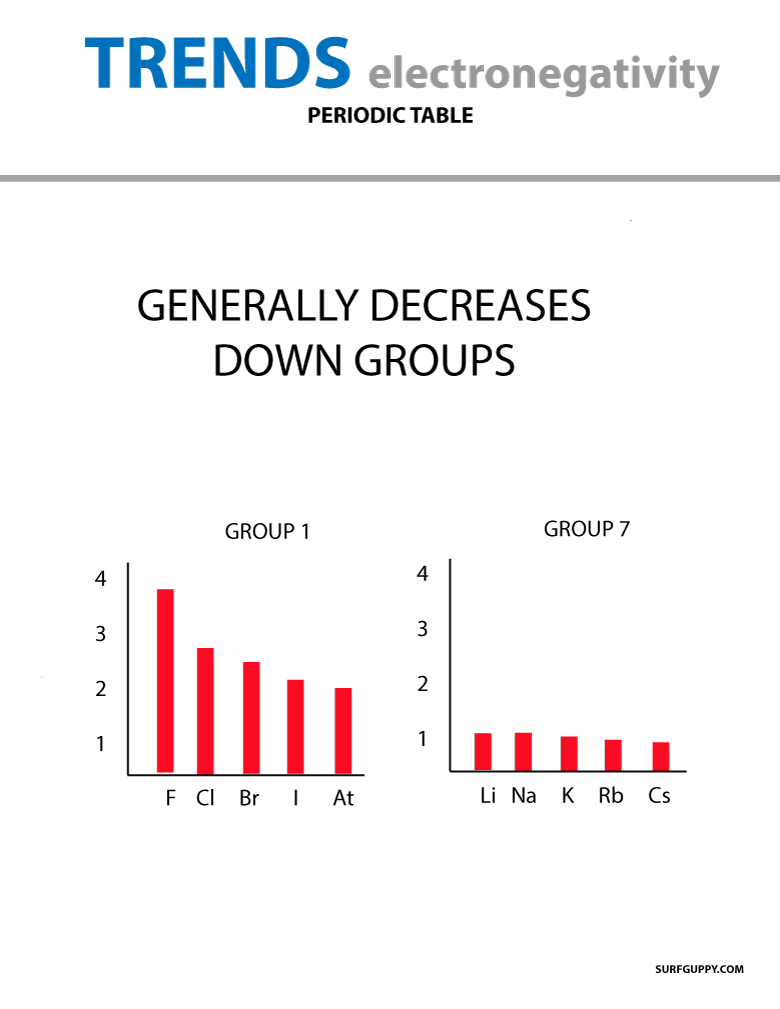
Wanneer het atoomnummer in een groep toeneemt, is er ook een toename in energieniveaus. De atomaire straal is groter, waardoor de elektronegativiteit afneemt.
PERIODISCHE TABEL VAN ELECTRONEGATIVITEIT
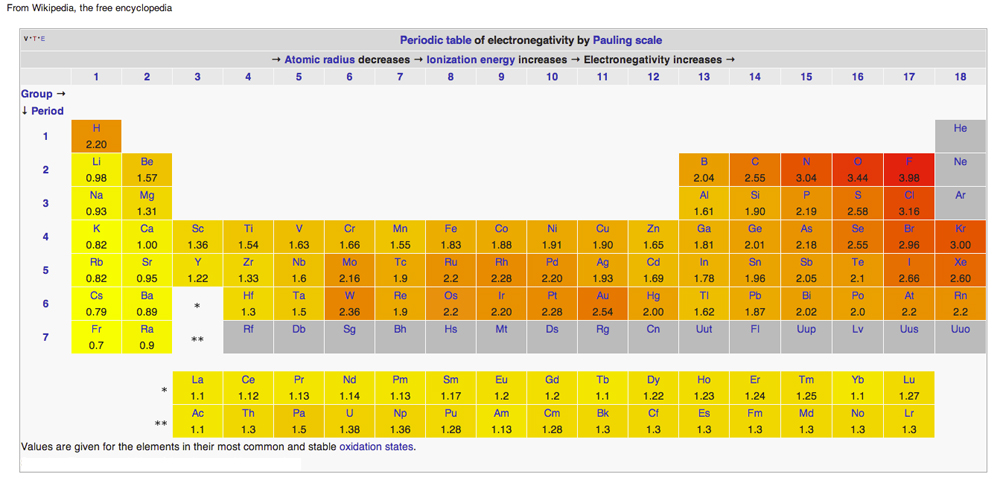 diagram uit Wikipedia, uitgegeven onder Creative Common Licenses
diagram uit Wikipedia, uitgegeven onder Creative Common Licenses
Leave a Reply