Waarom heeft #”HF “# een lager kookpunt dan water, ook al is #”F “# elektronegatiever dan #”O “#?
Er zijn veel ingewikkelde factoren. Dit is wat ik kon vinden:
- Water kan een evenwichtiger waterstofbruggennetwerk vormen (twee acceptoren en twee donoren, in plaats van één donor en drie acceptoren), waardoor het bulksysteem een meer uniforme interactie heeft en dus sterker is als geheel.
- Water vormt een uitgebreider waterstofbruggennetwerk (een driedimensionale tetrahedrale lokale omgeving, in plaats van een tweedimensionale zigzagomgeving), waardoor het bulksysteem minder gemakkelijk verdampbaar wordt.
- Water heeft over het algemeen een meer optimale hoek van interactie, omdat het meer overeenkomt met de elektronengeometrie van het molecuul en de interacties uitlijnt langs de moleculaire dipool, terwijl #”HF “# sterkere waterstofbruggen zou hebben (in termen van ruwe getallen) als de interacties lineair waren.
DISCLAIMER: LANG ANTWOORD! Ook zeer visueel.
Hydrogen-bonding is de sterkste intermoleculaire kracht in zowel #”HF “# als #”H”_2 “O “#. De sterkte van de interactie is afhankelijk van de interactieafstand, de interactiehoek, en de uitgebreidheid van het netwerk.
Wanneer we alle waterstofbruginteracties eruit halen, en uitgaan van zuiver water en zuiver #”HF “#, krijgen we (isoleren van een selecte set moleculen uit een oneindige matrix)#””^()##””^()#:
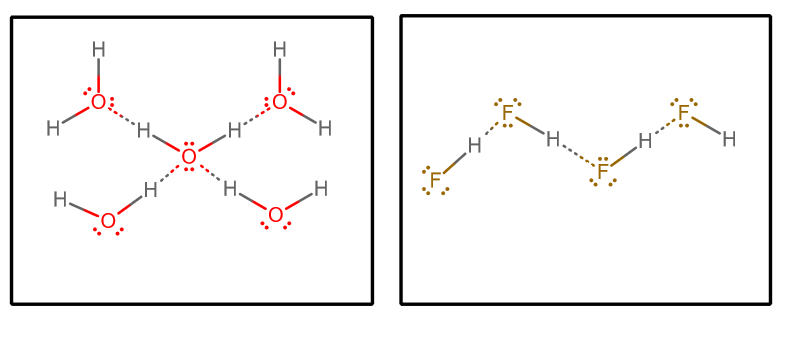
We kunnen dan een paar factoren in overweging nemen:
- Aantal waterstofbruggen-donoren en -acceptoren
Elk watermolecuul kan twee waterstofbruginteracties accepteren (via de lone pairs) en twee waterstofbruginteracties doneren (via de hydrogenen).
Aan de andere kant accepteert elk #”HF “# molecuul drie waterstof-bonding interacties (via de eenparen) en doneert er slechts één (via de waterstof).
U zou dan kunnen stellen dat water een evenwichtiger waterstof-bonding netwerk heeft, waardoor het bulksysteem over het geheel genomen minder goed in staat is om te verdampen. Dit zou het hogere kookpunt van water ten opzichte van #”HF “# ondersteunen.
- Elektronegativiteiten van #bb(“F”)# en #bb(“O”)#
#”F “# is elektronegatiever, dus houdt het zijn elektronendichtheid gemakkelijker vast; dus wordt verwacht dat de eenparen zwakkere donors van waterstofbruginteracties zijn dan de eenparen op #”O “#.
Dit lijkt te voorspellen dat elke individuele waterstofbrug interactie zwakker is, wat het hogere kookpunt van water boven #”HF “# zou ondersteunen, MAAR dit wordt tegengesproken door het volgende punt.
- Gemiddelde ruwe waterstof-bonding sterktes in #bb(“HF”)# vs. water
#”O”-“H “cdotcdotcdot: “O”-#, #DeltaH_(“H”-“bond”) ~~ “21 kJ/mol “#
#”F”-“H “cdotcdotcdot: “F”-#, #DeltaH_(“H”-“bond”) ~~ “161.5 kJ/mol “#
Deze gegevens van Wikipedia suggereren dat #”HF “# sterkere waterstof-bond interacties heeft tussen #”HF “# moleculen dan in water.
Dit zou het experimentele bewijs dat #”HF “# een veel lager kookpunt heeft niet ondersteunen, maar dit is ook slechts een ruw getal en houdt geen rekening met, zeg, interactiehoeken in het bulksysteem.
- Geobserveerde waterstofbruggenhoeken en dimensies van interactie
#”HF “#, een lineair molecuul, heeft zigzag waterstofbruggenbruggen, in twee dimensies, met hoeken van #116^@#. Een meer optimale hoek zou bij 180^@# liggen, aangezien dat meer directe dipoolinteracties zou geven. Dit beperkt de waterstofbrugsterkte van #”HF “#.
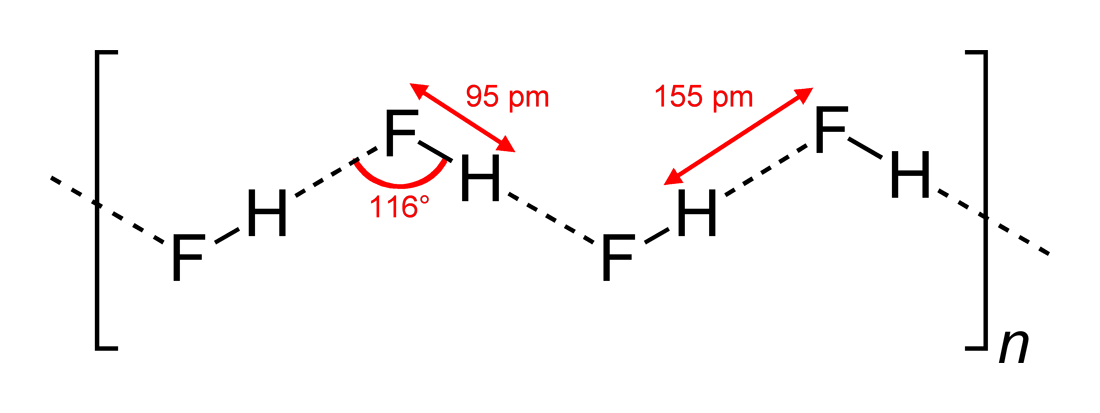
Water, dat een gebogen molecuul is met een tetrahedrale elektronengeometrie, kan waterstofbruggen in drie dimensies binden.
Hier ziet u een voorbeeld van de tetrahedrale cluster in de lokale omgeving van een waterstofbruginteractie in water:
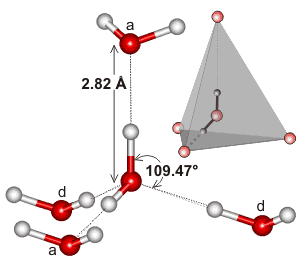
Het kan zijn dat de uitgebreidheid van het waterstofbruggennetwerk, en hoe het de neiging heeft om overeen te komen met de elektronengeometrie van water, ervoor zorgt dat het kookpunt van water zo hoog is. Dit zou het hogere kookpunt van water boven “HF” ondersteunen.
Over het geheel genomen zijn dit de minst belemmerende factoren die ik zou kunnen bedenken:
- Water kan een meer uitgebalanceerd waterstofbruggen-netwerk maken (twee acceptoren en twee donoren, in plaats van één donor en drie acceptoren), waardoor het bulksysteem een meer uniforme interactie heeft en dus sterker is in zijn geheel.
- Water vormt een uitgebreider waterstofbruggennetwerk (een driedimensionale tetrahedrale lokale omgeving, in plaats van een tweedimensionale zigzagomgeving), waardoor het bulksysteem minder gemakkelijk verdampbaar wordt.
- Water heeft over het algemeen een meer optimale hoek van interactie, omdat het meer overeenkomt met de elektronengeometrie van het molecuul en de interacties uitlijnt langs de moleculaire dipool, terwijl #”HF “# sterkere waterstofbruggen zou hebben (in termen van ruwe getallen) als de interacties lineair waren.
Leave a Reply