Kan de FT3-spiegel de opsporing van ontsteking of katabolisme en ondervoeding bij dialysepatiënten vergemakkelijken?
INLEIDING
Wijzigingen in de schildklierfunctie bij euthyroïde patiënten met ernstige aandoeningen worden in verband gebracht met een verminderde overleving. Wij spreken van het lage T3-syndroom om veranderingen in de schildklierfunctie te beschrijven die een hoog percentage van de bevolking treffen (tot 75% van de gehospitaliseerde patiënten)1 en die een daling van FT3, normaal of licht laag vrij T4 (FT4) en normaal thyrotropine (TSH) inhouden. Deze veranderingen worden geïnterpreteerd als het aanpassingsmechanisme van het lichaam bij ziekte en treden op wanneer er een daling is in de perifere omzetting van T4 en FT3, zonder dat er sprake is van een schildklier-specifieke ziekte. Een hoge prevalentie van lage FT3 niveaus werd ook beschreven bij patiënten met chronische nierziekte (CKD) zonder een voorgeschiedenis van schildklierziekte,2 en FT3 niveaus werden geïdentificeerd als onafhankelijke voorspellers van mortaliteit zowel bij hemodialyse (HD)3 als bij peritoneale dialyse (PD)4 patiënten. Het is niet bekend of de oorzaak van deze verlaging van FT3 gewoon het fysiologische aanpassingsmechanisme is dat het basismetabolisme verlaagt wanneer er sprake is van ziekte, of dat het een verandering is die samenhangt met CKD of dialyse en waarvan de correctie de overleving van deze patiënten zou kunnen helpen verbeteren. FT3-spiegels kunnen laag zijn bij CKD-patiënten vanwege verschillende mechanismen, zoals: 1) ondervoeding: Een vermindering van de voedselinname kan leiden tot een vermindering van de omzetting van T4 in FT3 en uiteindelijk tot een vermindering van de energie-output en een stopzetting van het eiwitkatabolisme; 2) ontsteking: Bij CKD treedt chronische ontsteking op die ook in verband kan worden gebracht met de afname van FT3 tijdens dialyse;4,5 3) nierfalen op zich: Dit wordt veroorzaakt door de accumulatie van uremische toxinen die de schildklierfunctie veranderen, zoals metabole acidose of een afname van de jodiumexcretie; of veranderingen geassocieerd met dialysetechnieken zoals het gebruik van heparine tijdens HD of kleine verliezen van T4 of T3 in de peritoneale effluent.2 Daarom zou een verminderde schildklierfunctie bij dialysepatiënten een marker kunnen zijn van ondervoeding-inflammatie, of secundair zijn aan chronisch nierfalen of de gebruikte dialysetechniek.
Het hoofddoel van deze studie was het evalueren van de incidentie van een laag T3-syndroom bij stabiele patiënten die dialyse ondergaan (HD en PD) en het verband met de verschillende markers van ondervoeding en ontsteking.
MATERIAAL EN METHODE
Dit is een beschrijvend, cross-sectioneel onderzoek, waarbij chronische dialysepatiënten (32 in HD en 11 in PD) in het Algemeen Ziekenhuis van Segovia gedurende de maand april 2008 betrokken waren. Alle patiënten waren al minstens 3 maanden chronisch gedialyseerd en waren klinisch stabiel. “Stabiel” werd gedefinieerd als geen ziekenhuisopnames, intercurrente infecties of ziekten geregistreerd tijdens de maand voorafgaand aan de studie. Elf patiënten werden later van het onderzoek uitgesloten: Vier wegens eerder vastgestelde schildklierziekte en zeven die medicatie gebruikten die de schildklierfunctie kon beïnvloeden.
De TSH, FT4 en FT3 van de dwarsdoorsnede werden gemeten door elektrochemiluminescentie-gebaseerde immunoanalyse (ECLIA), met behulp van een E170-analyser (Roche Diagnostics, Mannheim, Duitsland). De gevoeligheid voor de TSH-, FT4- en FT3-tests was respectievelijk 0,005mcU/l, 0,3pmol/l en 0,4pmol/l. De referentiewaarden waren: TSH 0,4-5mcU/l, FT4 11-23pmol/l en FT3 3,9-6,8pmol/l. We maten antityroïde antilichamen (anti-TPO en anti-TG) met behulp van een immunoabsorptietest (Aeskulisa Aesku Diagnostics, Duitsland) om auto-immuunziekten uit te sluiten (waarden boven 150U/ml voor anti-TPO of 50U/ml voor TG werden als positief beschouwd). Tegelijkertijd werden de biochemische en hematologische parameters die verband houden met voeding en ontsteking getest: albumine, prealbumine, transferrine, cholesterol, hematocriet, creatinine, pH, bicarbonaat en C-reactief proteïne (CRP), met behulp van routinematige laboratoriummethoden in ons ziekenhuis. Groeihormoon (GH) niveaus en de insuline-achtige groeifactor (IGF-1) werden ook vastgesteld met behulp van radio-immunoassay in een referentielaboratorium. De waarden worden uitgedrukt in ng/ml. De tests werden uitgevoerd vóór de eerste dialysesessie van de week; patiënten die ’s middags moesten worden gedialyseerd, kregen de instructie ten minste vier uur van tevoren te vasten.
De gemiddelde calorie- en eiwitinname per dag werd vastgesteld met behulp van het driedaagse voedingsonderzoek (softwareprogramma Dietsource 3.0 NovartisÆ) en werd gecorrigeerd op basis van het ideale gewicht van de patiënt. Het percentage vetten en koolhydraten werd genoteerd, evenals de inname van natrium, kalium en fosfor.
De voedingstoestand van de patiënt werd geëvalueerd aan de hand van antropometrische metingen die halverwege de week na de dialyse met standaardtechnieken6 werden uitgevoerd en die het volgende omvatten: lengte, gewicht, body mass index (BMI), triceps skinfold (TSF), armomtrek (AC) en armspieromtrek (AMC). De resultaten werden gestandaardiseerd door voor elk geval het percentage te berekenen ten opzichte van het 50e percentiel van de gegevens die werden verkregen uit een populatie van normale Spaanse volwassenen van dezelfde leeftijd en hetzelfde geslacht,7,8 waarbij als matig-ernstige tekorten werden beschouwd de gevallen die boven 80% van de normale populatie lagen.
Om een nauwkeuriger evaluatie van de voedingstoestand en de lichaamssamenstelling te verkrijgen, werd halverwege de week na de dialyse een bioimpedantievectoranalyse (BIVA) uitgevoerd (Vectorial BIA 101; Akern, Florencia, Italië), waarbij de weerstand (R), de reactantie (Xc), de fasehoek (PA), de natrium-kaliumuitwisseling (I Na/K), het totale lichaamswater (TBW), het extracellulaire water (ECW), het intracellulaire water (ICW), de celmassa, de celmassa-index (celmassa/hoogte2) (BCMI), de vetmassa (FM), de vetvrije massa (FFM) en de spiermassa werden gemeten. Deze gegevens werden vergeleken met de waarden van normale proefpersonen van dezelfde leeftijd en gewicht.9
Comorbiditeit werd geschat met behulp van de Charlson-index, gewijzigd door Beddhu.10 De dialysedosis werd gemeten door de KT/V te berekenen, en de eiwitinname werd geschat op basis van de genormaliseerde eiwitcatabolische snelheid voor het huidige gewicht (nPCR).
Statistische analyse
De statistische analyse werd uitgevoerd met behulp van het SPSS-softwarepakket, versie 11.0 voor Windows. De waarden werden uitgedrukt in percentages of gemiddelden ± SD; een waarde van p
RESULTATEN
De klinische kenmerken van de 32 patiënten zijn te vinden in tabel 1. De gemiddelde KT/V bij HD was1,6 ± 0,27, en bij PD was de gemiddelde wekelijkse KT/V 2,07 ± 0,27.
De gemiddelde schildklierhormoonwaarden waren als volgt: TSH 2,2 ± 1,5mcU/ml, FT4 14,7 ± 2,3pmol/l en FT3 4,0 ± 0,71pmol/l. Slechts twee patiënten (6,3%) hadden lage FT4-waarden en nog eens twee patiënten hadden een verhoogd TSH, terwijl 17 patiënten (53,1%) lage FT3-waarden hadden. We vonden geen correlatie tussen de niveaus van FT3, FT4 en TSH. Geen enkele patiënt vertoonde antityroïde antilichamen. Er waren geen significante verschillen tussen de FT3-niveaus volgens geslacht (4,2 ± 0,7 voor mannen vs. 3,8 ± 0,6 voor vrouwen; ns); de FT3-niveaus waren significant hoger bij PD dan bij HD (4,5 ± 0,4 vs. 3,8 ± 0,7; p = 0,016). Er waren geen verschillen in de FT3-spiegels naargelang het type dialyse. PD-patiënten vertoonden echter hogere concentraties TSH (3,5 ± 1,3 vs. 1,7 ± 1,3mcU/ml; p = 0,002), en de BMI was ook hoger bij PD-patiënten (30,6 ± 3,3 vs. 24,8 ± 4,4; p = 0,002) in vergelijking met HD-patiënten.
Om te bepalen waar de afname van FT3 bij dialyse mee samenhangt, hebben we de klinische, sociodemografische, analytische, antropometrische en BIVA-gegevens van patiënten met een laag FT3 vergeleken met de normale waarden die in ons laboratorium werden verkregen (
DISCUSSIE
Recentelijk, lage niveaus van FT32-4 die niet worden veroorzaakt door schildklierziekte maar het resultaat zijn van verslechtering van de perifere omzetting van FT4 naar FT3 beschreven bij een hoog percentage dialysepatiënten. Dit fenomeen kan vergelijkbaar zijn met andere incidenties beschreven bij verschillende chronische of acute ziekten,1 en staat bekend als het euthyroïde ziektesyndroom of het lage T3-syndroom. CKD verschilt echter van de rest van de gevallen van euthyroïd sick syndrome omdat het niet gepaard gaat met een toename van reverse T3 (rT3).11 Dit komt omdat, ondanks het feit dat de rT3 klaring bij nierpatiënten lager is, er een herverdeling van rT3 lijkt te zijn van de vasculaire naar de extravasculaire ruimte en een toename van de rT3 cellulaire opname.
Onze gegevens bevestigen de hoge incidentie van patiënten met lage FT3 niveaus (53%) die dialyse ondergaan en zonder enige bekende schildklierziekte, wat waarschijnlijk te wijten is aan deficiënte perifere conversie van T4 en FT3, aangezien de niveaus van FT3 niet correleerden met FT4 of TSH niveaus. Er is gesuggereerd dat de accumulatie van uremische toxines of metabole acidose kan bijdragen tot een daling van FT3.12 Wij vonden geen verband tussen pH- en bicarbonaatniveaus en FT3-niveaus. Wij vonden ook geen verband met de met KT/V gemeten dialyseringsdosis of met de tijd die patiënten aan dialyse hadden doorgebracht. Het is het overwegen waard dat de dialysedoses bij onze patiënten in het algemeen hoog waren (gemiddelde KT/V van HD-patiënten was 1,6 ± 0,27 en gemiddelde wekelijkse KT/V bij PD was 2,07 ± 0,27) en dat acidose relatief goed werd gecorrigeerd (pH 7,34 ± 0,6 en bicarbonaat 22,7 ± 2,8). Met betrekking tot het type dialyse vonden we dat PD-dialysepatiënten hogere FT3-spiegels hadden, wat enigszins in tegenspraak is met de verwachte resultaten, aangezien bij PD grotere verliezen van T4 en T3 in het effluent kunnen worden verwacht.13 Er is echter ook aangetoond dat deze verliezen minimaal zijn: Minder dan 10μg T4 en minder dan 0,1μg T3 per dag, wat minder is dan respectievelijk 10% en 1% met betrekking tot de T4- en T3-productie. Bijgevolg bevestigen onze bevindingen dat het gebrek aan perifere omzetting als reactie op ondervoeding veel belangrijker is dan peritoneaal verlies, en in het geval van deze studie registreerden PD-patiënten betere voedingsresultaten, waaronder een hogere BMI. Wij sluiten ons aan bij de bevindingen van andere auteurs en zijn van mening dat de daling van FT3 bij dialysepatiënten voornamelijk de adaptieve reactie van het lichaam op ziekte is, met als doel het basaalmetabolisme te verminderen en katabolismen te vermijden.2 In het geval van chronische ziekten is het soms moeilijk vast te stellen of de daling van FT3 veroorzaakt wordt door ziekteactiviteit of door ondervoeding die met de ziekteactiviteit gepaard gaat. De schildklierfunctie wordt niet alleen veranderd door vasten, maar ook door de samenstelling van het dieet; daarom veroorzaakt een verlaging van de koolhydraatinname een grotere verlaging van FT3 dan een verlaging van de eiwitinname. Een onvoldoende calorie-inname, zelfs bij een adequate eiwitinname, kan het “euthyroïde ziektesyndroom” veroorzaken.14 Wij vonden geen correlatie tussen FT3-niveaus en de totale calorie-inname (kcal/dag) of de gecorrigeerde calorie-inname op basis van het ideale of werkelijke gewicht. Wij vonden ook geen verschillen in de voedingssamenstelling tussen patiënten met een normale en een verlaagde FT3 en om die reden zijn wij terughoudend om de hypothese te ondersteunen dat een daling van FT3 bij dialysepatiënten te wijten is aan een onvoldoende inname. We vonden echter wel een verband tussen FT3-niveaus en enkele biochemische en antropometrische parameters van ondervoeding, zoals prealbumine, transferrine, BMI, AC, AMC of spiermassa gemeten met behulp van bioimpedantie. Het lijkt er dus op dat FT3-niveaus geassocieerd zijn met ondervoeding, maar niet met een gebrek aan calorie-inname. Bovendien vonden we een omgekeerd evenredige correlatie met het CRP-niveau. Tijdens infecties of sepsis is er een vermindering van schildklierhormonen door verschillende mechanismen, maar het gebeurt fundamenteel door een vermindering van de perifere omzetting van FT4 naar T3. De vermindering van schildklierhormonen is geassocieerd met de ernst van het proces15 en lijkt, althans gedeeltelijk, gemedieerd te worden door cytokinen.16,17 De chronische ontsteking die optreedt bij CKF lijkt ook geassocieerd te zijn met een afname van FT3 bij HD.4,5 In studies van Zocalli et al. werd bij beide typen dialysepatiënten een afname van FT3-niveaus gevonden in vergelijking met gezonde proefpersonen; zij geven ook aan dat FT3-niveaus omgekeerd correleren met niveaus van interleukine 6 en CRP. De mogelijkheid dat de daling van FT3 het gevolg is van ziekte of leeftijd, die wordt geassocieerd met een vermindering van het energiemetabolisme aan de basislijn, moet ook worden overwogen, maar in onze studie vonden we geen correlatie tussen FT3 en leeftijd of comorbiditeit in het algemeen, er was echter wel een correlatie met de ontstekingsparameters.
Onlangs heeft de International Society of Renal Nutrition and Metabolism (ISRNM)18 voorgesteld de term “ondervoeding” te vervangen door “eiwit-energieverspilling” (PEW) om deze situatie bij dialysepatiënten te definiëren, aangezien “ondervoeding” in de strikte zin van het woord “onvoldoende inname” betekent en de situatie die vaak bij deze patiënten wordt waargenomen een veranderd metabolisme is (overmatig metabolisme of gebrek aan anabolisme), bevorderd door ontstekingsbevorderende cytokinen, dat leidt tot het verlies van eiwit- of energievoorraden. Wij denken dat een daling van FT3 het aanpassingsmechanisme van het lichaam is om zich te verdedigen tegen eiwitverspilling, die niet veroorzaakt wordt door een gebrek aan inname, maar veeleer door ontsteking of het gebrek aan anaboliserende stoffen die met CKF in verband worden gebracht. In dit verband zijn de resultaten van een onderzoek van Lim et al.2 interessant, want hoewel doses FT3 toegediend aan normale proefpersonen de eiwitbalans niet veranderden, vertoonden HD-patiënten met lage FT3-niveaus een verhoogd katabolisme. Deze gegevens suggereren dat patiënten die een afname ervaren in de perifere omzetting van T4 naar FT3 zich verdedigen tegen een katabole situatie en dat T3 de eiwitondervoeding zou verergeren door het katabolisme te verhogen.
Op dit moment is er nog steeds geen betrouwbare marker voor spiermassa en eiwitkatabolisme bij dialysepatiënten, gezien het feit dat serumcreatinine of ureumgeneratie beïnvloed kunnen worden door de dialysedosis. Volgens de aanbevelingen van het ISRNM,18 zou het verlies van spiermassa in de PEW-criteria moeten worden opgenomen, aangezien dit zowel klinisch als prognostisch van groot belang kan zijn. Gezien de goede correlatie die in onze studie werd gevonden tussen FT3-niveaus en spiermassa, en rekening houdend met het feit dat FT3 waarschijnlijk snel varieert bij katabole ziekten, suggereren wij dat FT3-niveaus moeten worden gebruikt als een vroege indicator van katabolisme en als een marker om de respons te meten op bepaalde therapieën die dit trachten te behandelen, bijvoorbeeld om de respons op voedingssupplementen of anaboliserende stoffen te evalueren.
CONCLUSIE
De helft van onze dialysepatiënten vertoonde verlaagde niveaus van FT3 in serum zonder veranderde TSH of FT4 (laag FT3-syndroom). Deze verlaging lijkt veroorzaakt te worden door een verminderde perifere omzetting van FT4 naar FT3. Deze niveaus correleren fundamenteel met ondervoeding en ontstekingsparameters en kunnen worden beschouwd als een vroege marker voor katabolisme of PEW.
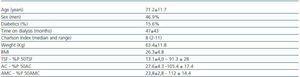
Tabel 1. Sociodemografische en antropometrische kenmerken
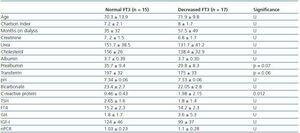
Tabel 2. Sociodemografische en analytische verschillen tussen patiënten met normaal FT3 (>3,95) en patiënten met verlaagd FT3
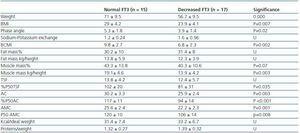
Tabel 3. Antropometrische en BIVA-verschillen tussen patiënten met normaal FT3 (> 3,95) en patiënten met verlaagd FT3
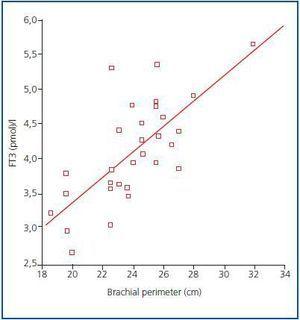
Figuur 1.
Leave a Reply