Frontiers in Oncology
Background
Radiation induced osteoporosis and resulting insufficiency fractures (IFs) are very common. De incidentie van IFs gemeld in de literatuur na abdominale of pelvische bestralingen varieert tussen 7 en 45% (1-8). In bepaalde oncologische situaties, zoals hormonale behandeling van borst- en prostaatkanker, zijn clinici bekend met behandelingsgerelateerde osteoporose en fractuurrisico (9-13). Dual-energy x-ray absorptiometry (DEXA) wordt routinematig besteld en preventieve maatregelen tegen osteoporose zoals calcium, vitamine D, of bifosfonaten worden profylactisch genomen tijdens de follow-up van de patiënten. Er is echter geen routinematige evaluatie van de gezondheidstoestand van de botten en stralingsoncologen zijn zich niet bewust van de stralingsgerelateerde bottoxiciteit en IF’s. Hoewel IF’s vaak worden aangetroffen bij de follow-up van patiënten na bestralingen van de buik of het bekken en tegenwoordig met een zeer hoge frequentie worden waargenomen na stereotactische bestralingen, worden DEXA of andere alternatieve metingen van de botmineraaldichtheid (BMD) in de bestralingsoncologische praktijk niet in overweging genomen (1-8, 14-16). Door de onwetendheid van bestralingsoncologen over IF’s, worden deze IF’s vaak niet herkend of kunnen soms worden beschouwd als de botmetastasen van de primaire kanker, wat resulteert in wanpraktijken en onnodige onderzoeken en psychologische stress voor patiënten.
Wij hebben onlangs 9,6% risico op wervelfracturen aangetoond bij patiënten die werden behandeld met abdominale bestraling (8). Wij zijn van mening dat het bot moet worden beschouwd als een orgaan dat risico loopt bij de planning van radiotherapie en dat de BMD bij deze patiënten voor en na de bestraling regelmatig moet worden gemeten en gevolgd. Bestralingsoncologen kunnen de botgezondheid van hun patiënten en niet herkende IF’s bepalen door gebruik te maken van hun belangrijkste instrument: het bestralingsbehandelingsplanningssysteem.
BMD is de maat voor de botmineraal- en calciumdichtheid en wordt bepaald door DEXA (17, 18). DEXA wordt momenteel beschouwd als de gouden standaardmethode voor BMD-kwantificatie en er is aangetoond dat er een correlatie bestaat met het fractuurrisico en de doeltreffendheid van de behandeling (17, 18). Verscheidene studies hebben aangetoond dat van de computergestuurde tomografie (CT) afgeleide Hounsfield-eenheden (HU’s) een sterke correlatie vertonen met de BMD die door DEXA wordt bepaald (19-22). HU waarden kunnen een betrouwbare schatting geven van de regionale botsterkte en BMD, en kunnen worden gebruikt om osteoporose met hoge nauwkeurigheid uit te sluiten (19-22). Bovendien kan met CT-scan, in vergelijking met DEXA, een nauwkeuriger identificatie van wervelfracturen worden verkregen (23). Diagnostische en bestralingsplanning CT scans worden besteld om ziekte te stadiëren, bestralingsbehandeling te plannen of om routinematig de patiënten op te volgen. We kunnen van de CT afgeleide HUs bij deze patiënten gebruiken om de BMD te bepalen en te controleren, en zo kunnen we extra kosten en extra stralingsbelasting van DEXA metingen vermijden. Naast deze voordelen kunnen sagittale wervelaanzichten die gemakkelijk uit CT-scans worden gereconstrueerd, worden gebruikt om niet-erkende en niet-symptomatische botbreuken te evalueren.
Het doel van de huidige studie is om verlies van botmineraaldichtheid en niet-gediagnosticeerde wervelfracturen aan te tonen door het meten van HU’s en sagittale reconstructie van wervels uit de CT-scans die zijn geïmporteerd naar het behandelingsplanningssysteem voor patiënten die worden behandeld met abdominale radiotherapie.
Methoden
Vijfenveertig opeenvolgende patiënten geopereerd voor maagadenocarcinoom die adjuvante abdominale radiotherapie kregen, werden opgenomen in de studiegroep. Vierendertig opeenvolgende patiënten met ziekte in een vroeg stadium die na de operatie geen adjuvante behandeling nodig hadden, vormden de controlegroep.
Bij de bestraalde patiënten werd bestraling toegediend met 6 of 15 MV fotonen door middel van conforme, intensiteitgemoduleerde, of volumetrisch gemoduleerde boogbehandelingsplanning. De voorgeschreven stralingsdosis was 46 Gy in 23 fracties met 2 Gy per dag, of 45 Gy in 25 fracties met 1, 8 Gy per dag, 5 dagen per week, gedurende 5 weken. Alle patiënten kregen ofwel bolus- ofwel infuusbehandeling met 5-fluorouracil, één cyclus vóór, twee cycli gelijktijdig met en één cyclus na de bestralingsbehandeling. Van alle patiënten werd geïnformeerde toestemming verkregen en de studie werd goedgekeurd door de plaatselijke ethische commissie van het ziekenhuis.
Planning en diagnostische tomografieën werden verkregen met behulp van multidetector CT-scanners (LightSpeed 16 slice of VCT 64 slice; GE Healthcare, Waukesha, WI) met slice-dikten van 3 of 5 mm. Abdominale tomografieën werden geïmporteerd uit het radiologie beeldarchiverings- en communicatiesysteem naar het Eclipse Treatment Planning System (TPS) (Varian Medical Systems, Palo Alto, CA). In de studiegroep was de eerste tomografie reeds in het behandelingsplanningssysteem voor de bestralingsplanning. De tweede werd 1 jaar na de radiotherapie verkregen en in het behandelingsplanningsysteem geïmporteerd. In de controlegroep werden abdominale tomografieën, verkregen net na de operatie en 1 jaar later, geïmporteerd in het planningsysteem. T12-L1-L2 wervellichamen werden gecontourd om de gemiddelde stralingsdosis voor elk wervellichaam bij de bestraalde patiënten te bepalen door een radiologisch oncoloog. Daarna bepaalde een ervaren radioloog met TPS de gemiddelde HU-waarden van dezelfde wervels voor alle patiënten. De gemiddelde HU-waarden voor beide groepen patiënten werden 1 jaar later opnieuw gemeten.
HU-waarden aan het begin van de studie en die verkregen 1 jaar later werden berekend voor elk wervellichaam bij elke groep en de procentuele verandering in HU’s (Δ%HU) werd bepaald. Hoewel de HU-metingen aan het begin en 1 jaar later werden gepland, bleven we de patiënten gedurende ten minste 5 jaar na de behandeling regelmatig volgen voor de oncologische uitkomst. Eventuele wervelcompressiefracturen werden vastgesteld aan de hand van sagittale reconstructies van wervels uit de computertomografieën tijdens de follow-ups.
HU-meettechniek
HU’s werden gemeten op de axiale dwarsdoorsneden van de trabeculaire gebieden van T12, L1, L2 wervellichamen. Elk wervellichaam werd verdeeld in drie axiale segmenten en HUs werden berekend door het plaatsen van rechthoekige regio van belang (ROI) over een gebied van trabeculaire bot op het wervellichaam. We hebben geprobeerd om de basivertebrale veneuze plexus posterior en subchondrale sclerotisch bot te vermijden. De metingen zijn gedetailleerd weergegeven in supplementaire figuur 1. De gemiddelde HU-waarden van drie axiale segmenten in elke wervel werden gemiddeld om de uiteindelijke HU-waarde voor elk wervellichaam te bepalen. HUpre staat voor de HU-waarde gemeten tijdens de eerste CT voor zowel de studie- als de controlegroep, terwijl HUpost de HU-waarde weergeeft gemeten na 1 jaar.
Statistische analyses
Percentage afname in botverzwakking (Δ%HU) voor elke wervel werd berekend met de volgende vergelijking:
Chi-kwadraatanalyses werden uitgevoerd om de verschillen tussen leeftijd, geslacht en tumorkenmerken van de groepen aan te tonen. Studenten t-toets werd gebruikt om de verschillen tussen pre- en post HU-waarden in elke groep en tussen twee groepen, en voor drie stralingsdosisniveaus (<20 Gy, 20-40 Gy, en >40 Gy) in de studiegroep te bepalen. Om het effect van de stralingsdosis op de verandering in Δ%HU rechtstreeks te beoordelen, werd Pearson’s correlatieanalyse uitgevoerd op Δ%HU en stralingsdosis. Een p-waarde van < 0,05 werd als significant beschouwd. De statistische analyse werd uitgevoerd met behulp van het Statistical Package for Social Sciences (SPSS) software 17.0.
Resultaten
De patiënt- en behandelingsgegevens worden gepresenteerd in tabel 1. Er was geen statistisch significant verschil tussen de groepen met betrekking tot leeftijd, geslacht, chirurgische resectie type, en tumor locatie. De gemiddelde HU waarden van de T12, L1, en L2 wervels werden gemeten in beide groepen. Aan het begin van de studie was er geen statistisch significant verschil in HU-waarden gemeten voor alle wervels tussen de studie- en de controlegroep. Terwijl de gemiddelde HU-waarden van de T12, L1, L2 wervels significant daalden in de studiegroep (p < 0,001 voor elke wervel) na 1 jaar, werd er geen significante verandering in HU-waarden gevonden in de controlegroep (p: 0,09-0,08-0,24, respectievelijk) gedurende dezelfde periode. Tabel 2 geeft een overzicht van de veranderingen in HU-waarden voor de studie- en de controlegroep.
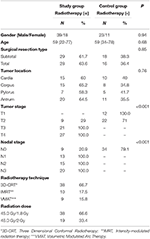
Tabel 1. Patiënt- en behandelingskenmerken.

Tabel 2. Vergelijking van HU’s in beide groepen zelf en tussen de twee groepen voor elke wervel.
De gemiddelde stralingsdoses voor T12, L1, en L2 wervels in de studiegroep waren respectievelijk 34.55 ± 11.1; 31.82 ± 12.4; 30.37 ± 13.6 Gy. Er werd een negatieve en significante correlatie gevonden tussen Δ%HU en de door elke wervel ontvangen stralingsdosis. Naarmate de stralingsdosis toenam, daalde het HU-percentage in elke wervel. Dit wordt samengevat in de figuren 1-3.
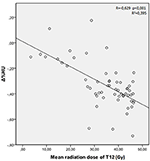
Figuur 1. Correlatie tussen Δ%HU en de door de T12 wervel ontvangen stralingsdosis.
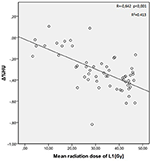
Figuur 2. Correlatie tussen Δ%HU en de door de L1 wervel ontvangen stralingsdosis.
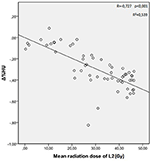
Figuur 3. Correlatie tussen Δ%HU en de door de L2 wervel ontvangen stralingsdosis.
De relatie tussen de door de wervel ontvangen stralingsdosis en de HU-verandering is samengevat in tabel 3. Hoewel de afname van de HU-waarden statistisch significant was bij stralingsdoses boven 20 Gy, waren de HU-waarden niet significant veranderd bij stralingsdoses onder 20 Gy, behalve voor de L2 wervels.

Tabel 3. Verandering in HU’s met betrekking tot bestralingsdosisgroepen.
Fracturen
Terwijl geen enkele patiënt in de controlegroep fracturen had, ontwikkelden 4 van de 57 patiënten (%7) in de bestraalde groep wervelfracturen gedurende het verloop van de studie. Terwijl twee van de wervelfracturen werden waargenomen bij vrouwen, werden twee van hen waargenomen bij mannen. De fracturen werden vastgesteld in de 16e, 18e, 20e en 26e maand na de bestraling, met een mediane follow-up tijd van 24 maanden (bereik: 12-36 maanden). Fracturen werden waargenomen in L1 wervel bij drie patiënten, en in L2 wervel bij één patiënt. De gemiddelde stralingsdosis ontvangen door elke gebroken wervel was als volgt; 39, 28.5, 22.3, 31 Gy. Kenmerken van de patiënten met wervelfracturen zijn samengevat in aanvullende tabel 1 en aanvullende figuur 2.
Discussie
Radiotherapie leidt tot osteoporose door directe en indirecte mechanismen en IFs ontwikkelen zich vaak na bekken- of abdominale bestralingen in de klinische praktijk (1-8). IFs in de wervelkolom en het bekkengebied komen vaak voor en vormen een belangrijke late bijwerking van radiotherapie. Bestralingsoncologen zijn zich echter niet bewust van door bestraling veroorzaakte osteoporose en bottoxiciteit. Omdat zij zich niet bewust zijn van de bottoxiciteit van bestraling, wordt geen speciale aandacht besteed aan het voorkomen van deze belangrijke late complicatie. In onze vorige studie (8) hebben wij getracht het belang van dit probleem te benadrukken en meldden wij een zeer hoge incidentie van wervelfracturen na abdominale bestralingen zoals bij de patiënten die werden bestraald voor bekkentumoren (1-7).
De bestralingsoncologen besteden tijdens de planning van de bestraling veel aandacht aan de stralingsdosis die wordt ontvangen door elk orgaan dat risico loopt. Hoewel de graad III/IV late toxiciteitspercentages voor deze zeer nauwlettend gevolgde complicaties niet boven bepaalde percentages liggen, zijn de aan abdominale of bekkenbestraling gerelateerde bottoxiciteit en de daaruit voortvloeiende fracturen inderdaad hoger dan de bekende graad III/IV late toxiciteiten. Terwijl dosisbeperkingen goed gedefinieerd zijn voor organen waarvan bekend is dat zij risico lopen en bepalend zijn voor de uiteindelijke goedkeuring van het plan, is dit niet het geval voor botweefsel.
Zelfs in de laatste versie van de Common Terminology Criteria for Adverse Events (CTCAE) versie 5.0 is er geen specifieke definitie van bottoxiciteit als gevolg van bestraling (24). In de bestralingsoncologische praktijk bestaan er geen criteria voor de beoordeling van de toxiciteit voor botten. Noch in de scoringstabellen voor late toxiciteit van LENT-SOMA, noch in het rapport Quantitative Analyses of Normal Tissue Effects in the Clinic (QUANTEC) is bot gedefinieerd als een orgaan dat risico loopt, en er zijn geen dosis- en volumebeperkingen voor dit weefsel vastgesteld (25, 26). De vorige studies en onze onlangs gepubliceerde studie hebben echter aangetoond dat ernstig rekening moet worden gehouden met osteoporose en het risico van fracturen, en dat de nodige voorzorgsmaatregelen moeten worden genomen tijdens de follow-up van bestraalde patiënten om stralingsgerelateerde fracturen te voorkomen (1-8).
DEXA is de gouden standaardmethode voor BMD-kwantificatie en routinescreening voor osteoporose. Bestralingsoncologen bestellen geen DEXA voor hun patiënten die bekken- of abdominale bestraling ondergaan. Zij consulteren deze patiënten niet bij de endocrinoloog voor de beoordeling van het fractuurrisico en de aanwezigheid van osteoporose vóór elke bestralingsbehandeling. Als bestralingsoncologen kunnen wij echter ons planningssysteem gebruiken om de BMD en het risico op osteoporose te bepalen. Deze evaluaties kunnen gemakkelijk worden gemaakt via CT-scans die worden besteld voor de stadiëring van de ziekte, voor de planning van de bestraling en voor de follow-up van de patiënten. We kunnen BMD afname, osteoporose, en onopgemerkte fracturen bepalen door het meten van HU waarden van het bot van de CT scans van de patiënten geïmporteerd in het planningsysteem, en door het construeren van sagittale beelden van de bestraalde botgebieden.
Er is recent gesuggereerd dat CT afgeleide HU waarden van het bot kunnen worden gebruikt om patiënten met verminderde BMD en osteoporose te identificeren (19-22, 27-30). Pickhardt et al. (22) hebben duidelijk omschreven hoe de bot HU waarden kunnen worden gemeten en gebruikt als alternatief voor DEXA voor het vaststellen van BMD en osteoporose diagnoses. In deze studies worden HU-waarden voor het bot onder 100 beschouwd als indicatie voor osteoporose, HU-waarden tussen 100 en 160 worden beschouwd als indicatie voor osteopenie, en HU-waarden boven 160 wijzen op een normale botmineraaldichtheid (19-22). Patiënten met HU-waarden boven 160 hebben een normale botdichtheid en hoeven dus geen DEXA-meting te ondergaan en zich geen zorgen te maken over de gezondheid van hun botten. Patiënten met HU-waarden tussen 100 en 160 kunnen worden beschouwd als osteopenisch, en zij moeten vroegtijdig worden ingegrepen om osteoporose en het risico op botbreuken in de toekomst te voorkomen. Patiënten met HU-waarden onder 100 moeten als osteoporotisch worden beschouwd. Lage HU-waarden moeten de bestralingsoncoloog waarschuwen voor een verhoogd fractuurrisico in botgebieden die aan straling zullen worden blootgesteld. Deze patiënten moeten met de endocrinoloog worden geraadpleegd alvorens een bestralingsbehandeling toe te passen. In studies waarin HUs werden vergeleken met DEXA voor botmineraaldichtheid en bepaling van osteoporose, werden bij sommige patiënten die met DEXA in de niet-osteoporotische groep vielen, wervelfracturen ontdekt tijdens de bepaling van HUs op basis van CT-scans (22, 29-31).
In onze studie probeerden we een gemakkelijke manier te vinden voor bestralingsoncologen om osteoporose te diagnosticeren en fractuurrisico te bepalen. Als we deze metingen implementeren in de dagelijkse routine tijdens de bestralingsplanning, kunnen we osteopenie, osteoporose en fractuurrisico bepalen bij patiënten die abdominale of bekken radiotherapie zullen krijgen en vroegtijdig ingrijpen om late bottoxiciteit door bestraling te voorkomen.
Terwijl er geen statistisch significant verschil was in HU-waarden van T12, L1, L2 wervels verkregen op baseline en 1 jaar later in de controlegroep, daalden de HU-waarden significant bij de bestraalde patiënten. Alleen bij de bestraalde patiënten vonden wij wervelfracturen. Vier van de 57 patiënten hadden wervelfracturen na een mediane follow-up van 24 maanden, met een cumulatief incidentiecijfer van 7% fracturen. Hoewel de follow-up tijd kort was en de meeste fracturen asymptomatisch waren, rapporteerden wij 9,6% fracturen in onze vorige studie, met een langere follow-up tijd, en de meeste van deze fracturen waren symptomatisch (8). Het hoge risico op botbreuken bij deze patiënten verdient aandacht en het bot moet worden beschouwd als een orgaan dat risico loopt. De gerapporteerde tijd voor het ontwikkelen van fracturen na radiotherapie varieerde tussen 2 en 63 maanden (2, 14). Interessant is dat fracturen als graad IV late stralingstoxiciteit worden waargenomen met een hogere incidentie dan andere bekende late stralingstoxiciteiten zoals stralingsfibrose, cystitis, proctitis, enz.
De afname in HU was dosisafhankelijk. Er was een grotere kans op afname van de HU-waarden van het bot bij hogere stralingsdoses die door de wervels werden ontvangen. Wij vonden echter dat de afname in HU waarden niet significant was voor de wervellichamen die blootgesteld waren aan stralingsdoses lager dan 20 Gy.
In de literatuur zijn er tegenstrijdige bevindingen met betrekking tot de stralingsdosis waarbij BMD verlies wordt waargenomen. Terwijl een studie BMD-verlies aantoonde bij patiënten die werden behandeld met 22,5 Gy bekkenbestraling, toonde een andere studie geen correlatie aan tussen de stralingsdosis en het risico op insufficiëntiefracturen (32, 33). Wei et al. (33) rapporteerden dat zelfs 5 Gy wervel bestralingsdoses resulteren in significante BMD reductie en IFs bij patiënten die werden behandeld met abdominale radiotherapie. Zij bevelen ook aan de stralingsdosis te beperken tot de wervellichamen, vooral bij patiënten met lage HU-waarden die tijdens de planning van de bestraling werden vastgesteld. Er moet dus een dosisbeperking worden vastgesteld voor de wervels binnen het bestralingsveld. De dosisbeperkingen kunnen variëren afhankelijk van de HU-waarden die tijdens de planning van de bestraling zijn gemeten. We moeten proberen de gemiddelde stralingsdosis voor de wervelbeenderen binnen het bestralingsveld te verlagen, vooral bij ouderen en patiënten die al osteoporotisch zijn.
Conclusies
Radiation induced osteoporosis and resulting insufficiency fractures (IFs) are very common. BMD afname, osteoporose, en onopgemerkte fracturen kunnen worden opgespoord door het meten van HU waarden van het bot van de CT scans van de patiënten geïmporteerd in het planningsysteem, en door het reconstrueren van sagittale beelden van de bestraalde botgebieden. Bij patiënten bij wie tijdens de bestralingsplanning reeds lage HU-waarden van het bot worden vastgesteld, kan vroegtijdig worden ingegrepen om de gezondheid van het bot te herstellen en toekomstige bestralingsgerelateerde fracturen te voorkomen. Om bottoxiciteit als gevolg van bestraling te voorkomen, moet de stralingsdosis voor de wervelbeenderen met reeds lage HU-waarden op het moment van de planning van de behandeling worden beperkt tot minder dan 20 Gy.
Data Availability Statement
Materialen beschreven in het artikel, met inbegrip van alle relevante ruwe gegevens, zijn vrij beschikbaar voor elke wetenschapper die ze wil gebruiken voor niet-commerciële doeleinden, zonder de vertrouwelijkheid van de deelnemers te schenden en kunnen worden verkregen bij de corresponderende auteur.
Ethics Statement
Onze studie is uitgevoerd in overeenstemming met de Verklaring van Helsinki. De studie werd goedgekeurd door de ethische commissie van het Dr. Lutfi Kirdar Kartal Onderwijs- en Onderzoeksziekenhuis (2017/514/109/2). Schriftelijke geïnformeerde toestemming is verkregen van alle deelnemers aan de studie.
Author Contributions
GY: borg voor integriteit van de gehele studie. GY en CG: studie concepten en ontwerp. NC: literatuuronderzoek. GY, CG, IK, OS, en NC: klinische studies. GY: statistische analyse. OS: manuscript voorbereiding. CG: manuscript redactie. Alle auteurs hebben het definitieve manuscript gelezen en goedgekeurd.
Conflict of Interest
De auteurs verklaren dat het onderzoek werd uitgevoerd in afwezigheid van commerciële of financiële relaties die zouden kunnen worden opgevat als een potentieel belangenconflict.
Supplementary Material
Het Supplementary Material voor dit artikel is online te vinden op: https://www.frontiersin.org/articles/10.3389/fonc.2020.00742/full#supplementary-material
Afkortingen
IFs, insufficiëntiefracturen; DEXA, Dual energy x-ray absorptiometry; BMD, botmineraaldichtheid; CT, gecomputeriseerde tomografie; HU, Hounsfield-eenheid; Δ%HU, procentuele verandering in HU; ROI, Regio van belang; SPSS, Statistisch pakket voor de sociale wetenschappen; CTCAE, Gemeenschappelijke terminologiecriteria voor ongewenste voorvallen; QUANTEC, Kwantitatieve analyses van normale weefseleffecten in de kliniek.
1. Oh D, Huh SJ. Insufficiëntiefractuur na bestralingstherapie. Radiat Oncol J. (2014) 32:213-20. doi: 10.3857/roj.2014.32.4.213
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Higham CE, Faithfull SJ. Bone health and pelvic radiotherapy. Clin Oncol. (2015) 11:668-78. doi: 10.1016/j.clon.2015.07.006
CrossRef Full Text | Google Scholar
3. Shih KK, Folkert MR, Kollmeier MA, Abu-Rustum NR, Sonoda Y, Leitao MM Jr, et al. Pelvic insufficiency fractures in patients with cervical and endometrial cancer treated with postoperative pelvic radiation. Gynecol Oncol. (2013) 128:540-3. doi: 10.1016/j.ygyno.2012.12.021
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Uezono H, Tsujino K, Moriki K, Nagano F, Ota Y, Sasaki R, et al. Pelvic insufficiency fracture after definitive radiotherapy for uterine cervical cancer: retrospective analysis of risk factors. J Radiat Res. (2013) 54:1102-9. doi: 10.1093/jrr/rrt055
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Igdem S, Alco G, Ercan T, Barlan M, Ganiyusufoglu K, Unalan B, et al. Insufficiëntiefracturen na bekkenradiotherapie bij patiënten met prostaatkanker. Int J Radiat Oncol Biol Phys. (2010) 77:818-23. doi: 10.1016/j.ijrobp.2009.05.059
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Schmeler KM, Jhingram A, Iyer RB, Sun CC, Eifel PJ, Soliman PT, et al. Pelvic fractures after radiotherapy for cervical cancer: implications for survivors. Kanker. (2010) 116:625-30. doi: 10.1002/cncr.24811
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Kim HJ, Boland PJ, Meredith DS, Lis E, Zhang Z, Shi W, et al. Fracturen van het sacrum na chemoradiatie voor rectumcarcinoom: incidentie, risicofactoren, en radiografische evaluatie. Int J Radiat Oncol. (2012) 84:694-9. doi: 10.1016/j.ijrobp.2012.01.021
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Yaprak G, Gemici C, Temizkan S, Ozdemir S, Dogan BC, Seseogullari OO. Ontwikkeling van osteoporose en wervelfracturen na abdominale bestraling bij patiënten met maagkanker. BMC Cancer. (2018) 18:972. doi: 10.1186/s12885-018-4899-z
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Lustberg MB, Reinbolt RE, Shapiro CL. Bone health in adult cancer survivorship. J Clin Oncol. (2012) 30:3665-74. doi: 10.1200/JCO.2012.42.2097
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Coleman R, Body JJ, Aapro M, Hadji P, Herrstedt J, ESMO Guidelines Working Group. Botgezondheid bij kankerpatiënten: ESMO richtlijnen voor klinische praktijk. Ann Oncol. (2014) 25:124-37. doi: 10.1093/annonc/mdu103
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Pfeilschifter J, Diel IJ. Osteoporosis due to cancer treatment: pathogenesis and management. J Clin Oncol. (2000) 18:1570-93. doi: 10.1200/JCO.2000.18.7.1570
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Hadji P, Gnant M, Body JJ, Bundred NJ, Brufsky A, Coleman RE, et al. Cancer treatment-induced bone loss in premenopausal women: a need for therapeutic intervention? Cancer Treat Rev. (2012) 38:798-806. doi: 10.1016/j.ctrv.2012.02.008
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Skolarus TA, Caram MV, Shahinian VB. Androgen-deprivation-associated bone disease. Curr Opin Urol. (2014) 24:601-7. doi: 10.1097/MOU.000000000101
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Boehling NS, Grosshans DR, Allen PK, McAleer MF, Burton AW, Azeem S, et al. Vertebral compression fracture risk after stereotactic body radiotherapy for spinal metastases. J Neurosurg Spine. (2012) 16:379-86. doi: 10.3171/2011.11.SPINE116
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Cunha MV, Al-Omair A, Atenafu EG, Masucci GL, Letourneau D, Korol R, et al. Vertebral compression fracture (VCF) after spine stereotactic body radiation therapy (SBRT): analysis of predictive factors. Int J Radiat Oncol Biol Phys. (2012) 84:343-9. doi: 10.1016/j.ijrobp.2012.04.034
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Jawad MS, Fahim DK, Gerszten PC, Flickinger JC, Sahgal A, Grills IS, et al. Vertebral compression fractures after stereotactic body radiation therapy: a large, multi-institutional, multinational evaluation. J Neurosurg Spine. (2016) 24:928-36. doi: 10.3171/2015.10.SPINE141261
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Marshall D, Johnell O, Wedel H. Meta-analyse van hoe goed maten van botmineraaldichtheid het optreden van osteoporotische fracturen voorspellen. BMJ. (1996) 312:1254-9. doi: 10.1136/bmj.312.7041.1254
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Kanis JA, McCloskey EV, Johansson H, Oden A, Melton LJ 3rd, Khaltaev N. A reference standard for the description of osteoporosis. Bone. (2008) 42:467-75. doi: 10.1016/j.bone.2007.11.001
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Schreiber JJ, Anderson PA, Rosas HG, Buchholz AL, Au AG. Hounsfield units for assessing bone mineral density and strength: a tool for osteoporosis management. J Bone Joint Surg Am. (2011) 93:1057-63. doi: 10.2106/JBJS.J.00160
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Schreiber JJ, Anderson PA, Hsu WK. Use of computed tomography for assessing bone mineral density. Neurosurg Focus. (2014) 37:E4. doi: 10.3171/2014.5.FOCUS1483
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Batawil N, Sabiq S. Hounsfield unit voor de diagnose van botmineraaldichtheidsziekte: een proof of concept studie. Radiografie. (2016) 22:93-8. doi: 10.1016/j.radi.2015.11.004
CrossRef Full Text | Google Scholar
22. Pickhardt PJ, Pooler BD, Lauder T, del Rio AM, Bruce RJ, Binkley N. Opportunistic screening for osteoporosis using abdominal computed tomography scans obtained for other indications. Ann Intern Med. (2013) 158:588-95. doi: 10.7326/0003-4819-158-8-201304160-00003
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Lenchik L, Shi R, Register TC, Beck SR, Langefeld CD, et al. Measurement of trabecular bone mineral density in the thoracic spine using cardiac gated quantitative computed tomography. J Comput Assist Tomogr. (2004) 28:134-9. doi: 10.1097/00004728-200401000-00023
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Common Terminology Criteria for Adverse Events (CTCAE). Versie 5.0. U.S. Department of Health and Human Services, National Institutes of Health National Cancer Institute. Maryland (2017).
25. Overgaard J, Bartelink H. Late effecten Consensus Conferentie: RTOG/EORTC. Radiother Oncol. (1995) 35:1-82. doi: 10.1016/0167-8140(95)01548-U
CrossRef Full Text | Google Scholar
26. Bentzen SM, Constine LS, Deasy JO, Eisbruch A, Jackson A, Marks LB. Quantitative analyses of normal tissue effect in the clinic (QUANTEC): an introduction to the scientific issues. Int J Radiat Oncol Biol. Phys. (2010) 76(3 Suppl):S3-S9. doi: 10.1016/j.ijrobp.2009.09.040
CrossRef Full Text | Google Scholar
27. Buckens CF, Dijkhuis G, de Keizer B, Verhaar HJ, de Jong PA. Opportunistische screening op osteoporose bij routine computertomografie? Een externe validatiestudie. Eur Radiol. (2015) 25:2074-9. doi: 10.1007/s00330-014-3584-0
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Emohare O, Cagan A, Morgan R, Davis R, Asis M, Switzer J, et al. The use of computed tomography attenuation to evaluate osteoporosis following acute fractures of the thoracic and lumbar vertebra. Geriatr Orthop Surg Rehabil. (2014) 5:50-5. doi: 10.1177/2151458514525042
PubMed Abstract |Ref Full Text | Google Scholar
29. Alacreu E, Moratal D, Arana E. Opportunistic screening for osteoporosis by routine CT in Southern Europe. Osteoporos Int. (2017) 28:983-90. doi: 10.1007/s00198-016-3804-3
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Lee S, Chung CK, Oh SH, Park SB. Correlatie tussen botmineraaldichtheid gemeten door dual-energy X-ray absorptiometry en hounsfield units gemeten door diagnostische CT in lumbale wervelkolom. Korean Neurosurg Soc. (2013) 54:384-9. doi: 10.3340/jkns.2013.54.5.384
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Miyabara Y, Holmes D, Camp J, Miller VM, Kearns AE. Comparison of calibrated and uncalibrated bone mineral density by CT to DEXA in menopausal women. Climacteric. (2012) 15:374-81. doi: 10.3109/13697137.2011.618566
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Park SH, Kim JC, Lee JE, Park IK. Bekkeninsufficiëntiefractuur na radiotherapie bij patiënten met baarmoederhalskanker in het tijdperk van PET/CT. Radiat Oncol J. (2011) 29:269-76. doi: 10.3857/roj.2011.29.4.269
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Wei RL, Jung BC, Manzano W, Sehgal V, Klempner SJ, Lee SP, et al. Bone mineral density loss in thoracic and lumbar vertebrae following radiation for abdominal cancers. Radiother Oncol. (2016) 118:430-6. doi: 10.1016/j.radonc.2016.03.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Leave a Reply