8.3: Gassen en druk
Leerdoelen
- De gasfase beschrijven.
De gasfase is uniek onder de drie toestanden van de materie in zoverre dat er enkele eenvoudige modellen zijn die we kunnen gebruiken om het fysische gedrag van alle gassen te voorspellen – onafhankelijk van hun identiteit. We kunnen dit niet doen voor de vaste en vloeibare fase. In feite vormt de ontwikkeling van dit begrip van het gedrag van gassen het historische scheidingspunt tussen de alchemie en de moderne scheikunde. De eerste vorderingen in het begrip van het gedrag van gassen werden gemaakt in het midden van de jaren 1600 door Robert Boyle, een Engelse wetenschapper die de Royal Society oprichtte (een van ’s werelds oudste wetenschappelijke organisaties).
Hoe komt het dat wij alle gassen kunnen modelleren onafhankelijk van hun chemische identiteit? Het antwoord ligt in een groep stellingen die de kinetische theorie van gassen wordt genoemd:
- Gassen bestaan uit minuscule deeltjes die door grote afstanden van elkaar worden gescheiden.
- Gasdeeltjes zijn voortdurend in beweging, en ondervinden botsingen met andere gasdeeltjes en de wanden van hun container.
- De snelheid van gasdeeltjes is gerelateerd aan de temperatuur van een gas.
- Gasdeeltjes ondervinden geen aantrekkings- of afstotingskracht van elkaar.
Heb je opgemerkt dat geen van deze beweringen betrekking heeft op de identiteit van het gas? Dit betekent dat alle gassen zich op dezelfde manier moeten gedragen. Een gas dat deze uitspraken perfect volgt, wordt een ideaal gas genoemd. De meeste gassen vertonen kleine afwijkingen van deze verklaringen en worden echte gassen genoemd. Het bestaan van echte gassen doet echter niets af aan het belang van de kinetische theorie van gassen.
Een van de stellingen van de kinetische theorie heeft betrekking op botsingen. Aangezien gasdeeltjes voortdurend in beweging zijn, botsen zij ook voortdurend met elkaar en met de wanden van hun vat. Er komen krachten bij kijken als gasdeeltjes tegen de wanden van de container botsen (figuur). De door de gasdeeltjes opgewekte kracht gedeeld door de oppervlakte van de wanden van het vat levert de druk op. Druk is een eigenschap die we kunnen meten voor een gas, maar we houden doorgaans geen rekening met druk voor vaste stoffen of vloeistoffen.
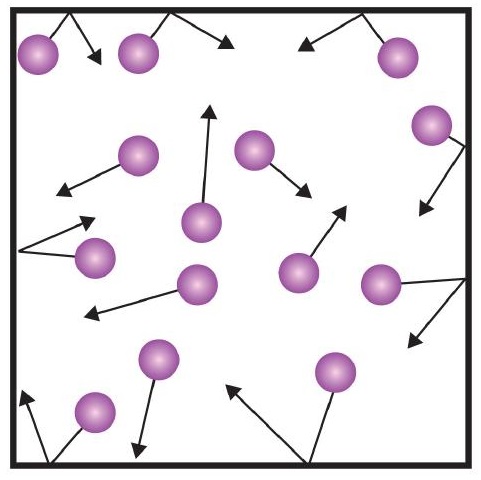
De basiseenheid van druk is de newton per vierkante meter (N/m2). Deze gecombineerde eenheid wordt herdefinieerd als pascal (Pa). Eén pascal is niet een erg grote hoeveelheid druk. Een meer bruikbare eenheid van druk is de bar, die 100.000 Pa is (1 bar = 100.000 Pa). Andere veelgebruikte eenheden van druk zijn de atmosfeer (atm), die oorspronkelijk werd gedefinieerd als de gemiddelde druk van de atmosfeer van de aarde op zeeniveau; en mmHg (millimeter kwik), de druk die wordt opgewekt door een kwikkolom van 1 mm hoog. De eenheid millimeter kwik wordt ook wel torr genoemd, naar de Italiaanse wetenschapper Evangelista Torricelli, die in het midden van de jaren 1600 de barometer uitvond. Een nauwkeuriger definitie van atmosfeer, in termen van torr, is dat er precies 760 torr zijn in 1 atm. Een bar is gelijk aan 1,01325 atm. Gezien alle relaties tussen deze drukeenheden, is het kunnen omrekenen van de ene drukeenheid naar de andere een nuttige vaardigheid.
Voorbeeld: Drukken omrekenen
Schrijf een omrekenfactor om te bepalen hoeveel atmosfeer er in 1.547 mmHg zit.
Oplossing
Omdat 1 mmHg gelijk is aan 1 torr, is de gegeven druk ook gelijk aan 1.547 torr. Omdat er 760 torr in 1 atm zitten, kunnen we deze omrekeningsfactor gebruiken om de wiskundige omrekening te doen:
(\mathrm{1,547: torr} maal \dfrac{1: atm}{760: torr}=2.04: atm})
Zie hoe de torr-eenheden algebraïsch opheffen.
Oefening: (Pagina-index{1}): Drukken omrekenen
Schrijf een omrekenfactor om te bepalen hoeveel millimeter kwik er in 9,65 atm zit.
Antwoord
(\mathrm{9,65: atm} maal \dfrac{760: mm Hg}{1: atm}=7,334: mm Hg})
De kinetische theorie stelt ook dat er geen wisselwerking is tussen individuele gasdeeltjes. Hoewel we weten dat er wel degelijk intermoleculaire interacties zijn in echte gassen, gaat de kinetische theorie ervan uit dat de gasdeeltjes zo ver uit elkaar liggen dat de individuele deeltjes elkaar niet “voelen”. Zo kunnen we gasdeeltjes behandelen als kleine stukjes materie waarvan de identiteit niet belangrijk is voor bepaalde fysische eigenschappen.
Oefening voor begripsherziening
-
Wat is druk, en welke eenheden gebruiken we om het uit te drukken?
Antwoord
-
Druk is de kracht per oppervlakte-eenheid; de eenheden ervan kunnen pascal, torr, millimeters kwik, of atmosfeer zijn.
Key Takeaway
- De gasfase heeft bepaalde algemene eigenschappen die kenmerkend zijn voor die fase.
Oefeningen
-
Wat is de kinetische theorie van gassen?
-
Volgens de kinetische theorie van gassen zijn de afzonderlijke gasdeeltjes (altijd, vaak, nooit) in beweging.
-
Waarom oefent een gas druk uit?
-
Waarom laat de kinetische theorie van gassen toe om aan te nemen dat alle gassen een gelijkaardig gedrag zullen vertonen?
-
Rangschik de volgende drukgrootheden in volgorde van klein naar groot: 1 mmHg, 1 Pa, en 1 atm.
-
Welke eenheid van druk is groter-de torr of de atmosfeer?
-
Hoeveel torr zitten er in 1.56 atm?
-
Bereken 760 torr in pascal.
-
Bloeddruk wordt uitgedrukt in millimeters kwik. Wat zou de bloeddruk in atmosfeer zijn als de systolische bloeddruk van een patiënt 120 mmHg is en de diastolische bloeddruk 82 mmHg? (In de geneeskunde zou een dergelijke bloeddruk worden gerapporteerd als “120/82”, uitgesproken als “honderdtwintig over tweeëntachtig.”)
-
In weersvoorspellingen wordt de barometerdruk uitgedrukt in inch kwik (in. Hg), waarbij er precies 25,4 mmHg in elke 1 in. Hg is. Wat is de barometrische druk in millimeters kwik als de barometrische druk wordt gerapporteerd als 30,21 in. Hg?
Antwoorden
-
Gassen zijn samengesteld uit minuscule deeltjes die door grote afstanden van elkaar worden gescheiden. Gasdeeltjes zijn voortdurend in beweging en komen in botsing met andere gasdeeltjes en met de wanden van hun reservoir. De snelheid van gasdeeltjes is gerelateerd aan de temperatuur van een gas. Gasdeeltjes ondervinden geen aantrekkings- of afstotingskracht van elkaar.
-
Een gas oefent druk uit doordat zijn deeltjes weerkaatsen tegen de wanden van zijn container.
-
1 Pa, 1 mmHg, en 1 atm
-
1.190 torr
9. 0,158 atm; 0,108 atm
10. 767,3 mm Hg
Leave a Reply