FT3値は透析患者における炎症または異化作用と栄養失調の検出を容易にすることができるか? | Nefrología
INTRODUCTION
重症患者の甲状腺機能異常は、生存率の低下と関連しています。 我々は、人口の高い割合(入院患者の75%まで)に影響し、FT3の減少、正常またはわずかに低い遊離T4(FT4)および正常なサイロトロトロピン(TSH)を伴う甲状腺機能の変化を説明するために、低T3症候群と呼んでいる1。 これらの変化は、病気に直面したときの身体の適応機構と解釈され、甲状腺特有の病気が存在しなくても、T4とFT3の末梢変換が減少するときに起こります。 甲状腺疾患の既往がない慢性腎臓病(CKD)患者2においても、FT3値の低下が高い頻度で認められ、血液透析(HD)3および腹膜透析(PD)4患者において、FT3値は死亡率の独立した予測因子として同定されています。 このFT3の減少の原因が、疾患がある場合に基礎代謝を低下させる生理的適応機構にすぎないのか、CKDや透析に伴う変化であり、その補正がこれらの患者の生存率向上につながるのかは不明である。 CKD患者においてFT3値が低くなるのは、以下のような様々なメカニズムが考えられる。 1) 栄養失調。 食事量の減少は、T4からFT3への変換を減少させ、最終的にエネルギー産生を減少させ、タンパク質の異化を停止させる可能性がある;2)炎症。 CKDでは、慢性炎症が起こり、それが透析中のFT3の減少とも関連する可能性がある;4,5 3)腎不全そのもの。 代謝性アシドーシスやヨウ素排泄量の減少など、甲状腺機能を変化させる尿毒症の蓄積、またはHD中のヘパリン使用や腹膜流出液中のT4やT3のわずかな損失など透析技術に伴う変化が原因となる2. したがって、透析患者における甲状腺機能の低下は、栄養失調-炎症のマーカーであるか、慢性腎不全または使用される特定の透析技術に続発する可能性がある。
この研究の主目的は、透析(HDおよびPD)中の安定患者に影響を及ぼす低T3症候群の発生率と栄養不良および炎症の異なるマーカーとの関連を評価することでした。
MATERIAL AND METHOD
本研究は、2008年4月にセゴビア総合病院の慢性透析患者(HD32名、PD11名)を対象とした記述的横断的研究である。 全患者は慢性透析を開始して3ヶ月以上経過しており,臨床的な観点から安定していた。 「安定」とは、調査前の1カ月間に入院、感染症の併発、疾患の記録がないこととした。 その後、11人の患者が研究から除外された。
断面のTSH、FT4、FT3は、E170分析器(Roche Diagnostics, Mannheim, Germany)を用いて、電気化学発光ベースの免疫分析(ECLIA)により測定された。 TSH、FT4、FT3検査の感度は、それぞれ0.005mcU/l、0,3pmol/l、0.4pmol/lであった。 基準値は以下の通り。 TSH 0.4-5mcU/l、FT4 11-23pmol/l、FT3 3.9-6.8pmol/l である。 自己免疫疾患を除外するために、免疫吸着検査(Aeskulisa Aesku Diagnostics、ドイツ)を用いて抗甲状腺抗体(抗TPOおよび抗TG)を測定した(抗TPOは150U/ml以上、TGは50U/ml以上の値を陽性とみなした)。 同時に、栄養と炎症に関連する生化学的および血液学的パラメーターを検査した:アルブミン、プレアルブミン、トランスフェリン、コレステロール、ヘマトクリット、クレアチニン、pH、重炭酸、CRP(C反応タンパク質)、当院の通常の検査方法を使用した。 成長ホルモン(GH)値とインスリン様成長因子(IGF-1)値も、基準検査室でラジオイムノアッセイを用いて確立された。 数値はng/mlで表される。 検査は、その週の最初の透析セッションの前に行われた。午後に透析を受ける予定の患者は、事前に少なくとも4時間絶食するように指示された。
平均カロリーおよび1日のタンパク質摂取量は、3日間の食事調査(ソフトウェアプログラムDietSource 3.0 Novartis→)を使用して確立され、患者の理想体重に従って修正された。 脂質と炭水化物の割合、ナトリウム、カリウム、リンの摂取量も記録された。
患者の栄養状態は、標準的な手法6を用いて透析後の週の半ばに行われた身体測定で評価され、身長、体重、ボディマス指数(BMI)、上腕三頭筋皮膚厚(TSF)、腕周り(AC)、腕筋周り(AMC)が含まれた。 結果は、同じ年齢と性別のスペイン人健常者集団から得られたデータの50パーセンタイルに対する各症例の割合を計算することによって標準化され、7,8正常集団の80%を超える症例を中重度の障害とみなした。
栄養状態と身体組成のより正確な評価を得るために、生体インピーダンスベクトル分析(BIVA)が、透析後の週の半ばに実施された(Vectorial BIA 101; Akern, Florencia, Italy)を実施し、抵抗(R)、リアクタンス(Xc)、位相角(PA)、ナトリウム-カリウム交換(I Na/K)、全身水分(TBW)、細胞外水分(ECW)、細胞内水分(ICW)、細胞量、細胞量指数(細胞量/身長2)(BCMI)、脂肪量(FM)、無脂肪量(FFM)と筋質量を測定した。 このデータは、同じ年齢と体重の健常者の値と比較された9
共存率は、Beddhuによって修正されたCharlson指数を使用して推定された10。透析量はKT/Vを計算することによって測定し、タンパク質摂取量は現在の体重に対する正規化タンパク質異化率(nPCR)に基づいて推定された
統計分析
SPSSソフトウェアパッケージ、Windows用バージョン11.0を用いて実施された。 値はパーセンテージまたは平均値±SDで表した。p
RESULTS
患者32人の臨床的特徴は表1で見ることができる。 HDの平均KT/Vは1.6±0.27、PDの平均週間KT/Vは2.07±0.27だった。
甲状腺ホルモン値の平均は次の通りであった。 TSH 2.2 ± 1.5mcU/ml, FT4 14.7 ± 2.3pmol/l, FT3 4.0 ± 0.71pmol/l であった。 FT4が低値の患者は2名(6.3%),TSHが高値の患者は2名のみであったが,FT3が低値の患者は17名(53.1%)であった. FT3値,FT4値,TSH値の間に相関は認められなかった. 抗甲状腺抗体を有する患者はいなかった。 FT3値は性別による有意差はなかったが(男性4.2 ± 0.7 vs 女性3.8 ± 0.6; ns)、PDではHDより有意に高かった(4.5 ± 0.4 vs 3.8 ± 0.7; p = 0.016 )。 FT3値は、透析の種類による差はなかった。 しかし、PD患者はHD患者に比べTSHの濃度が高く(3.5 ± 1.3 vs. 1.7 ± 1.3mcU/ml; p = 0.002)、BMIもPD患者では高く(30.6 ± 3.3 vs. 24.8 ± 4.4; p = 0.002)なっていた。
透析におけるFT3の減少が何に関連しているかを明らかにするために、FT3が低い患者の臨床、社会人口学、分析、身体測定、BIVAデータを当研究室で得られた正常値と比較した(
DISCUSSION
近年。 甲状腺疾患によるものではなく、末梢でのFT4からFT3への変換が悪化した結果、FT32-4が低値を示すことが、透析患者の高い割合で報告されている。 この現象は、様々な慢性・急性疾患の症例で報告されている他の事例と類似していると思われ1、euthyroid sick syndromeまたはlow T3 syndromeと呼ばれている。 しかし、CKDは、逆T3(rT3)の増加を伴わないという点で、他の真性甲状腺疾患症候群のケースとは異なる11。これは、腎臓患者のrT3クリアランスが低いにもかかわらず、血管から血管外へのrT3の再分配とrT3の細胞への取り込みが増加するようだからである。
我々のデータは、透析を受けている、甲状腺疾患が知られていない低FT3レベルの患者(53%)の高い発生率を確認し、これはFT3のレベルがFT4またはTSHレベルと相関していないことから、おそらくT4とFT3の末梢変換不足に起因すると思われる。 尿毒症毒素の蓄積や代謝性アシドーシスがFT3の減少に寄与している可能性が示唆されている。12 我々は、pHおよび重炭酸レベルとFT3レベルとの間に関連性を見いだせなかった。 また、KT/Vで測定した透析量や透析時間との相関も認められませんでした。 一般に、我々の患者の透析量は多く(HD患者の平均KT/Vは1.6±0.27、PDの平均週間KT/Vは2.07±0.27)、アシドーシスは比較的よく改善された(pH 7.34±0.6 および重炭酸 22.7±2.8 )ことは考慮すべき点であったと思われる。 透析の種類に関しては、PDの透析患者ではFT3が高値であった。これは、PDでは排液中のT4とT3の損失が大きいことが予想されるため、予想された結果と若干矛盾しているが13、これらの損失は最小限であることも証明されている。 これは、T4 と T3 の生産率に換算すると、それぞれ 10%と 1% 未満である。 その結果、栄養失調に対する反応として末梢変換の欠如が腹膜損失よりもはるかに重要であることが確認され、本研究の場合、PD患者はより高いBMIを含むより良い栄養結果を記録した。 我々は、他の著者の知見と一致し、透析患者におけるFT3の減少は、主に基礎代謝を減らし、異化を避けることを目的とした身体の疾患に対する適応反応であると考える2。慢性疾患の場合、時にFT3の減少が疾患活動により引き起こされるのか、疾患活動に伴う栄養失調によるのかを見極めることが困難なことがある。 甲状腺機能は空腹時だけでなく、食事の構成によっても変化する。したがって、炭水化物摂取量の減少は、タンパク質摂取量の減少よりも大きなFT3の減少を引き起こす。 FT3値と総カロリー摂取量(kcal/day)、理想体重と実測体重による補正カロリー摂取量との間に相関は認められなかった。 また、FT3が正常な患者と低下している患者の間で食事構成に違いは見られなかった。そのため、透析患者におけるFT3の低下が摂取不足によるものであるという仮説を支持することには抵抗がある。 しかし、我々は、FT3レベルと栄養不良のいくつかの生化学的および身体測定パラメータ、例えばプレアルブミン、トランスフェリン、BMI、AC、AMCまたは生体インピーダンスを用いて測定した筋肉量との間に関連性を見いだした。 したがって、FT3値は栄養失調と関連するが、カロリー摂取量の不足とは関連しないと思われる。 さらに、CRPのレベルとの逆相関も見いだされた。 感染症や敗血症では、様々なメカニズムで甲状腺ホルモンが減少するが、基本的には末梢でのFT4からT3への変換が減少するために起こる。 Zocalliらの研究では、健常者と比較して、両方のタイプの透析患者でFT3の減少が認められ、FT3値はインターロイキン6およびCRP値と逆相関があることも示されています。 FT3の減少は、ベースラインのエネルギー代謝の低下に関連する疾患や加齢の結果である可能性も考慮されるべきであるが、我々の研究では、FT3と年齢や一般的な合併症との間に相関は見られなかったが、炎症パラメータとの相関は見られた。
最近、国際腎栄養代謝学会(ISRNM)18は、透析患者に影響を及ぼすこの状況を定義するために、「栄養不良」という用語を「タンパク質-エネルギー消耗症」(PEW)に置き換えることを提案している。 厳密な意味での「栄養失調」は「摂取不足」を意味し、これらの患者でしばしば観察される状況は、炎症性サイトカインによって促進される代謝の変化(過剰代謝または同化の欠如)であり、タンパク質またはエネルギー貯蔵量の喪失につながることを考慮する。 FT3の低下は、摂取不足ではなく、CKFに関連する炎症や同化物質の不足によって起こるタンパク質の消耗から身を守るための身体の適応機構であると考えています。 このことを考慮すると、Limら2名の研究結果は興味深いものです。健常者にFT3を投与してもタンパク質バランスは変化しませんが、FT3レベルの低いHD患者では異化作用が亢進しています。 このデータは、T4からFT3への末梢変換の減少を経験する患者が異化状況に対して自己防衛しており、T3が異化を増加させることによってタンパク質栄養失調を悪化させることを示唆している。
現在、血清クレアチニンまたは尿素生成が透析量に影響する場合があることから、透析患者の筋肉量およびタンパク質異化に関する信頼できるマーカーはまだ存在しない。 ISRNMの勧告18によると、筋肉量の減少は、臨床的にも予後的にも非常に重要であるため、PEW基準に含めるべきであるとしている。 FT3値と筋肉量との間に良好な相関があること、また、異化作用のある疾患ではFT3値が急速に変化することを考慮すると、FT3値は異化作用の早期指標として、また、これを治療することを目的とした特定の治療法の効果を測定するマーカーとして、例えば、栄養補助食品や異化作用物質に対する効果を評価するために使用すべきことを示唆するものである。
結論
我々の透析患者の半数は、TSHやFT4に変化がないのに血清中のFT3レベルが低下していた(低FT3症候群)。 この減少は、FT4からFT3への末梢変換の障害に起因するようである。 これらのレベルは基本的に栄養不良や炎症パラメータと相関しており、異化作用やPEWの早期マーカーと考えられる。
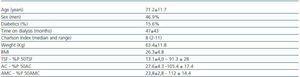
表1. 社会人口学的および身体測定学的特徴
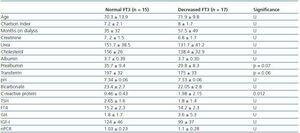
表2. FT3正常(>3.95)患者とFT3低下患者の社会人口学的および分析的差異
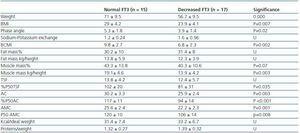
表3. FT3正常(> 3.95)患者とFT3低下患者の人体計測とBIVAの違い
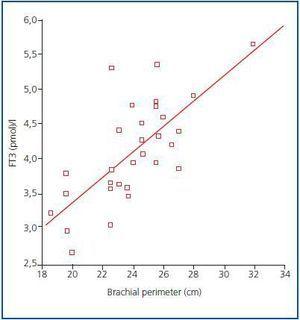
図1.
Leave a Reply