Frontiers in Pharmacology
Introduction
認知症の中で最も多いアルツハイマー病(AD)は、慢性的に認知機能の低下を伴い、認知症患者の60-70%を占める(Fan and Chiu, 2014; Lu et al., 2018). 2014年のレビューによると、現在、約3560万人がADに苦しんでおり、ADの発症率は年齢とともに漸増し、2050年までに世界で約1億1540万人が罹患するとされています(Fan and Chiu, 2014)。 ADは、主にコリン作動性伝達の変性、酸化ストレス、神経炎症などが関連する複数の病態が複雑に絡み合った神経変性疾患であると一般に認められています(Coyleら、1983;Aucoinら、2005;Lin and Beal、2006;Verriら、2012;Henekaら、2015;Bassaniら、2017)。 ドネペジル、リバスチグミン、ガランタミンなどのアセチルコリンエステラーゼ(AChE)阻害剤は、初期段階のADの臨床治療に優先的に処方される(Kwonら、2010;Rijpmaら、2014;KumarおよびSingh、2015)。 さらに、抗酸化剤および抗炎症剤も、ADのアジュバント療法に箴言的に使用されている(Zhouら、2016;Demirciら、2017)。 しかし、これらの薬剤はすべて、疾患の進行に伴って徐々に効力を失うために限られた効果を発揮し、薬剤はまた、多くの毒性の副作用を伴う(Zhouら、2016年;Jeonら、2017年;Luら、2018年)。 すなわち、ADを治癒するため、またはその進行性経過を変えるための利用可能な満足のいく治療法は現在存在しない。
ハルマリン(HAL)およびハルミン(HAR)は、同様の化学構造を有するペガナム ハルマラ L. の豊富な薬理β-カルボリン アルカロイドである(リら、2017年b)。 それらは有意なAChE、モノアミン酸化酵素(MAO)、ミエロペルオキシダーゼ(MPO)阻害活性、抗酸化、抗炎症、抗腫瘍、抗高血圧効果を有し、また様々な神経伝達物質の内容に影響を与え、動物やヒトの生化学、生理、行動変化をもたらす可能性がある(Mahmoudian et al, 2002; Frison et al., 2008; Jiménez et al., 2008; Herraiz et al., 2010; Louis et al., 2010; Bensalem et al., 2014; Wang et al., 2015; Li et al., 2017a)があります。 我々の以前の研究によると、HALとHARはin vitroでガランタミンと比較して同様のAChE阻害を示した(Zhaoら、2013)。 さらに、HALとHARを主に含むP. harmalaの総アルカロイド(28 mg/kg)は、スコポラミンと30%エタノールによって誘発された学習・記憶の障害に対して改善効果を示した(Heら、2015年b)。 その後、Heら(2015a)の研究では、さらにHAR(20 mg/kg)がAChEを阻害することによるコリン作動性機能増強によって、スコポラミン誘発マウスの記憶障害を改善することが確認された。 それにもかかわらず、最新の研究では、HARは多剤耐性関連タンパク質アイソフォーム2(MRP2)の基質であるだけでなく、代謝安定性が弱く、最終的に異なる動物においてHALのバイオアベイラビリティよりも大幅に低いことを示した(Li et al.,2017b)。 したがって、ADに対するHALの有効量は、HARよりもはるかに低い可能性があると推測される。 したがって、AD治療のための好ましい候補化合物を求めるために、2つのアナログの抗健忘効果およびメカニズムに関する系統的な比較研究を行うべきである。
本研究では、スコポラミン誘発記憶障害に対するHALおよびHARの調節効果をモリス水迷路(MWM)の行動評価により比較検討した。 MWMは空間学習と記憶の神経生物学と神経薬理学の研究に広く使用されており、ADなどの神経認知障害のげっ歯類モデルの検証に重要な役割を果たしている(Bromley-Brits et al.、2011)。 さらに、AD の進行に関与するいくつかの基礎的なメカニズムに対する HAL および HAR の影響を明らかにするために、生化学的アッセイ、ウェスタンブロッティングおよび免疫蛍光分析が包括的に実施されました。 本研究の結果は、今後の研究開発において、β-カルボリンアルカロイドの抗健忘症作用の評価に有益であるとともに、ADの臨床治療に貴重な情報を提供するものと考えられる。
材料と方法
材料
ハーマリン、HAR、L-トリプトファン(L-Trp)、5-ヒドロキシトリプタミン(5-HT)、5-ヒドロキシインドール-3-酢酸(5-HIAA)、塩化アセチルコリン(ACh)、塩化コリン(Ch), γ-アミノ酪酸(γ-GABA)、L-グルタミン酸一ナトリウム塩一水和物(L-Glu)、L-フェニルアラニン(L-Phe)、L-チロシン(L-Tyr)、テオフィリン、その他すべての使用化学物質はSigma-Aldrich、株式会社から購入されました。, Ltd.の商標です。 (St. Louis, MO, United States)に依頼した。 スコポラミン臭化水素酸塩およびドネペジル塩酸塩一水和物は、TCI(上海)開発、Co.Ltd.から購入した。 (Shanghai,China)から購入した。 カルボキシメチルセルロースナトリウム(CMC-Na)およびNaClはMeilunbio® Biotech, Co, Ltd.から入手した。 (Dalian, China)から入手した。 複合酸化チタン着色料は,Shanghai Dyestuffs Research Institute, Co, Ltd.から購入した。 (Shanghai, China)から購入した。 BCAタンパク質定量キット,RIPA溶解バッファ,ウシ血清アルブミン(BSA),PBST(10X),30%アクリルアミド,10%SDS,グリシン,サンプルローディングバッファ(4X)およびTEMEDはYEASEN Biotechnology, Co. (Shanghai,China)から購入した。 Phospholipase inhibitorおよびprotease inhibitorはRoche Applied Science (Foster City, CA, United States)から購入した。 PVDF膜およびImmobilonTM Western chemiluminescent HRP substrateはMillipore (Billerica, MA, United States)から購入した. ウサギ抗 AChE、ウサギ抗コリンアセチルトランスフェラーゼ(ChAT)、ウサギ抗 MPO および抗グリセルアルデヒド 3- リン酸脱水素酵素(GAPDH)、HRP 標識抗ウサギ IgG 抗体、マーカーは Abcam Technology(Cambridge, MA, United States)より購入した。 HPLCグレードのアセトニトリル、メタノール、ギ酸は、Fisher Scientific, Co.から購入した。 (Santa Clara, CA, United States)から購入した. 脱イオン水(>18 mΩ)は,Milli-Q Academic System (Millipore, Corp., Billerica, MA, United States)で精製した. その他の化学物質はすべて分析グレードであった。
Animals
180匹の雄C57BL/6マウス(10週齢)を上海中医薬大学医薬品安全評価研究センターから入手した。 マウスは採光の良い空調室(25±1℃)で標準的な環境条件(相対湿度:60~65%、12時間明暗サイクル:7:00~19:00に点灯)で飼育し、ネズミの餌と水道水を自由に摂取できるようにした。 すべての動物実験は、1988年11月14日に中国国家科学技術委員会が公布した「動物実験条例」に従い、上海中医薬大学実験動物倫理委員会の承認を得た(No. SUTCM-2011-1107; Approval date: 10 November, 2011)。
Drug Administration
HALとHARのバイオアベイラビリティの差に基づき、投与量はHALが2、5、10mg/kg、HARが10、20、30mg/kgとした(張、2013;石ら、, 2014). マウス1008匹を無作為に9群(1群12匹)に分け、対照群(ビヒクル、0.5%CMC-Na)、スコポラミン群(1mg/kg)、ドネペジル群(陽性対照、5mg/kg)、HAL群(2、5、10mg/kg、すなわち低:L、中:M、高:H投与)、HAR群(10、20、30mg/kg、すなわちL、M、H投与)に分け、それぞれ投与量を設定した。 図1に示すように、MWM試験前に、対照群およびスコポラミン群には0.5%CMC-Na溶液を経口投与し、HAL群(L、M、H投与)、HAR群(L、M、H投与)およびドネペジル(5 mg/kg)には連続7日間ガベジ投与した。 8日目から16日目まで、各種処理後30分後に通常生理食塩水を投与した対照群を除く全群にスコポラミン(1 mg/kg)を腹腔内(i.p.)に注射した。 その後、スコポラミンまたは通常の生理食塩水のi.p.注射の30分後に、行動試験を毎日行った
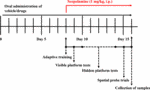
FIGURE 1. マウスの実験及び治療デザインのタイムスケジュール。
Behavioral Assessment in Morris Water Maze
マウスの空間学習及び記憶に対するHAL及びHARの効果を評価するために、1982年にRichard Morrisによって以前に記載された通りに、マイナー修正を加えてMWMテストが適用された(Morris et al, 1982; He et al., 2015a; Singh et al., 2016)。
MWM装置は、白い円形の水槽(直径:120cm、高さ:50cm)を、実験全体にわたって固定された位置の柱にある様々な視覚手がかり(星、四角、長方、丸など)で囲んだものであった。 水槽は22±2℃で無毒の着色剤である複合酸化チタンを添加し、プラットフォームが水面下で見えなくなるように白色化した。 水槽は仮想的に南東,北東,南西,北西の4等分した。 白色のプラットフォーム(直径:10 cm、高さ:25 cm)は、南西の象限に中心を置いた(Jeon et al., 2017; Kouémou et al., 2017; Lu et al., 2018)。 全体の実験手順は、適応訓練(1日、1日1回)、可視プラットフォーム試験(1日、1日4回)、隠れプラットフォーム試験(5日、1日4回)、空間プローブ試験(最後の隠れプラットフォーム試験の24時間後、1日1回)で構成した。
適応訓練(1日、1回)については、MWM試験の初日(薬剤処理の第8日)に、それぞれのマウスを水槽内に入れて60秒間泳がせ、慣らしセッションを受けることにした。 翌日(薬物投与9日目)は、マウスの視覚、感覚、運動能力を調べるため、水面から1cmの位置に可視プラットフォームを配置し、各マウスに60秒間でプラットフォームを見つけさせる試験(1日4試行)を隠れプラットフォーム試行に先立ち行い、適格マウスを審査した。 その後、hidden platform試験でプラットフォームを水面下1cmに沈めた(5日間、1日4回試行、薬物投与10~14日目)。 遊泳活動は頭上のビデオカメラで記録し、コンピュータ追跡・画像解析システム(RD1101-MWM-G、Shanghai Mobile Datum Information Technology Company, Shanghai, China)を介して解析した。 マウスは東北、北、東、東南の4方向から水槽の壁に頭を向けて放し、60秒間でプラットフォームを見つけさせた。マウスがプラットフォームを見つけられない場合は、特定の実験者が優しく誘導し、プラットフォームで15秒間滞在させた。 各試行終了後、各マウスをケージに戻し、ヒーターの下で乾燥させた。 各試行で逃避潜時および逃避率を記録した。 空間プローブ試験(薬物投与15日目)では、水槽からプラットフォームを取り外した。 各マウスは、前のプラットフォームの位置(標的象限)と反対側の象限(瞬間的には北西)から水槽に入れ、60秒間の記憶保持試験を受けた(Leeら、2016;Liuら、2017;Malikら、2017)。 標的象限での時間と交差数を記録した。
脳組織の収集
薬剤投与後16日目に、全てのマウスを麻酔し、眼球摘出により血漿を採取し、断頭して脳組織を収集した。 各群において、サブセットの動物の脳を免疫蛍光分析に、その他を生化学分析およびウェスタンブロッティング分析に使用した。 犠牲後、脳組織は直ちに摘出し、通常の生理食塩水で洗浄し、表面の水分を濾紙で拭き取り、重量を測定した。 各脳の大脳皮質と海馬をそれぞれ氷上で2分割(左と右)した。 一部は免疫蛍光分析のために4%パラホルムアルデヒドで固定し、他は液体窒素で直ちに凍結し、分析まで-80℃で保存した。
Biochemical Assay
皮質と海馬を氷冷した0.5℃でホモジナイズした。1Mリン酸緩衝液(pH7.4)で処理し、10%(w/v)ホモジネートを4℃、12000rpmで10分間遠心分離し、上清を分離した後、生化学的推定のために-80℃にて保存した(Malik et al, 2017). AChE、ChAT、スーパーオキシドジスムターゼ(SOD)、グルタチオンペルオキシダーゼ(GSH-px)、マレイン酸ジアルデヒド(MDA)、MPO、腫瘍壊死因子α(TNF-α)、インターロイキン 1β(IL-1β )、インターロイキン 6(IL-6 )、インターロイキン 10(IL-10 )レベルを示した。 および大脳皮質および/または海馬のホモジネート中の一酸化窒素(NO)を、市販のアッセイキット(Jiancheng, Nanjing, China)を用いて、メーカーのプロトコルに従ってELISA法により測定した。 特に,大脳皮質および海馬の上記生化学因子の濃度は,各サンプルのタンパク質濃度を用いて正規化した.
Western Blotting Analysis
大脳皮質と海馬を、ホスファターゼ阻害剤とプロテアーゼ阻害剤を含む氷冷した50 mM Tris-HCl buffer (pH 7.4) 中でホモジナイズした. 遠心分離(12,000rpm)、4℃、10分後、BCA protein assay kitにより総タンパク質量を測定した。 タンパク質サンプルは、1/4量のローディングバッファーと混合した後、100℃で5分間加熱した。 各サンプル20μgのタンパク質を8% SDS-PAGEで電気泳動し、PVDF膜に移した。 その後、膜を室温で5%無脂肪乳により1時間ブロッキングし、抗GAPDH(1:5000)、抗AChE(1:1000)、抗ChAT(1:1000)および抗MPO(1:1000)とともに4℃で一晩インキュベートした。 その後、膜をPBSTで十分に洗浄し、HRP標識抗ウサギ(1:5000)二次抗体と室温で2時間インキュベートした。 PBSTで完全に洗浄した後、タンパク質バンドをECLプライムキットで可視化した。
免疫蛍光分析
ミエロペルオキシダーゼ生成は、マイナーチェンジして以前に記載したように免疫蛍光顕微鏡で可視化した(Grayら、2008)。 4%パラホルムアルデヒドで固定した後、皮質を5μm厚の矢状断面に切り出し、脱パラフィンして免疫蛍光分析用に処理した。 脳切片を抗原修復用のクエン酸(pH6.0)溶液に入れ、電子レンジで加熱した。 その後、自家蛍光消光を5分間行った。 2%BSAでブロッキングした後、切片を抗MPO(1:100)で4℃にて一晩プローブした。 その後、切片をPBS (pH 7.4) で3回洗浄し、HRP標識抗ウサギ (1:300) 二次抗体と室温で30分インキュベートした。 その後、DNAの対比染色に4′,6-diamidino-2-phenylindole(DAPI)を採用し、蛍光顕微鏡(Nikon ECLIPSE C1、日本)で脳切片を観察し、適宜、画像を取り込んだ。 ここで、DAPIまたはMPOの蛍光は、それぞれ励起波長330-380または510-560nm、発光波長420または590nmで測定した。
神経伝達物質に対するHALおよびHARの影響
抽出手順
迅速、確実、便利な沈殿法により、大脳皮質ホモジネートや血漿試料を調製した。 1.5mL遠心管に100μLの試料と60ng/mLのISを含む200μLの氷冷アセトニトリルを加え、1分間ボルテックスミキシングを行いました。 その後、12,000rpmで10分間遠心分離した(4℃)。 各サンプルの上清の5μLのアリコートを、定量分析のためにエレクトロスプレーイオン化(ESI)四重極タンデム質量分析(UPLC-ESI-MS/MS)と組み合わせた超高速液体クロマトグラフィーに注入した。
UPLC-ESI-MS/MS Analysis
様々な神経伝達物質の濃度は、SHIMADZU LC-30AD UPLCシステム(Shimadzu, Kyoto, Japan)とAB Sciex QTRAP® 6500 triple quadrupole mass spectrometer (SCIEX, United States) をESIイオン源と接続して、多重反応モニタリング用の正イオンを使用して同時定量された。 ZIC-cHILIC カラム (150 mm × 2.1 mm, 3 μm, Merck-Sequant, Germany) と SeQuant ZIC-cHILIC ガードカラム (20 mm × 2.1 mm, 5 μm, Merck-Sequant, Germany) でクロマトグラフィー分離を行なった。 移動相は0.1%ギ酸を含むアセトニトリル-水(65:35, v/v)を流速0.2 mL/minで送液した。 質量分析計を汚染から保護するため、注入後の最初の1分間は流量を廃棄物へ転換した。 他のすべての機器パラメータは、我々の以前の研究(Jiang, 2016)に従って設定された。 UPLC-ESI-MS/MS法は十分に検証され、大脳皮質ホモジネートおよび血漿中の神経伝達物質の濃度の測定に成功した(Jiang, 2016)
統計解析
統計評価はSPSSバージョン18.0ソフトウェアで行い、データは平均±SDとして表現された。 MWM試験で提示された逃避潜時および経路長のデータは、反復測定二元配置ANOVAによって解析された。 その他の行動データおよびバイオマーカーの変化については、一元配置分散分析による多重比較で検定した。 有意な結果は、従来の臨界P値に従ってマークした。 #P < 0.05; ##P < 0.01; ###P < 0.001, vs. コントロールグループ. ∗P < 0.05; ∗P < 0.01; ∗P < 0.001, vs. スコポラミン誘発群.
結果
HAL and HAR Attenuated Cognitive Dysunction of Scopolamine-Treated MWM
空間学習と記憶に対するHAL(L、M、H投与)およびHAR(L、M、H投与)の影響を調べるため、Scopolamine誘発記憶障害マウスでMWMタスクを実施した。 混合モデルによる二元配置反復測定分析の結果、プラットフォームに到達するまでの待ち時間は、マウスの実験群間(F(8,396) = 26.011, P < 0.001 )、獲得訓練の日数(F(4,396) = 15.274, P < 0.001 )で有意差があった。 群と日数の間に有意な交互作用はなく(F(32,396) = 1.132, P > 0.05)、群間の差は処置に依存していることが示唆された。 図2に示したように、隠れプラットフォーム試験において、スコポラミン誘発群の逃避潜時および経路長は、4日に対照群より有意に長くなった(図2A、F(8,99) = 3.135, P < 0.05)。01; Figure 2B, F(8,99) = 4.074, P < 0.01) と5日目 (Figure 2A, F(8,99) = 4.164, P < 0.01; Figure 2B, F(8,99) = 4.548, P < 0.01) において、記憶障害モデルマウスがうまく構成されたことが示された。 しかし、スコポラミンによる認知障害は、HALとHARの両方によって逆転された。 スコポラミン誘発群と比較して、4日のHAL(L、M、H投与)およびHAR(M、H投与)投与群では、逃避潜時および経路長が効果的に減少した(図2A、F(8,99)=4,975、P<1507> 0.01;F(8,99)=2.816, P < 0.05; F(8,99) = 2.795, P < 0.05; Figure 2B, F(8,99) = 3.836, P < 0.01; F(8,99) = 3.836.231, P < 0.01; F(8,99) = 2.658, P < 0.05; 図2C, F(8,99) = 4.673, P < 0.01; F(8,99) = 4.881, P < 0.05; 図2C, F(8,99) = 4.873, P < 0.01; F(8,99) = 4.881, P < 0.01;図2D、F(8,99) = 3.817, P < 0.01;F(8,99) = 3.129, P < 0.01) および5日目(図2A、F(8,99) = 12.637, P < 0.001; F(8,99) = 2.802, P < 0.05;F(8,99) = 2.772, P < 0.05; 図2B, F(8,99) = 4.0, P 0.05)014, P < 0.01; F(8,99) = 2.722, P < 0.05; F(8,99) = 2.531, P < 0.05; Figure 2C, F(8,99) = 4.574, P < 0.05; F(8,99) = 4.574, P < 0.05; Figure 2C, F(8,99) = 2.574, P < 0.01; F(8,99) = 4.632, P < 0.01; Figure 2D, F(8,99) = 2.547, P < 0.05; F(8,99) = 3.905, P < 0.01) であった。 しかし、HARを10 mg/kgの低用量で投与した場合(L用量群)、4日の訓練期間を通して逃避潜時および経路長に有意な減少は見られなかった(図2C、F(8,99)=1.182, P > 0.05; Figure 2D, F(8,99) = 0.494, P > 0.05) と5日目(Figure 2C, F(8,99) = 0.873, P > 0.05; Figure 2D, F(8,99) = 0.201, P > 0.05) の訓練期間を通じて、逃避潜時および経路長の有意な減少は認められなかった。 また、図2からわかるように、ドネペジル投与群(5mg/kg)の逃避潜時および経路長は、4日目にスコポラミン誘導群に比べ顕著に短縮した(図2A、F(8,99)=2.668、P<1507>0.05;図2B、F(8,99) = 2.643, P < 0.05)および訓練試行セッション3中の5日目(図2A、F(8,99) = 2.780, P < 0.05; 図2B、F(8,99) = 2.897, P < 0.05)
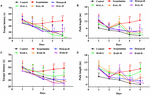
FIGURE 2. スコポラミン誘発記憶障害マウスに対するHAL(2、5、10mg/kg、すなわち低:L、中:M、高:Hの投与量)およびHAR(10、20、30mg/kg、すなわちL、M、Hの投与量)の効果を示す。 HAL(L、M、H投与量)、HAR(L、M、H投与量)およびdonepezil(5 mg/kg)をモリス水迷路(MWM)試験の訓練前に7日間経口投与し、試験中も継続投与した。 記憶障害はスコポラミン(1 mg/kg、i.p.)で誘発した。 HAL(L、M、H投与)投与群の隠れプラットフォーム試験における逃避潜時(A)と経路長(B)、HAR(L、M、H投与)投与群の隠れプラットフォーム試験における逃避潜時(C)と経路長(D)を5日間連続測定したもの。 本図のデータポイントのエラーバー(SD)は、処理間の差異を明確に識別するために与えていない。 N = 12/グループ。 対照群に対して##P < 0.01。 ∗P < 0.05; ∗P < 0.01; ∗P < 0.001, vs. スコポラミン誘発群。
隠れプラットフォーム試験の翌日、プラットフォームを奪って空間探査試験を行い、全マウスの空間記憶を評価した。 図3に示すように、スコポラミン誘発群では通過頻度が著しく低下し(F(8,81)=5.498、P<1507>0.05)、スコポラミン1mg/kgがマウスの空間記憶の形成にダメージを与えることが明らかとなった。 特に、HAR(L投与)投与群(F(8,81) = 0.494, P > 0.05)とは別に、HAL(L、M、H投与)およびHAR(M、H投与)の他の投与群では通過頻度が劇的に上昇した(F(8,81) = 11.667, P < 0.05)。01; F(8,81) = 9.072, P < 0.01; F(8,81) = 4.507, P < 0.05; F(8,81) = 7.063, P < 0.05; F(8,81) = 8.583, P < 0.01, それぞれ)そして、他の群に比べてHAL・L投与群の上昇が顕著だった(図 3)。”HAL” は、”M” と “H” の2つの投与法からなる。 その上、donepezil投与(5 mg/kg)群もスコポラミン誘発マウスと比較して有意に通過頻度が増加した(図3, F(8,81) = 5.345, P < 0.05). これらの結果から、HAL(L、M、H投与)およびHAR(M、H投与)はスコポラミン誘発認知機能障害マウスの空間記憶能力を改善することができ、HALはHARよりもMWMの空間学習および記憶に対して強い効果を示すことが示唆された。
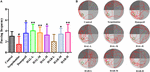
FIGURE 3. Scopolamine誘発の記憶障害マウスに対するHAL(2、5、10 mg/kg、すなわち低:L、中:M、高:H投与)およびHAR(10、20、30 mg/kg、すなわちL、M、H投与)の影響. プラットフォームの位置を通過するマウスの頻度(A)、水槽内のマウスの遊泳軌跡(B)。 緑色の円は隠しプラットフォームの位置、赤色の曲線はマウスの移動の軌跡を示す。 N = 10/グループ。 #P < 0.05, vs. コントロールグループ。 ∗P < 0.05; ∗P < 0.01; vs. スコポラミン誘発群。
スコポラミン誘発のコリン作動性システム、酸化ストレス、および炎症に対するHALおよびHARの効果
スコポラミンによって誘発される記憶を改善するHALおよびHARの潜在的メカニズムをさらに解明するために、コリン作動性システム、酸化ストレスおよび炎症に関する様々な生化学因子およびタンパク質発現レベルを調査した。 図4、5は大脳皮質または海馬における各種生化学因子の変化を、図6〜8はマウスの大脳皮質におけるタンパク質発現に対するHALおよびHARの効果を示したものである。 HAL(2、5、10 mg/kg、すなわち低:L、中:M、高:H)の効果。 スコポラミン誘発認知障害マウスの大脳皮質(A-C)および腰部(D-F)におけるアセチルコリンエステラーゼ(AChE)、コリンアセチルトランスフェラーゼ(ChAT)およびミエロペルオキシダーゼ(MPO)活性に対するHAL(2、5、10 mg/kg、すなわち低用量: L, 中容量: M, 高容量: H)およびHAR(10、20、30 mg/kg、すなわちL、M、H)それぞれの用量)の影響を示した。 データは平均値±SDで表した(n = 10)。 #P < 0.05; ##P < 0.01; ###P < 0.001, vs. コントロール群. ∗P < 0.05; ∗P < 0.01; ∗P < 0.001, vs. スコポラミン誘発群.
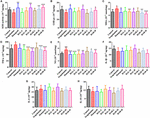
FIGURE 5.スコポラミン誘発群.

FIGURE 7. スコポラミン誘発認知障害マウスの大脳皮質(A,C)および腰部(B,D)におけるミエロペルオキシダーゼ(MPO)のタンパク質発現レベルに対するHAL(2,5,10 mg/kg、すなわち低:L,中:M,高:H投与量)およびHAR(10,20,30 mg/kg、すなわちL,M,H投与量)の影響。 データは平均値±SDで表した(n = 3)。 #P < 0.05; ##P < 0.01, vs. コントロール群。 ∗P < 0.05; ∗P < 0.01、対スコポラミン誘発群。

図8.図8.スコポラミン誘発群。 免疫蛍光顕微鏡で可視化したスコポラミン誘発認知障害マウスの大脳皮質におけるミエロペルオキシダーゼ(MPO)の生成に対するHAL(2、5、10 mg/kg、すなわち低:L、中:M、高:H投与量)及びHAR(10、20、30 mg/kg、すなわちL、M、H投与量)の影響。
Effects of HAL and HAR on Cholinergic Deficits
HALおよびHARの脳コリン作動性機能への影響を明らかにするために,すべてのマウスの大脳皮質および海馬組織におけるAChEおよびChATの活性とタンパク質レベルの変化を評価した. 図4A,Dに示すように、スコポラミン1mg/kg投与により、大脳皮質および海馬のAChE活性は有意に上昇した(F(8,81) = 10.553, P < 0.01; F(8,81) = 6.177, P < 0.05 )。 大脳皮質のHAR-L投与群を除き、他のHAL(L、M、H投与)およびHAR(M、H投与)投与群はAChE活性をかなり低下させた(図4A、F(8,81)=10.837、P<1507> 0.01;F(8,81)=8.621,P<1507> 0.05;F(8,81)=15.177,P<1507> 0.01; F(8,81) = 8.615, P < 0.05; F(8,81) = 16.330, P < 0.001; 図4D, F(8,81) = 46.593, P < 0.001; F(8,81) = 34.179, P < 0.001; F(8,81) = 8.615, P < 0.00; F(8,81) = 8.3403, P < 0.00001; F(8,81) = 7.968, P < 0.05; F(8,81) = 4.769, P < 0.05; F(8,81) = 49.802, P < 0.001; F(8,81) = 46.665, P < 0.001) となった。 同様に、ドネペジル投与群は、スコポラミン誘発群のレベルと比較して、明らかにAChEの活性を低下させた(図4A、F(8,81)=13.138、P<1507> 0.01;図4D、F(8,81)=7.400、P<1507> 0.05). さらに、スコポラミン誘発群は、大脳皮質と海馬の両方でChATの活性の有意な低下を示した(図4B、F(8,81)=5.481、P < 0.05; 図4E、F(8,81)= 4.874, P < 0.05 )。 それにもかかわらず、HAL(LおよびM投与量)およびHAR(MおよびH投与量)投与は、大脳皮質におけるChAT活性を有意に増加させた(図4B、F(8,81)=7.956、P<1507> 0.05;F(8,81)=8.390,P<1507> 0.05;F(8,81)=7.835, P < 0.05; F(8,81) = 51.927, P < 0.001)、海馬におけるHALおよびHAR処理群すべてのChATレベルがスコポラミン誘発群に比べ有意に高く(図4E、F(8,81)=18.139, p < 0.001; f(8,81) = 9.665, p < 0.01; f(8,81) = 14.113, p < 0.01; f(8,81) = 5.178, p < 0.05; f(8,81) = 7.599, p < 0.00; p 0.05; F(8,81) = 11.953, P < 0.01)、HAL-L投与群のChAT活性への影響はHAR投与群に比べより顕著であった。
図6に描かれているように、対照群と比較して、スコポラミン誘発群の大脳皮質および海馬におけるAChEのタンパク質発現量は顕著に増加したが(図6C、F(8,18)= 36.632, P < 0.01; 図6D、F(8,18)= 14.823, P < 0.05) ChATのタンパク質レベルはほとんど変化しなかった(図6E,F)。 HAL(L、M、H投与)、HAR(M、H投与)およびドネペジルによる処理後、HAR(L投与)を除き、大脳皮質におけるAChEのタンパク質レベルはスコポラミン誘発群と比較して著しく減少した(図6C、F(8,18)=50.590, p < 0.001; f(8,18) = 16.950, p < 0.05; f(8,18) = 30.993, p < 0.01; f(8,18) = 23.821, p < 0.00; f(8,18) = 23.821, p < 0.01; F(8,18) = 52.196, P < 0.001; F(8,18) = 29.284, P < 0.01), 一方、ChATのレベルは変化しなかった(図6E)。 そして、AChEおよびChATのレベルに対する同様の効果は、海馬におけるHALおよびHAR(L、M、Hの投与量)投与で見られた(図6D、F(8,18)=41.195、P<1507>0.001; F(8,18) = 28.111, P < 0.01; F(8,18) = 47.611, P < 0.001; F(8,18) = 30.539, P < 0.01; F(8,18) = 33.225, P < 0.01; F(8,18) = 40.032, P < 0.001; Figure 6F) を示した。 また、HARのAChEタンパク質発現抑制効果は用量依存的であったが、HALは2 mg/kgの低用量で顕著な抑制効果を示した(図6)。 このように、HALおよびHARは、スコポラミンによるAChE活性およびタンパク質発現の上昇、ChAT活性の低下を抑制し、コリン作動性システムの機能を高め、行動機能障害を緩和することが明らかとなった。 特にHALは低用量で有意な改善を示した。
酸化ストレスマーカーに対するHALおよびHARの影響
大脳皮質における抗酸化酵素SOD、GSH-px活性およびMDAレベルに対するHALおよびHARの効果を測定した。 図5が示すように、スコポラミン誘発群は対照群に比べ、SODとGSH-pxの活性が目に見えて減衰した(図5A、F(8,81)=12.254、P<1507>0.01;図5B、F(8,81)=4.577、P<1507>0.05)。 一方、HAL(H投与)、HAR(MおよびH投与)、ドネペジル投与は、SOD活性を有意に上昇させた(図5A、F(8,81)=13.287、P < 0.01; F(8,81)=13.424, P < 0.01; F(8,81)=34.510, P < 0.05)。001; F(8,81) = 8.670, P < 0.01)、HAL、HAR(両H用量)、ドネペジル処理によりGSH-pxの活性は明らかに上昇した(図5B, F(8,81) = 6.010, P < 0.05; F(8,81) = 6.008, P < 0.05; F(8,81) = 6.860, P < 0.05 )。 さらに、HAL、HAR(MおよびHの両方の投与量)およびドネペジル(5mg/kg)処理では、スコポラミン誘発マウスと比較して、MDAレベル増加の有意な減衰が観察された(図5C、F(8,81)=9.302, p < 0.01; f(8,81) = 6.565, p < 0.05; f(8,81) = 12.690, p < 0.01; f(8,81) = 33.627, p < 0.001; f(8,81) = 5.874, p < 0.05) であった。 これらの結果は、HALとHARが大脳皮質を酸化ストレスから保護することにより、スコポラミンによる酸化的損傷を防いでいる可能性を示唆するものである。
Effects of HAL and HAR on Inflammation Levels
HAL と HAR が大脳皮質または海馬の炎症因子 MPO, TNF-α, IL-1β, IL-6, IL-10 の活性と NO レベルに与える影響を分析した. スコポラミン誘発マウスでは、MPO(大脳皮質および海馬)およびTNF-α(大脳皮質)の活性が対照マウスと比較して上昇した(図4C、F(8,81)=34.740, P < 0.001; 図4F, F(8,81) = 6.729, P < 0.05; 図5D, F(8,81) = 6.316, P < 0.05) 、IL-1β、IL-6およびIL-10のレベルは変化しなかった(図5F-H)。 しかし、HAL、HAR(M及びHの両投与量)及びドネペジル投与により、大脳皮質及び海馬のMPO活性は用量依存的に有意に低下した(図4C、F(8,81)=10.435, p < 0.01; f(8,81) = 32.309, p < 0.001; f(8,81) = 16.397, p < 0.01; f(8,81) = 31.291, p < 0.01。001; F(8,81) = 7.129, P < 0.05; 図4F, F(8,81) = 7.212, P < 0.05; F(8,81) = 10.533, P < 0.0; 図4F, F(8,81) = 7.129, P < 0.01; F(8,81) = 9.150, P < 0.01; F(8,81) = 18.903, P < 0.001; F(8,81) = 11.641, P < 0.01) 、HAL(L、M、H投与)、HAR(M、H投与)、ドネペジル治療も大脳皮質におけるTNF-αの活性が弱められる(図5D、 F(8,81)=10.377, p < 0.01; f(8,81) = 28.257, p < 0.001; f(8,81) = 31.088, p < 0.001; f(8,81) = 15.966, p < 0.001; f(8,81) = 23.530, p < 0.001; f(8,81) = 5.909, p < 0.05) とした。 また、HAR-L投与群以外のHAL、HAR、ドネペジル投与マウスでは、スコポラミン誘発健忘症マウスと比較して、NOレベル上昇の顕著な減衰が認められた(図5E、F(8,81)=21.319, p < 0.001; f(8,81) = 12.996, p < 0.01; f(8,81) = 11.911, p < 0.01; f(8,81) = 5.227, p < 0.05; f(8,81) = 8.799, p < 0.00; p < 0.01; F(8,81) = 17.349, P < 0.001)、HALのTNF-αおよびNOに対する抑制作用はHARのそれよりも顕著であった。
図7に示すように、対照マウスと比較して、スコポラミン誘発マウスの皮質および海馬のMPOのタンパク質発現量は上昇した(図7C、F(8,18)=29.975、P<1507> 0.01;図7D、F(8,18)=32.014、P<1507> 0.01 )。 ドネペジル、HAL、HAR(L、M、H投与)投与後、スコポラミン投与群と比較して、大脳皮質および海馬でMPOのタンパク質発現が明らかに低下した。 また、免疫蛍光測定の結果、HALおよびHAR投与は、大脳皮質のMPO発現を用量依存的に顕著に低下させ、HALおよびHARの抑制効果は同程度であった(図8)。 これらの知見はすべて、HALおよびHARが大脳皮質および海馬を炎症から抑制することにより、スコポラミン誘発の炎症性傷害を軽減できることを示唆した。
Modulator Effects of HAL and HAR on the Neurotransmters of Scopolamine-Treated Mice
UPLC-ESI-MS/MSを用いて様々な形質および皮質の神経伝達物質の評価を行い、変化を図9,10にそれぞれ提示した。 先に確立した神経伝達物質の定量法に基づき、血漿中のACh, Ch, L-Trp, 5-HT, L-Glu, L-Phe, L-Tyr、皮質中のACh, Ch, L-Trp, γ-GABA, L-Glu, L-Phe, L-Tyr は定量下限を超えており、その後は全て正常に定量できた
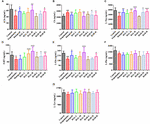
FIGURE 9.神経伝達物質の定量は、図9に示すように、血漿中と皮質中の神経伝達物質の定量を行った。 スコポラミン誘発認知障害マウスの血漿中の神経伝達物質の内容に対するHAL(2、5、10 mg/kg、すなわち低:L、中:M、高:H投与量)およびHAR(10、20、30 mg/kg、すなわちL、M、H投与量)の影響。 N = 10/グループ。 ACh (A), Ch (B), L-Trp (C), 5-HT (D), L-Glu (E), L-Phe (F), L-Tyr (G). #P < 0.05; ##P < 0.01; ###P < 0.001, vs. コントロールグループ. ∗P < 0.05; ∗P < 0.01; ∗P < 0.001, vs. スコポラミン誘発群.
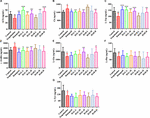
FIGURE 10.スコポラミン誘発群.
〈7270>〈7270〉
スコポラミン1mg/kgの用量で誘導後、血漿中のACh、L-Trp、5-HT、L-Glu、L-Phe濃度は減少した(図9A、F(8,81)=11.453, P < 0.01; 図9C, F(8,81) = 23.137, P < 0.001; 図9D, F(8,81) = 7.359, P < 0.05; 図9E, F(8,81) = 55.0, P < 0.0).531, P < 0.001; Figure 9F, F(8,81) = 6.330, P < 0.05), 一方、L-Tyrには影響がなかった (Figure 9G, F(8,81) = 2.091, P > 0.05). しかし、HALおよびHARを高用量で投与すると、AChおよびL-Gluの含量が上昇し(図9A、E)、HAL(L、M、H)およびHAR(M、H)投与によりL-Trpが用量依存的に明らかに上昇することがわかった(図9C)。 さらに、HALおよびHAR(MおよびH用量)投与マウスは、スコポラミン誘導マウスと比較して、5-HTレベルの有意な上昇を示した(図9D)。 しかし、HALおよびHARの投与は、L-PheおよびL-Tyrの含有量を調節しなかった(図9F、G)。 また、HAL(H投与)およびHAR(MおよびH投与)は、血漿中のChの含有量を減少させる効果を示した(図9B)。
さらに、図10は、大脳皮質における神経伝達物質の変動を示している。 スコポラミン投与後、ACh、L-Trp、L-Glu、L-Phe、L-Tyrの含有量は明らかに減少した(図10A、F(8,81)=11.296、P<1507>0.01;図10C、F(8,81)=10.979、P<1507>0.01;図10E、F(8,81)=7.216、P<1507>0.05;図10F、F(8,81)=10.340, P < 0.01; 図10G, F(8,81) = 6.834, P < 0.05), 一方、大脳皮質ではChとγ-GABAの含有量が対照群と比較して有意に上昇した(図10B、F(8,81)= 7.377, P < 0.05; 図10D、F(8,81)= 5.580, P < 0.05). それにもかかわらず、AChの含有量はHAL(L、M、H投与)群およびHAR(M、H投与)群で観察的に上昇し、L-Trpの含有量はHAL(L、M、H投与)群およびHAR(H投与)群で顕著に上昇し、HALおよびHAR群の高投与量でL-Gluの量も上昇した(図10A,C,E)。 また、HAL(L、M、H投与)およびHAR(H投与)処理により、スコポラミン誘発群と比較してChおよびγ-GABA量が明らかに減少した(図10B、D)。 しかし、HALとHARの異なる用量は、スコポラミンによって誘導されたL-PheとL-Tyrの減少に対して無視できるほどの効果を示した(図10F,G)。 一般に、重要な形質および皮質神経伝達物質に対するHALの効果は、HARの効果よりも顕著であった(図9、10)。
考察
アルツハイマー病は、高齢化と寿命の増加により致命的に進行する神経変性疾患であり、ADを有効に治療できる新薬を見つけることが緊急である(Kouémou et al.、2017)。 一般に、コリン作動性機能低下、酸化ストレス、神経炎症がADの主な特徴の1つであることが知られています(Abd-El-Fattahら、2014年;Demirciら、2017年)。 スコポラミンは、ムスカリン性コリン作動性受容体の非選択的拮抗薬である(Jang et al, 2013; Kaur et al, 2017)。 数多くの研究により、スコポラミンがヒトおよび動物モデルにおいて学習および記憶の能力を損なうことが示されており、スコポラミン誘発ADモデルは、認知機能不全の研究および抗AD薬のスクリーニングに広く用いられている(Goverdhanら、2012年)。 スコポラミンは、コリン作動性神経伝達の減少、酸化ストレスの増加、および脳内の炎症の上昇に関連する認知障害を引き起こします(Lin and Beal, 2006)。 したがって、薬物は、コリン作動性機能を効果的に増強し、および/または酸化ストレスおよび炎症を減衰させ、スコポラミン誘発ADマウスの学習および記憶障害を逆転させることができ、最終的にADの治療に有用となるであろう」
以前に、Heら(2015a)は、HARがAChE活性を阻害し、APP/PS1トランスジェニックおよびスコポラミン誘発ADマウスなどの認知障害マウスの空間学習と記憶を大幅に改善できることを証明した。 本研究では、スコポラミン誘発マウスに対するHAL(2、5、10 mg/kg)およびHAR(10、20、30 mg/kg)の記憶改善効果をMWM行動評価法を用いて比較検討した。 スコポラミン(1 mg/kg)は、MWM課題においてマウスの空間学習および記憶能力を損傷することが確認され、これは我々の以前の研究(Heら、2015a;Liuら、2017)と一致した。 HAL(L、M、H投与)およびHAR(M、H投与)の投与後、逃避潜時および経路長が減少し、通過頻度が効果的に増加し(図2、3)、HALおよびHAR投与がスコポラミン誘発マウスの学習および空間記憶を顕著に改善し、HALの改善はHARの改善よりも有意であることが実証された。
スコポラミン誘発マウスにおけるHALとHARの学習・記憶改善の基礎的なメカニズムをさらに明らかにするために、コリン作動性システム、酸化ストレス、および炎症の変化を評価した。 先行文献(Abd-El-Fattahら、2014;Linら、2016;Demirciら、2017)で報告されているように、スコポラミンi.p.注入により、本研究ではコリン作動性機能の減衰、酸化ストレスおよび炎症の上昇を引き起こした。 ドネペジルはAChE阻害薬として軽度・中等度ADの代表的な対症療法であり(Bohnen et al., 2005)、近年の研究により炎症や酸化ストレスも抑制できることが明らかになっている(Saxena et al., 2008; Yoshiyama et al.) 今回、donepezil(ポジティブコントロール)は、スコポラミン誘発マウスのこれらの変化を効果的に改善し、学習・記憶を改善することができました。 試験管内での活性(Zhao et al., 2013; Liu et al., 2014)と同様に、HALとHARは異なる投与量で、スコポラミンによるAChE活性の上昇を逆転させただけでなく、大脳皮質、海馬または血漿中の神経伝達物質AChの上昇とChの低下をもたらした(図4、9、10)。 さらに、大脳皮質 AChE のタンパク質レベルは、HAL および HAR によって明らかに抑制された(図 6C,D)。 Ohら(2009)が報告したように、ChAT陽性ニューロンはスコポラミンで処理することで有意に減少した。 本結果は、HAL および HAR がスコポラミンによる ChAT 活性の低下を回復させること(図 4B、E)を示したが、ChAT のタンパク質発現には影響を与えず(図 6E、F)、さらなる立証が必要であった。 したがって、これらは、スコポラミンによって誘発された認知機能障害に対するHALおよびHARの抗健忘症効果は、おそらくコリン作動性システム(特にAChE)の修飾と関連しており、HALは低用量(2mg/kg)で明らかなコリン作動性改善を示したことを確認した。
さらに、多くの研究は、酸化ストレスの増加がAD発症の顕著な寄与リスク因子と広く考えられていることを示している(Ghumatkarら,2015;Luら、2018)。 HALおよびHARは内因性抗酸化物質として機能する可能性があり、フリーラジカルを捕捉することによって抗酸化能力を有することが見出された(Tse-Susanna et al, 1991; Berrougui et al., 2006a,b)。 本研究では、スコポラミン誘発マウスにおいて、活性酸素(脂質過酸化の産物であるMDA)の過剰生成と抗酸化酵素(SODとGSH-px)の減少が観察された(図5)。 しかし、HALとHARの投与は、スコポラミン誘発認知症マウスの大脳皮質において、SODとGSH-pxの抗酸化酵素を活性化し、MDAの生成を抑制することが確認され(図5)、さらに抗酸化防御能を改善し、HALとHARの神経保護効果を示すことが示された。 注目すべきは、HALとHARの抗酸化作用は概ね同等であったことである。
さらに、記憶障害が神経炎症の増加と関連していることを示唆する証拠が増えている(Abd-El-Fattah et al.、2014)。 Bensalemら(2014)の研究によれば、HALおよびHARは、それぞれ0.08および0.26μMのIC50で、MPOに対する有意な阻害を示した。 HARの抗炎症活性は、リポポリサッカライド刺激マウスRAW264およびヒトTHP-1細胞におけるTNF-αおよびNOを阻害することによって達成された(Patelら、2012年)。 特に、スコポラミンによって誘導された健忘マウスの脳では、炎症性サイトカイン(TNF-α、MPO)および炎症性メディエーター(NO)が高レベルで検出された(図4、図5)。 今回の研究では、HALとHARの投与により、NOの生成とTNF-αとMPOの上昇を同時に抑制できること、HALのTNF-αとNOに対する抑制作用はHARのそれよりも明らかであることが確認された(図4、図5)。 さらに、ウェスタンブロッティングおよび免疫蛍光分析の結果から、MPOのタンパク質発現レベルがHALおよびHARによって顕著に抑制されたことがさらに証明され(図7、8)、HALおよびHARの記憶障害に対する能力は、炎症マーカーTNF-α、MPOおよびNOの抑制によって仲介されている可能性が示唆された。
よく知られているように、ADは様々な神経伝達物質の不十分なレベルと関連している(Kumar and Singh, 2015; Svob Strac et al, 2015). 以前の研究では、スコポラミン単独を受けたマウスは、AChレベルの低下およびChAT活性の低下とともにAChE活性の上昇によって示されるように、コリン作動性システムの反応性のかなりの低下を示したことが報告されている(Leeら、2014年)。 ADのトランスジェニック動物モデルは、Gluレベルの低下を示し(Nilsenら、2012)、血清および血漿メタボロミクスは、ADモデルマウスまたは患者におけるTrp、5-HT、Glu、Phe、Tyrの減少も示した(Vermeirenら、2014;González-Domínguezら、2015;Wengら、2015;Corsoら、2017;Liら、2018)。 これに対応して、我々の結果は、スコポラミンによる認知症がACh、L-Trp、5-HT、L-Glu、L-Phe、L-Tyrの減少およびChとγ-GABAの上昇を伴うことを証明し、これは先行研究(Sculi et al, 1999; Nilsen et al., 2012; Lee et al., 2014; Vermeiren et al., 2014; González-Domínguez et al., 2015; Kumar and Singh, 2015; Weng et al., 2015; Zhou et al., 2016; Corso et al., 2017; Liu et al., 2017)と一致する。 神経伝達物質は、学習と記憶の多くの側面に関与する脳回路において重要な役割を果たし、特にコリン作動性、セロトニン作動性、グルタミン酸作動性、およびGABA作動性神経伝達物質が挙げられる(Vermeirenら、2014;Kumar and Singh、2015;Zhouら、2016)。 L-PheとL-Tyrを除く他の変化は、血漿と皮質においてHALとHARの両方の投与によって効果的に逆転させることができ、HALの変調はHARの変調よりも顕著であったことは注目に値する(図9、図10)。 したがって、HALとHARによるこれらの神経伝達物質の調節は、認知症マウスの学習・記憶能力を高めるのに有益であると考えられる。
一般に、HAL(2、5、10 mg/kg)およびHAR(20、30 mg/kg)はAChEの抑制およびChATの誘導を通じてコリン作動性神経伝達の亢進を示しました。 SOD および GSH-px 活性の上昇と MDA 産生の低下による抗酸化防御の強化、TNF-α、MPO および NO の低下による抗炎症作用の強化、重要な神経伝達物質(ACh、Ch、L-Trp、5-HT、γ-GABA および L-Glu)レベルの調節。 このように、HALとHARは、ADの治療薬として、複数のターゲットに作用する可能性があります。 さらに、HALのコリン作動性機能、炎症、神経伝達物質に対する調節作用は、HARよりも顕著であり、HALはHARと同様の抗酸化力を示しました。 特に、HALの有効量(2 mg/kg)はHARの有効量(20 mg/kg)よりもはるかに低く、これは主に2つの薬剤のバイオアベイラビリティと代謝安定性の違いによるものと思われます(Li et al.、2017b)。 これらの結果をすべてまとめると、HARと比較して、HALはAD治療のための優れた抗健忘症および薬物動態特性を有するより良い候補化合物である可能性があることが明らかになった<4914><9805>結論<4047><8536>要約すると、HALおよびHARは、コリン作動性システム機能の改善、酸化ストレスおよび炎症ダメージの抑制、ならびに認知症のマウスの重要な神経伝達物質の調節を介してスコポラミン誘発マウスの記憶障害を有効に改善し得ることが示された。 特にHALは、コリン作動性機能、炎症、神経伝達物質の調節がHARよりも顕著であり、HARと同等の抗酸化作用を示しました。 特に、HALの有効量(2mg/kg)は、HARの有効量(20mg/kg)よりはるかに少なかった。 これらの結果から、HALはADのような学習・記憶障害に対する優れた治療薬の候補となり得ることが示唆された。 HALの抗健忘効果や分子メカニズムについてさらなる評価を行う必要があり、ADの予防や治療のための実質的な初期証拠を提供することになる。
Author Contributions
S-PL and C-HW: Research designに参加、データ分析を行い、原稿を書いた、または執筆に貢献した。 S-PL, Y-WW, S-LQ, Y-PZ, GD, W-ZD, CM, Q-YL, H-DG, WL, and X-MC:実験を行った。
資金
この研究は中国国家自然科学基金と中国新疆ウイグル自治区(助成金番号:NO. U1130303)、中国国家自然科学基金(助成番号:81173119)、中国科学技術部重点プロジェクト(助成番号:No. 2012ZX09103201-051)、および中国上海市科学技術協力プロジェクト(助成番号14495800200)からC-HWに授与され、この研究の財政的支援を受けた。
利益相反声明
著者は、本研究が利益相反の可能性として解釈できるいかなる商業または財政的関係もない状態で行われたと宣言する
Abd-El-Fattah, M.A…, Abdelakader, N. F., and Zaki, H. F. (2014). ピロリジンジチオカルバメートはラットのスコポラミン誘発性認知機能障害から保護する。 Eur. J. Pharmacol. 723, 330-338. doi: 10.1016/j.ejphar.2013.11.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Aucoin, J. S., Jiang, P., Aznavour, N., Tong, X. K., Buttini, M., Descarries, L.、他 (2005).Therapy of cognitive impairment in a rat. アルツハイマー病モデルマウスにおける酸化ストレスによらない選択的なコリン作動性神経脱神経。 Neuroscience 132, 73-86. doi: 10.1016/j.neuroscience.2004.11.047
PubMed Abstract | CrossRef Full Text | Google Scholar
Bassani, T. B., Turnes, J. M., Moura, E. L., Bonato, J. M., Cóppola-Segovia,V., Zanata, S. M., et al. (2017). アルツハイマー型認知症のストレプトゾトシン誘発ラットモデルにおける短期空間・認識記憶、成体神経新生、神経炎症に対するクルクミンの効果。 Behavior. Brain Res. 335, 41-54. doi: 10.1016/j.bbr.2017.08.014
PubMed Abstract | CrossRef Full Text | Google Scholar
Bensalem, S., Soubhye, J., Aldib, I., Bournine, L., Nguyen, A. T., Vanhaeverbeek, M.ら (2014). Peganum harmala L. (Zygophyllaceae) のアルカロイドによるミエロペルオキシダーゼ活性の阻害. J. Ethnopharmacol. 154, 361-369. doi: 10.1016/j.jep.2014.03.070
PubMed Abstract | CrossRef Full Text | Google Scholar
Berrougui, H.Isabelle, M.Cloutier, M.Hmamouchi, M.and Khalil, A.(2006a). Peganum harmala L. extract, harmine and harmaline against human low-density lipoprotein oxidation(ヒト低密度リポタンパク質酸化に対するPeganum harmala L. extract, harmine and harmalineの保護効果). J. Pharm. Pharmacol. 58, 967-974. doi: 10.1211/jpp.58.7.0012
PubMed Abstract | CrossRef Full Text | Google Scholar
Berrougui, H., Martín-Cordero, C., Khalil, A., Hmamouchi, M., Ettaib, A. , Marhuenda, E., et al. (2006b). また、このような臓器移植は、臓器移植が成功した場合にのみ行われる。 Pharmacol. また、このような “痒い “状態から “痒い “状態を作り出すには、”痒い “状態から “痒い “状態を作り出すには、”痒い “状態から “痒い “状態を作り出すには、”痒い “状態から “痒い “状態を作り出すには、”痒い “状態から “痒い “状態を作り出すには、”痒い “状態から “痒い “状態を作り出すには、”痒い痒い “を作り出すには、”痒い痒い痒い “からは、ならないのだそうで。 アルツハイマー病におけるドネペジル治療による皮質アセチルコリンエステラーゼ活性の抑制の程度と認知効果。 J. Neurol. Neurosurg. Psychiatry 76, 315-319. doi: 10.1136/jnnp.2004.038729
PubMed Abstract | CrossRef Full Text | Google Scholar
Bromley-Brits, K., Deng, Y., and Song, W. H. (2011). アルツハイマー病モデルマウスの学習・記憶障害に対するモリス水迷路テスト。 J. Vis. 53, 1-5. doi: 10.3791/2920
PubMed Abstract | CrossRef Full Text | Google Scholar
Corso, G., Cristofano, A., Sapere, N., La Marca, G., Angiolillo, A., Vitale, M.、他 (2017).。 健常者とアルツハイマー型認知症患者またはその危険性のある患者における血清アミノ酸プロファイル。 Dement. Geriatr. Cogn. Dis. doi: 10.1159/000466688
PubMed Abstract | CrossRef Full Text | Google Scholar
Coyle, J. T., Price, D. L., and Delong, M. R. (1983)(2011). アルツハイマー病:大脳皮質コリン作動性神経支配の障害。 Science 219, 1184-1190. doi: 10.1126/science.6338589
CrossRef Full Text | Google Scholar
Demirci, K., Nazıroğlu, M., Övey,İ. S., and Balaban, H. (2017). セレンは、スコポラミン誘発認知症の高齢ラットの血液と脳におけるアポトーシス、炎症、酸化ストレスを減衰させる。 Metab. Brain Dis. 32, 321-329. doi: 10.1007/s11011-016-9903-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Fan, L. Y., and Chiu, M.J. (2014). アルツハイマー病の治療における併用療法と現在の概念、および今後の戦略。 Neuropsychiatr. Dis. Treat. 10, 439-451. doi: 10.2147/NDT.S45143
PubMed Abstract | CrossRef Full Text | Google Scholar
Frison, G., Favretto, D., Zancanaro, F., Fazzin, G., and Ferrara, S. D. (2008). Peganum harmala種子抽出物の摂取によるβ-カルボリンアルカロイド中毒の一例。 Forensic Sci. Int. 179, 37-43. doi: 10.1016/j.forsciint.2008.05.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Ghumatkar,P. J., Patil,S. P., Jain, P. D., Tambe,R. M., and Sathaye, S. (2015). スコポラミンによるマウスの健忘症におけるフロレチンの強心作用、神経保護作用、神経栄養作用。 Pharmacol. Biochem. Behav. 135, 182-191. doi: 10.1016/j.pbb.2015.06.005
PubMed Abstract | CrossRef Full Text | Google Scholar
González-Domínguez, R., García-Barrera, T., and Gómez-Ariza, J. L. (2015). Metabolite profiling for the identification of altered metabolic pathways in Alzheimer’s disease(アルツハイマー病における代謝経路の変化を特定するための代謝物プロファイリング). J. Pharm. Biomed. Anal. 107, 75-81. doi: 10.1016/j.jpba.2014.10.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Goverdhan, P., Sravanthi, A., and Mamatha, T. (2012). スコポラミン誘発の認知障害と酸化ストレスにおけるメロキシカムとセレギリンの神経保護効果。 Int. J. Alzheimers Dis. 2012, 1-8. doi: 10.1155/2012/974013
PubMed Abstract | CrossRef Full Text | Google Scholar
Gray, E., Thomas, T. L., Betmouni, S., Scolding, N., and Love, S. (2008). 多発性硬化症の脱髄大脳皮質におけるミエロペルオキシダーゼの活性上昇とミクログリア発現. Brain Pathol. 18, 86-95. doi: 10.1111/j.1750-3639.2007.00110.x
PubMed Abstract | CrossRef Full Text | Google Scholar
He, D. D., Wu, H., Wei, Y., Liu, W., Huang, F., Shi, H. L., et al. (2015a). APP/PS1トランスジェニックマウスおよびスコポラミン誘発記憶障害マウスの空間学習・記憶に対するアセチルコリンエステラーゼ阻害剤であるハルミンの効果。 Eur. J. Pharmacol. 768, 96-107. doi: 10.1016/j.ejphar.2015.10.037
PubMed Abstract | CrossRef Full Text | Google Scholar
He, D.D., Zhang, L., Liu, L., Wu, X.J., Cheng, X.M., and Wang, C.H. (2015b). Peganum harmalaの種子から得た総アルカロイドはマウスの学習能力と記憶を改善する。 Chin. Tradit. Pat. Med. 37, 478-482.
Heneka, M. T., Carson, M. J., El Khoury, J., Landreth, G. E., Brosseron, F., Feinstein, D. L., et al (2015). アルツハイマー病における神経炎症。 Lancet Neurol. 14, 388-405. doi: 10.1016/S1474-4422(15)70016-5
CrossRef Full Text | Google Scholar
Herraiz, T., Gonzalez, D., Ancin-Azpilicueta, C., Arán, V. J., and Guillén, H. (2010). Peganum harmala の β-カルボリンアルカロイドとヒトモノアミン酸化酵素 (MAO) の阻害。 Food Chem. Toxicol. 48, 839-845. doi: 10.1016/j.fct.2009.12.019
PubMed Abstract | CrossRef Full Text | Google Scholar
Jang, Y. J., Kim, J., Shim, J., Kim, C.Y., Jang, J.H., Lee, K.W., and al. (2013). カフェインレスコーヒーがスコポラミンによるラットの記憶障害を予防する。 Behav. Brain Res. 245, 113-119. doi: 10.1016/j.bbr.2013.02.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Jeon, S. J., Kim, B., Park, H. J., Zhang, J. B., Kwon, Y., Kim, D. H., et al(2017).の項参照。 スコポラミンによる記憶障害に対する1-パルミトイル-2-リノレオイル-3-アセチルグリセロールのアセチルコリンエステラーゼ阻害およびLTP活性化による改善効果。 Behav. Brain Res. 324, 58-65. doi: 10.1016/j.bbr.2017.01.040
PubMed Abstract | CrossRef Full Text | Google Scholar
Jiang, B. (2016). Peganum harmala由来のアルカロイドの血液脳関門を介した輸送とラット脳内神経伝達物質への作用機構に関する研究. 博士論文、上海中医薬大学、上海.
Jiménez, J., Riveron-Negrete, L., Abdullaev, F., Espinosa-Aguirrec, J., and Rodríguez-Arnaiza, R. (2008). β-カルボリンアルカロイドであるハルミンおよびハルマリンのヒト細胞アッセイにおけるin vitroでの細胞毒性. Exp. Toxicol. Pathol. 60, 381-389. doi: 10.1016/j.etp.2007.12.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Kaur, R., Singh, V., and Shri, R. (2017). Ganoderma種の抗健忘効果:コリン作動性および抗酸化機構の可能性。 Biomed. Pharmacother. 92, 1055-1061. doi: 10.1016/j.biopha.2017.06.029
PubMed Abstract | CrossRef Full Text | Google Scholar
Kouémou, N. E., Taiwe, G. S., Moto, F. C. O., Pale, S., Gwladys, N. T., Njapdounke, J. S. K., et al. (2017). アルツハイマー病のスコポラミンマウスモデルに対するdichrocephala integrifoliaの向精神作用と神経保護作用。 Front. Pharmacol. 8:847. doi: 10.3389/fphar.2017.00847
CrossRef Full Text | Google Scholar
Kumar, A., and Singh, A. (2015). アルツハイマー病の病態生理とその管理に関するレビュー:アップデート。 Pharmacol. Rep. 67, 195-203. doi: 10.1016/j.pharep.2014.09.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Kwon, S. H., Lee, H. K. , Kim, J. A., Hong, S. I., Kim, H. C., Jo, T. H. , 他 (2010). クロロゲン酸の抗アセチルコリンエステラーゼおよび抗酸化活性を介したスコポラミン誘発健忘症に対するマウス神経保護効果。 Eur. J. Pharmacol. 649, 210-217. doi: 10.1016/j.ejphar.2010.09.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Lee, H. E., Jeon, S. J. , Ryu, B., Park, S. J. , Ko, S. Y., Lee, Y. , et al. C-グルコシルフラボンであるSwertisinは、そのアデノシンA1受容体拮抗特性により、スコポラミンによるマウスの記憶障害を改善する。 ビヘイビア. Brain Res. 306, 137-145. doi: 10.1016/j.bbr.2016.03.030
PubMed Abstract | CrossRef Full Text | Google Scholar
Lee, S., Kim, J., Seo, S.G., Choi, B.R., Han, J.S., Lee, K. W.他 (2014).スウォルティシン(C-グルコシルフラボン)は、スコポラミンに誘発される記憶障害を改善する。 スルフォラファンはスコポラミンによるマウスの記憶障害を緩和する。 Pharmacol. Res. 85, 23-32. doi: 10.1016/j.phrs.2014.05.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Li,J., Liu,Y., Li,W., Wang,Z., Guo,P., Li, L.et al. (2018). アルツハイマー病マウスモデルにおけるジンセノサイドReの効果に関する代謝プロファイリング。 Behav. Brain Res. 337, 160-172. doi: 10.1016/j.bbr.2017.09.027
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, S. P., Cheng, X. M., and Wang, C.H. (2017a). Peganum属の伝統的用途、植物化学、薬理学、薬物動態学および毒物学に関するレビュー。 J. Ethnopharmacol. 203, 127-162. doi: 10.1016/j.jep.2017.03.049
PubMed Abstract | CrossRef Full Text | Google Scholar
Li,S. P., Zhang,Y. P., Deng, G., Wang,Y. W., Qi,S. L., Cheng,X. M., et al. (2017b). 多剤耐性タンパク質2の排出トランスポーターに基づく類似のβ-カルボリンアルカロイドであるハルマリンとハルミンの曝露特性 Front. Pharmacol. 8:541. doi: 10.3389/fphar.2017.00541
CrossRef Full Text | Google Scholar
Lin, J. J., Huang, L., Yu, J., Xiang, S. Y., Wang, J. L., Zhang, J. R., et al (2016). 海洋性カロテノイドであるフコキサンチンは、スコポラミンによるマウスの認知障害を回復させ、in vitroでアセチルコリンエステラーゼを阻害する。 Mar. Drugs 14:67. doi: 10.3390/md14040067
PubMed Abstract | CrossRef Full Text | Google Scholar
Lin, M. T., and Beal, M. F. (2006). 神経変性疾患におけるミトコンドリア機能障害と酸化ストレス。 Nature 443, 787-795. doi: 10.1038/nature05292
PubMed Abstract | CrossRef Full Text | Google Scholar
Liu,W., Yang,Y. D., Cheng,X. M., Gong,C., Li,S. P., He,D. D., et al. (2014). UPLC-ESIMS/MSによるアセチル-およびブチリル-コリンエステラーゼ阻害剤の阻害活性の迅速かつ高感度な検出。 J. Pharm. Biomed. Anal. 94, 215-220. doi: 10.1016/j.jpba.2014.02.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Liu, W., Zhu, Y. D., Wang, Y. L., Qi, S. L., Wang, Y. W., Ma, C.、他 (2017). Peganum harmalaの地上部からの抽出物およびアルカロイド画分のスコポラミン誘発性記憶障害に対する抗健忘症効果(マウス). J. Ethnopharmacol. 204, 95-106. doi: 10.1016/j.jep.2017.04.019
PubMed Abstract | CrossRef Full Text | Google Scholar
Louis, E. D., Jiang, W., Gerbin, M., Mullaney, M. M., and Zheng, W. (2010). 家族性本態性振戦,散発性本態性振戦および対照群における血中ハルマン濃度およびハルミン濃度の関係。 Neurotoxicology 31, 674-679. doi: 10.1016/j.neuro.2010.08.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Lu, C., Dong, L. M., Lv, J. W., Wang, Y., Fan, B., Wang, F.、他 (2018).Hope. 20(S)-protopanaxadiol (PPD) alleviates scopolamine-induced memory impairment via regulation of cholinergic and antioxidant systems, and expression of Egr-1, c-Fos and c-Jun in mice.(20(S)-プロトパナキサディオール(PPD)は、スコポラミンによる記憶障害を緩和する。 Chem. Biol. Interact. 279, 64-72. doi: 10.1016/j.cbi.2017.11.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Mahmoudian, M., Jalipour, H., and Dardashti, P. S. (2002). Peganum harmala の毒性:レビューと症例報告。 Iran. J. Pharmacol. Ther. 1, 1-4.
Google Scholar
Malik, J., Kaur, J., and Choudhary, S. (2017)(2017). Lactuca sativa Linn.の標準化エキスとそのフラクションは、マウスのスコポラミン誘発性健忘症を無効化する:コリン作動性および抗酸化機構の可能性。 Nutr. Neurosci. 1-12. doi: 10.1080/1028415X.2017.1291166 .
PubMed Abstract | CrossRef Full Text | Google Scholar
Morris, R. G., Garrud, P., Rawlins, J. A., and O’Keefe, J. (1982). 海馬を損傷したラットでは場所のナビゲーションが損なわれた。 Nature 297, 681-683. doi: 10.1038/297681a0
CrossRef Full Text | Google Scholar
Nilsen, L. H., Melø, T. M., Sæther, O., Witter, M. P., and Sonnewald, U. (2012). アルツハイマー病のMcGill-R-Thy1-APPラットモデルにおける神経化学プロファイルの変化:縦断的in vivo 1H MRS研究. J. Neurochem. 123, 532-541. doi: 10.1111/jnc.12003
PubMed Abstract | CrossRef Full Text | Google Scholar
Oh, J.H., Choi, B.J., Chang, M.S., and Park, S.K. (2009). Nelumbo nucifera 精液エキスは、コリンアセチルトランスフェラーゼの発現誘導を介して、スコポラミン誘発性健忘症のラットの記憶を改善する。 Neurosci. Lett. 461, 41-44. doi: 10.1016/j.neulet.2009.05.045
PubMed Abstract | CrossRef Full Text | Google Scholar
Patel, K., Gadewar, M., Tripathi, R., Prasad, S.K. , and Patel, D.K. (2012). β-カルボリンアルカロイド “Harmine “の薬効、薬理活性および生体分析的側面に関する総説. Asian Pac. J. Trop. Biomed. 2, 660-664. doi: 10.1016/S2221-1691(12)60116-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Rijpma, A., Meulenbroek, O., and Rikkert, M.O. (2014). アルツハイマー病におけるコリンエステラーゼ阻害薬とアドオン栄養補助食品:無作為化対照試験のシステマティックレビュー。 エイジング・レッスン. Rev. 16, 105-112. doi: 10.1016/j.arr.2014.06.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Saxena, G., Singh, S. P., Agrawal, R., and Nath, C. (2008). マウス脳内ストレプトゾトシン誘発認知症モデルにおける酸化ストレスに対するドネペジルとタクリンの効果. Eur. J. Pharmacol. 581, 283-289. doi: 10.1016/j.ejphar.2007.12.009
PubMed Abstract | CrossRef Full Text | Google Scholar
Scali, C., Prosperi, C., Giovannelli, L., Bianchi, L…, β(1-40)アミロイドペプチドのラット基底核への注入はミクログリア反応を誘発し、in vivoで皮質γ-アミノ酪酸放出を促進する。 Brain Res. 831, 319-321. doi: 10.1016/S0006-8993(99)01492-4
CrossRef Full Text | Google Scholar
Shi, X. Y., Liu, W., Zhang, L., Li, S. P., Cheng, X. M., Xi, Y., and al. (2014). Peganum harmala L.の総アルカロイド抽出物を投与したラットにおけるハルマリン、ハルミンおよびその代謝物の薬物動態 Chin. Tradit. Pat. Med. 36, 1169-1175. doi: 10.3969/j.issn.1001-1528.2014.06.013
CrossRef Full Text | Google Scholar
Singh, S., Kaur, H., and Sandhir, R.(2016年). フラクタル次元:モリス水迷路を用いた空間記憶と学習を評価するための新しいパラダイム。 Behav. Brain Res. 299, 141-146. doi: 10.1016/j.bbr.2015.11.023
PubMed Abstract | CrossRef Full Text | Google Scholar
Svob Strac, D., Muck-Seler, D., and Pivac, N. (2015). アルツハイマー病患者の脳脊髄液における神経伝達物質測定:レビュー。 Psychiatr. Danub. 27, 14-24.
Google Scholar
Tse-Susanna, Y. H., Mak, I. T., and Dickens, B. F. (1991). ハルマンとβ-カルボリンアルカロイドの抗酸化作用. Biochem. Pharmacol. 42, 459-464. doi: 10.1016/0006-2952(91)90305-O
CrossRef Full Text | Google Scholar
Vermeiren, Y., Van Dam, D., Aerts, T., Engelborghs, S., and De Deyn, P. P. (2014). うつ病および攻撃的なアルツハイマー病患者の死後脳領域におけるモノアミン作動性神経伝達物質の変化. Neurobiol. Aging 35, 2691-2700. doi: 10.1016/j.neurobiolaging.2014.05.031
PubMed Abstract | CrossRef Full Text | Google Scholar
Verri, M., Pastoris, O., Dossena, M., Aquilani, R., Guerriero, F., Cuzzoni, G.ら (2012). アルツハイマー病におけるミトコンドリア変化、酸化ストレス、神経炎症。 Int. J. Immunopathol. Pharmacol. 25, 345-353. doi: 10.1177/039463201202500204
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, C.H., Zhang, Z.X., Wang, Y.H., and He, X.J. (2015). 有毒植物Peganum harmala由来のヒト白血病細胞株に対する細胞毒性インドールアルカロイド。 Toxins 7, 4507-4518. doi: 10.3390/toxins7114507
PubMed Abstract | CrossRef Full Text | Google Scholar
Weng, R., Shen, S.S., Tian, Y. L., Burton, C., Xu, X.Y., Liu, Y., et al. (2015). メタボロミクスアプローチにより、セロトニン欠乏症に関連する統合的な代謝ネットワークが明らかになりました。 Sci. Rep. 5:11864. doi: 10.1038/srep11864
PubMed Abstract | CrossRef Full Text | Google Scholar
Yoshiyama, Y., Kojima, A. , Ishikawa, C. and Arai, K. (2010). ドネペジルの抗炎症作用はタウパチーマウスモードにおけるタウ病理、シナプス損失、神経変性を改善する。 J. Alzheimers Dis. 22, 295-306. doi: 10.3233/JAD-2010-100681
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhang, L. (2013). Peganum harmala 由来の総アルカロイドのフィルムコーティング錠に関する研究。 Master Dissertation, Shanghai University of Traditional Chinese Medicine, Shanghai.
Zhao, T., Ding, K.M., Zhang, L., Cheng, X.M., Wang, C.H., and Wang, Z.T. (2013). を用いた,Peganum 属植物由来のβ-カルボリンおよびキノリンアルカロイド誘導体のアセチルコリンエステラーゼおよびブチリルコリンエステラーゼ阻害活性を明らかにした。 J. Chem. 2013:717232. doi: 10.1155/2013/717232
CrossRef Full Text | Google Scholar
Zhou,X. L., Li,Y. F., Shi,X. Z., and Ma,C. (2016). アルツハイマー病におけるアミロイドβレベルを減衰させる治療薬に関する概要:神経伝達、炎症、酸化ストレス、コレステロールレベルの上昇を標的とする。 Am. J. Transl. Res. 8, 246-269.
PubMed Abstract|Google Scholar
.
Leave a Reply