Frontiers in Oncology
背景
放射線による骨粗鬆症とそれに伴う不全骨折(IF)は非常によくあることである。 腹部や骨盤への放射線照射後に報告されたIFの発生率は、7~45%である(1-8)。 乳癌や前立腺癌のホルモン治療のようなある種の腫瘍学的状況では、臨床医は治療に関連した骨粗鬆症や骨折のリスクに精通している(9-13)。 二重エネルギーX線吸収法(DEXA)はルーチンに行われ、カルシウム、ビタミンD、ビフォスフォネートなどの骨粗鬆症予防薬は、患者のフォローアップ中に予防的に服用されている。 しかし、骨の健康状態をルーチンに評価することはなく、放射線に関連する骨毒性やIFについて放射線腫瘍医の間で認識されていない。 IFは腹部や骨盤照射後の患者の経過観察でしばしば遭遇し、最近では定位照射後に非常に高い頻度で観察されるが、放射線腫瘍科の診療ではDEXAや他の代替的な骨密度(BMD)測定を考慮することはない(1-8, 14-16)。 放射線腫瘍医がIFを認識していないため、これらのIFはしばしば認識されず、時には原発がんの骨転移とみなされることもあり、結果として不正行為や不必要な検査、患者の心理的ストレスが生じる。
我々は最近、腹部照射を受けた患者の椎体骨折リスク9.6%を証明した(8)。 放射線治療計画において、骨はリスクのある臓器として考慮されるべきであり、これらの患者において放射線照射の前後にBMDを定期的に測定し、追跡調査すべきであると考える。 放射線腫瘍医は、最も重要なツールである放射線治療計画システムを使用することで、患者の骨の健康状態や未認識のIFを判断できる。
BMD は骨塩量とカルシウム密度の指標で、DEXAで測定される(17、18)。 DEXAは現在、BMD定量化のゴールドスタンダード法とされており、骨折リスクや治療効果との相関が示されている(17, 18)。 いくつかの研究により、コンピュータ断層撮影(CT)により得られたハウンズフィールド単位(HU)は、DEXAにより得られたBMDと強い相関があることが示されている(19-22)。 HU値は、局所的な骨強度およびBMDの信頼できる推定値を提供し、高い精度で骨粗鬆症を除外するために利用することができる(19-22)。 さらに、DEXAと比較した場合、CTスキャンは椎体骨折をより正確に同定することができる(23)。 診断および放射線計画用CT検査は、病期診断、放射線治療計画、患者のフォローアップのために定期的に行われる。 このような患者に対して、CTから得られるHUをBMDの測定やモニタリングに利用することで、DEXA測定による余分なコストや追加被曝を回避することができるのである。 これらの利点に加え、CTスキャンから容易に再構成された矢状面の椎体ビューは、認識されていない非症状の骨折の評価に使用できる。
本研究の目的は、腹部放射線治療を受ける患者の治療計画システムに取り込んだCTスキャンから椎体のHUと矢状面の再構成を測定することにより、骨密度損失と未診断椎体骨折を実証することである。
方法
胃腺癌の手術を受け、補助的な腹部放射線治療を受けた57名の連続した患者を研究グループに含めた。 対照群には術後補助療法を必要としない早期癌患者34名を選んだ。
放射線照射を受けた患者には,6または15MVの光子をコンフォーマル,強度変調,または体積変調アーク治療計画のいずれかで照射した。 照射線量は1日2Gy,23分割で46Gy,1日1,8Gy,25分割で45Gy,週5日,5週間であった。 5-フルオロウラシルは、放射線治療前に1サイクル、放射線治療と同時に2サイクル、放射線治療後に1サイクル、ボーラスまたは点滴で投与された。
計画および診断用断層撮影は、マルチ検出器CTスキャナー(LightSpeed 16スライスまたはVCT 64スライス;GE Healthcare、Waukesha、WI)を用いて3mmまたは5mmのスライス厚で行われた。 腹部断層写真は放射線画像保管通信システムからEclipse Treatment Planning System (TPS) (Varian Medical Systems, Palo Alto, CA)に取り込まれた. 研究グループでは、最初の断層写真はすでに放射線計画用の治療計画システムに入っていた。 2枚目は放射線治療の1年後に撮影し、治療計画システムに取り込んだ。 対照群では、手術直後と1年後に撮影された腹部断層写真が治療計画システムに取り込まれた。 T12-L1-L2椎体の輪郭は、放射線腫瘍医が照射患者の各椎体に対する平均線量を決定するために作成した。 その後、TPSを使用して経験豊富な放射線技師が全患者の同じ椎骨の平均HU値を決定した。 両群の平均HU値は1年後に再測定された。
試験開始時のHU値と1年後に得られたHU値を各群の椎体ごとに算出し、HUの変化率(Δ%HU)を決定した。 HUの測定期間は当初と1年後を予定していたが、治療後少なくとも5年間は定期的に経過観察を続け、腫瘍学的なアウトカムを検討した。 椎体圧迫骨折が発生した場合は、追跡調査中のコンピュータ断層写真から椎体の矢状面の再構成から判断した。
HU 測定法
HU はT12、L1、L2椎体の海綿体領域の軸断面で測定した。 各椎体を軸方向に3分割し、椎体上の海綿骨領域上に矩形の関心領域(ROI)を配置してHUを算出した。 後方の椎骨下静脈叢や軟骨下硬化骨を避けるようにした。 測定結果は補足図1に詳述した。 各椎体における3軸セグメントの平均HU値を平均し、各椎体の最終的なHU値を決定した。 HUpreは試験群、対照群ともに初回CTで測定したHU値、HUpostは1年後に測定したHU値である。
統計解析
各椎体の骨減衰の減少率(Δ%HU)は、以下の式で算出した:
グループの年齢、性別および腫瘍特性の間の差を示すためにカイ二乗分析が行われた。 各群におけるHU値の前後差、2群間差、試験群における3つの放射線量レベル(<20Gy、20-40Gy、>40Gy)についての差を調べるためにStudents t-testを使用した。 Δ%HUの変化に対する放射線量の影響を直接評価するために、Δ%HUと放射線量についてピアソンの相関分析を行った。 p値<4623>0.05を有意とした。 統計解析はStatistical Package for Social Sciences (SPSS) software 17.0を用いて行った。
Results
患者および治療の詳細は表1に示した。 年齢、性別、外科的切除の種類、腫瘍の位置に関して、群間で統計的に有意な差はなかった。 T12、L1、L2椎骨の平均HU値は両群で測定された。 試験開始時、試験群と対照群の間で、すべての椎骨のHU値測定に統計的に有意な差はなかった。 1年後、試験群ではT12、L1、L2椎骨の平均HU値が有意に減少した(各椎骨でp < 0.001)のに対し、対照群では同期間にHU値に有意な変化は認められなかった(p:それぞれ0.09-0.08-0.24)。 表2に試験群と対照群のHUの変化をまとめた。
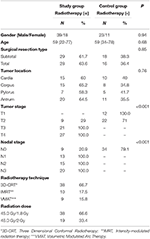
Table 1. 患者および治療特性。

Table 2.試験群および対照群のHUの変化。
試験群におけるT12、L1、L2椎骨の平均照射線量はそれぞれ34.55±11.1;31.82±12.4;30.37±13.6Gyであった。 Δ%HUと各椎骨が受けた放射線量との間に負の有意な相関が認められた。 放射線量が増加すると、各椎体においてHUは減少した。 これを図1-3にまとめた。
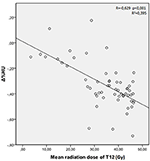
Figure 1.1.図1.1.図1. T12椎骨のΔ%HUと被曝線量の相関。
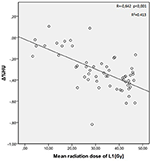
Figure 2.1. L1椎骨のΔ%HUと被曝線量との関係(図3)。 L2椎骨のΔ%HUと受けた放射線量の相関
椎骨の受けた放射線量とHU変化との関係を表3にまとめた。 20Gy以上の線量ではHU値の減少は統計的に有意であったが、20Gy以下の線量ではL2椎骨を除いてHU値に有意な変化はなかった。
骨折
対照群では骨折をした患者はいなかったが、照射群では57例中4例(%7)が試験期間中に椎体骨折を起こした。 椎体骨折のうち2例は女性に認められたが,2例は男性に認められた。 骨折は照射後16、18、20、26ヶ月目に確認され、追跡期間の中央値は24ヶ月(範囲:12-36ヶ月)であった。 骨折は3人の患者のL1椎体と1人の患者のL2椎体に観察された。 各骨折した椎骨が受けた平均放射線量は、39, 28.5, 22.3, 31 Gyであった。 椎体骨折患者の特徴を補足表1および補足図2にまとめた。
考察
放射線治療は直接的、間接的に骨粗鬆症を引き起こし、臨床では骨盤または腹部照射後にIFが頻繁に発生する(1-8)。 脊椎や骨盤領域のIFはよく見られ、放射線治療の重要な後発副作用である。 しかし、放射線腫瘍医は放射線による骨粗鬆症や骨毒性について認識していない。 このため、この重要な晩期合併症を予防するために特別な注意が払われていない。 我々は以前の研究(8)でこの問題の重要性を強調しようとし、骨盤内腫瘍に対する放射線照射を受けた患者と同様に腹部照射後に非常に高い頻度で椎体骨折が発生することを報告した(1-7)。 これらの非常に密接に追跡される合併症に対するグレードIII/IVの晩期毒性率は一定の割合以上ではないが、腹部、または骨盤放射線治療に関連する骨毒性とそれに起因する骨折は、よく知られたグレードIII/IVの晩期毒性よりも実際に高いものである。
最新版のCommon Terminology Criteria for Adverse Events (CTCAE) Version 5.0でも、放射線照射による骨毒性の具体的な定義はない(24)。 放射線腫瘍診療において、骨に対する毒性評価基準は存在しない。 LENT-SOMAの晩期毒性スコアリングテーブルでも、QUANTECのレポートでも、骨はリスクのある臓器と定義されておらず、この組織に対する線量や体積の制約も定義されていない(25, 26)。 しかし、これまでの研究や最近発表された我々の研究により、骨粗鬆症と骨折のリスクを真剣に考慮し、放射線関連骨折を防ぐために放射線照射患者のフォローアップ中に必要な注意を払う必要があることが示された(1-8)
DEXAはBMD定量化と骨粗鬆症のルーチンスクリーニングにおけるゴールドスタンダード方法である。 放射線腫瘍医は、骨盤または腹部照射を受ける患者に対してDEXAを注文することはない。 また、放射線治療前に骨折のリスク評価や骨粗鬆症の有無について内分泌学者と相談することもない。 しかし、放射線腫瘍医として、BMDと骨粗鬆症のリスクを決定するために、我々の計画システムを使用することができる。 これらの評価は、病期分類のため、あるいは放射線治療計画のため、患者のフォローアップのためにオーダーされたCTスキャンによって容易に行うことができる。 CT画像から骨のHU値を測定し、照射部位の矢状面画像を作成することにより、BMDの減少、骨粗鬆症、気づかない骨折を判断することができる。 Pickhardtら(22)は、骨HU値がどのように測定され、BMDおよび骨粗鬆症診断の確立のためのDEXAの代替物として使用され得るかを明確に定義している。 これらの研究では、骨HU値が100未満は骨粗鬆症を、100から160は骨減少症を、160以上は正常な骨密度を示すと考えられている(19-22)。 HU値が160以上の患者は、骨密度が正常であるため、DEXA測定は必要なく、骨の健康状態を気にする必要はない。 HU 値が 100 から 160 の患者は骨減少症とみなすことができ、将来の骨粗鬆症と骨折のリスク予防のために早期の介入が必要である。 HU 値が 100 未満の患者は、骨粗鬆症と見なすべきである。 低 HU 値は、放射線が照射される骨部位の将来の骨折リスクを放射線腫瘍医に警告する必要がある。 このような患者は、放射線治療を行う前に内分泌学者と相談する必要がある。 骨密度や骨粗鬆症の判定にHUとDEXAを比較した研究では、DEXAで非骨粗鬆症群に入る患者がCTスキャンからHUを求める際に椎体骨折が発見されることがあった(22、29-31)
本研究では、放射線腫瘍医にとって骨粗鬆症を簡単に診断し骨折リスクを判断する方法を模索した。
対照群ではベースラインと1年後に得られたT12、L1、L2椎骨のHU値に統計的有意差はなかったが、放射線照射患者ではHU値が有意に低下していることがわかった。 椎体骨折は被曝者のみで認められた。 中央値24ヵ月の追跡の結果、57人中4人が椎体骨折を起こし、骨折の累積発生率は7%であった。 追跡期間が短く、ほとんどが無症状であったが、より追跡期間の長い我々の先行研究では骨折発生率は9.6%と報告されており、そのほとんどが有症状であった(8)。 これらの患者では骨折のリスクが高いので注意が必要であり、骨は危険な臓器として考慮されるべきである。 放射線治療後の骨折の発生期間は2~63ヶ月と報告されている(2, 14)。 興味深いことに、グレードIVの晩期放射線障害としての骨折は、放射線線維症、膀胱炎、直腸炎などの他のよく知られた晩期放射線障害よりも高い発生率で観察される。 椎骨に受けた放射線量が高いほど、骨のHU値の減少のリスクが高かった。 しかし、20Gy以下の線量を受けた椎体では、HU値の減少は有意ではなかった。
文献では、骨量減少が観察される放射線量に関して矛盾する知見がある。 ある研究では22.5Gyの骨盤照射を受けた患者でBMDの減少が認められたが、別の研究では放射線量と不全骨折のリスクには相関がないことが示された(32, 33)。 Weiら(33)は、腹部放射線治療を受けた患者では、5Gyの椎体照射量でも有意なBMDの低下とIFを生じることを報告した。 彼らは、特に放射線治療計画時に検出されたHU値が低い患者に対しては、椎体への照射線量を制限することを推奨している。 従って、照射野内の椎体に対する線量制約を定義する必要がある。 線量制約は放射線治療計画時に測定されたHU値によって異なる可能性がある。 特に高齢者やすでに骨粗鬆症のある患者においては、照射野内の椎骨の平均線量を減らすよう努力すべきである。
結論
放射線による骨粗鬆症とそれに伴う不全骨折(IF)は非常に一般的である。 BMDの減少、骨粗鬆症、気づかない骨折は、計画システムに取り込んだ患者のCTスキャンから骨のHU値を測定し、照射された骨領域の矢状面画像を再構成することで発見できる。 放射線治療計画中に検出された骨のHU値が既に低い患者には、早期に介入して骨の健康を回復し、将来の放射線関連骨折を予防することができる。 放射線に関連する骨毒性を防ぐために、治療計画時に既にHU値が低い椎骨への放射線量は20Gy以下に制限する必要がある。
Data Availability Statement
論文に記載された資料は、すべての関連生データを含め、非商業的な目的で使用したい科学者は誰でも、参加者の秘密を破ることなく自由に利用でき、対応する著者から入手できる。
Ethics Statement
我々の研究はヘルシンキ宣言に従って実施された。 本研究は、Dr. Lutfi Kirdar Kartal Education and Research Hospitalの倫理委員会により承認された(2017/514/109/2)。 本研究の参加者全員から書面によるインフォームドコンセントを得ている
Author Contributions
GY:研究全体の整合性の保証人。 GYとCG:研究のコンセプトとデザイン。 NC:文献調査。 GY、CG、IK、OS、NC:臨床試験。 GY:統計解析。 OS:原稿作成。 CG:原稿編集。
Conflict of Interest
著者らは、潜在的な利益相反と解釈される商業的または金銭的関係がない状態で研究が行われたことを宣言する。
Supplementary Material
この記事の補足資料は、オンラインで見ることができる。 https://www.frontiersin.org/articles/10.3389/fonc.2020.00742/full#supplementary-material
略語
IFs, Insufficiency fractures; DEXA, Dual energy x-ray absorptiometry; BMD, Bone mineral density; CT, Computerized tomography; HU, Hounsfield unit; Δ%HU, Percent change in HU.Pent; ROI, Region of Interest; SPSS, Statistical package for the social sciences; CTCAE, Common terminology criteria for adverse event; QUANTEC, Quantitative analyses of normal tissue effects in the clinic.(臨床における正常組織影響の定量分析
1. Oh D, Huh SJ. 放射線治療後の不全骨折。 Radiat Oncol J. (2014) 32:213-20. doi: 10.3857/roj.2014.32.4.213
PubMed Abstract | CrossRef Full Text | Google Scholar
2.Higham CE, Faithfull SJ.放射線治療後の不全骨折。 骨の健康と骨盤放射線治療。 Clin Oncol. (2015) 11:668-78. doi: 10.1016/j.clon.2015.07.006
CrossRef Full Text | Google Scholar
3. Shih KK, Folkert MR, Kollmeier MA, Abu-Rustum NR, Sonoda Y, Leitao MM Jr, et al. 術後骨盤放射線治療をした頸癌、子宮内膜癌患者の骨盤不全骨折の件. Gynecol Oncol. (2013) 128:540-3. doi: 10.1016/j.ygyno.2012.12.021
PubMed Abstract | CrossRef Full Text | Google Scholar
4.骨盤内不全骨折は、術後骨盤内放射線治療を受けた子宮頸癌患者の骨盤内不全骨折の一つである。 上園浩、辻野和彦、森木紘一、長野史、太田泰、佐々木亮、他 子宮頸癌に対する根治的放射線治療後の骨盤不全骨折:危険因子のレトロスペクティブ解析。 J Radiat Res. (2013) 54:1102-9. doi: 10.1093/jrr/rrt055
PubMed Abstract | CrossRef Full Text | Google Scholar
5.子宮頸がんの放射線治療後の骨盤内不全骨折:リスクファクターのレトロスペクティブな分析。 Igdem S, Alco G, Ercan T, Barlan M, Ganiyusufoglu K, Unalan B, et al. 前立腺がん患者における骨盤放射線治療後の不全骨折。 Int J Radiat Oncol Biol Phys. (2010) 77:818-23. doi: 10.1016/j.ijrobp.2009.05.059
PubMed Abstract | CrossRef Full Text | Google Scholar
6.骨盤放射線治療後の不全骨折。 Schmeler KM, Jhingram A, Iyer RB, Sun CC, Eifel PJ, Soliman PT, et al. 子宮頸癌に対する放射線治療後の骨盤骨折:サバイバーに対する意味合い。 Cancer. (2010) 116:625-30. doi: 10.1002/cncr.24811
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Kim HJ, Boland PJ, Meredith DS, Lis E, Zhang Z, Shi W, et al. 直腸癌の化学放射線療法後の仙骨骨折:発生率、危険因子、X線検査評価. Int J Radiat Oncol. (2012) 84:694-9. doi: 10.1016/j.ijrobp.2012.01.021
PubMed Abstract | CrossRef Full Text | Google Scholar
8.直腸癌の化学放射線療法後の仙骨骨折の発生率、リスクファクター、および放射線学的評価。 Yaprak G, Gemici C, Temizkan S, Ozdemir S, Dogan BC, Seseogullari OO. 胃癌患者における腹部照射後の骨粗鬆症発症と椎体骨折。 BMC Cancer. (2018) 18:972. doi: 10.1186/s12885-018-4899-z
PubMed Abstract | CrossRef Full Text | Google Scholar
9.胃がん患者における骨粗鬆症の発症と椎体骨折(P.O.)。 Lustberg MB, Reinbolt RE, Shapiro CL. 成人がんサバイバーシップにおける骨の健康。 J Clin Oncol. (2012) 30:3665-74. doi: 10.1200/JCO.2012.42.2097
PubMed Abstract | CrossRef Full Text | Google Scholar
10.骨格の健康:成人がんサバイバーシップにおける骨の健康。 Coleman R, Body JJ, Aapro M, Hadji P, Herrstedt J, ESMO Guidelines Working Group. 癌患者における骨の健康。 ESMO臨床実践ガイドライン。 Ann Oncol. (2014) 25:124-37. doi: 10.1093/annonc/mdu103
PubMed Abstract | CrossRef Full Text | Google Scholar
11.骨粗鬆症の治療について. Pfeilschifter J, Diel IJ. がん治療による骨粗鬆症:病態と管理。 J Clin Oncol. (2000) 18:1570-93. doi: 10.1200/JCO.2000.18.7.1570
PubMed Abstract | CrossRef Full Text | Google Scholar
12.骨粗鬆症は癌治療によるものである。 Hadji P, Gnant M, Body JJ, Bundred NJ, Brufsky A, Coleman RE, et al. 閉経前女性におけるがん治療誘発性骨量減少:治療介入の必要性はあるか? Cancer Treat Rev. (2012) 38:798-806. doi: 10.1016/j.ctrv.2012.02.008
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Skolarus TA, Caram MV, Shahinian VB. アンドロゲン遮断に関連した骨疾患。 Curr Opin Urol. (2014) 24:601-7. doi: 10.1097/MOU.000000000101
PubMed Abstract | CrossRef Full Text | Google Scholar
14.骨粗鬆症(骨粗鬆症の治療法)。 Boehling NS, Grosshans DR, Allen PK, McAleer MF, Burton AW, Azeem S, et al. 脊髄転移に対する定位体放射線治療後の椎体圧迫骨折のリスク. J Neurosurg Spine. (2012) 16:379-86. doi: 10.3171/2011.11.SPINE116
PubMed Abstract | CrossRef Full Text | Google Scholar
15.脊椎転移に対する定位放射線治療後の椎体圧迫骨折リスク。 Cunha MV, Al-Omair A, Atenafu EG, Masucci GL, Letourneau D, Korol R, et al. 脊椎定位体放射線治療(SBRT)後の椎体圧迫骨折(VCF):予測要因の分析。 Int J Radiat Oncol Biol Phys. (2012) 84:343-9. doi: 10.1016/j.ijrobp.2012.04.034
PubMed Abstract | CrossRef Full Text | Google Scholar
16.脊椎定位放射線治療後の椎体圧迫骨折(VCF)について Jawad MS, Fahim DK, Gerszten PC, Flickinger JC, Sahgal A, Grills IS, et al. 定位体放射線治療後の椎体圧迫骨折:大規模、多施設、多国籍の評価。 J Neurosurg Spine. (2016) 24:928-36. doi: 10.3171/2015.10.SPINE141261
PubMed Abstract | CrossRef Full Text | Google Scholar
17.邦訳:『定位放射線治療後の椎体圧迫骨折』邦訳:『定位放射線治療後の椎体圧迫骨折』邦訳:『定位放射線治療後の椎体圧迫骨折』。 Marshall D, Johnell O, Wedel H. Meta-analysis of how well measures of bone mineral density predict of occurrence of osteoporotic fractures.骨密度測定による骨粗鬆症性骨折の発生予測に関するメタ分析. BMJ。 (1996) 312:1254-9. doi: 10.1136/bmj.312.7041.1254
PubMed Abstract | CrossRef Full Text | Google Scholar
18.骨密度測定は骨粗鬆症性骨折の発生をどの程度予測するかのメタ分析。 Kanis JA, McCloskey EV, Johansson H, Oden A, Melton LJ 3rd, Khaltaev N. A reference standard for the description of osteoporosis.骨粗鬆症の記述のための基準。 Bone. (2008) 42:467-75. doi: 10.1016/j.bone.2007.11.001
PubMed Abstract | CrossRef Full Text | Google Scholar
19.骨粗鬆症の記述の参照基準. Schreiber JJ, Anderson PA, Rosas HG, Buchholz AL, Au AG. 骨密度および強度を評価するためのハウンズフィールド単位:骨粗鬆症管理のためのツール。 J Bone Joint Surg Am. (2011) 93:1057-63. doi: 10.2106/JBJS.J.00160
PubMed Abstract | CrossRef Full Text | Google Scholar
20.骨密度と強度の評価におけるハウンズフィールドユニット:骨粗しょう症管理のためのツール。 Schreiber JJ, Anderson PA, Hsu WK. 骨密度評価のためのコンピュータ断層撮影の使用。 Neurosurg Focus. (2014) 37:E4. doi: 10.3171/2014.5.FOCUS1483
PubMed Abstract | CrossRef Full Text | Google Scholar
21.骨密度を評価するためのコンピュータ断層撮影の使用. Batawil N, Sabiq S. Hounsfield unit for the diagnosis of bone mineral density disease: a proof of concept study(骨密度疾患診断のためのハウンズフィールドユニット:概念実証研究). Radiography. (2016) 22:93-8. doi: 10.1016/j.radi.2015.11.004
CrossRef Full Text | Google Scholar
22.バタウィルN.サビクS. Pickhardt PJ, Pooler BD, Lauder T, del Rio AM, Bruce RJ, Binkley N. Opportunistic screening for osteoporosis using abdominal computed tomography scans obtained for other indications(他の適応症で得られた腹部CTスキャンを用いた骨粗鬆症の機会的スクリーニング). Ann Intern Med. (2013) 158:588-95. doi: 10.7326/0003-4819-158-8-201304160-00003
PubMed Abstract | CrossRef Full Text | Google Scholar
23.骨粗鬆症のスクリーニング。 Lenchik L, Shi R, Register TC, Beck SR, Langefeld CD, et al. Cardiac gated quantitative computed tomographyを用いた胸椎における海綿骨密度の測定。 J Comput Assist Tomogr. (2004) 28:134-9. doi: 10.1097/00004728-200401000-00023
PubMed Abstract | CrossRef Full Text | Google Scholar
24. CTCAE(Common Terminology Criteria for Adverse Events)。 バージョン5.0。 米国保健社会福祉省、国立衛生研究所国立がん研究所。 メリーランド州(2017).
25. Overgaard J, Bartelink H. Late effects Consensus Conference(晩期障害コンセンサス会議): RTOG/EORTC. Radiother Oncol. (1995) 35:1-82. doi: 10.1016/0167-8140(95)01548-U
CrossRef Full Text | Google Scholar
26.後遺症のコンセンサス会議:RTOG/EORTC. Bentzen SM, Constine LS, Deasy JO, Eisbruch A, Jackson A, Marks LB. 臨床における正常組織効果の定量的解析(QUANTEC):科学的問題点への導入。 Int J Radiat Oncol Biol. Phys. (2010) 76(3 Suppl):S3-S9. doi: 10.1016/j.ijrobp.2009.09.040
CrossRef Full Text | Google Scholar
27.放射線治療における正常組織効果の定量的解析(QUANTEC)の導入。 Buckens CF, Dijkhuis G, de Keizer B, Verhaar HJ, de Jong PA. ルーチンのコンピュータ断層撮影における骨粗鬆症のopportunisticスクリーニング? 外部検証研究。 Eur Radiol. (2015) 25:2074-9. doi: 10.1007/s00330-014-3584-0
PubMed Abstract | CrossRef Full Text | Google Scholar
28.骨粗鬆症のスクリーニングは、骨粗鬆症の予防に有効か? 胸椎と腰椎の急性骨折後の骨粗鬆症を評価するためのコンピュータ断層撮影による減衰の使用。 Geriatr Orthop Surg Rehabil. (2014) 5:50-5. doi: 10.1177/2151458514525042
PubMed Abstract | CrossRef Full Text | Google Scholar
29.骨粗鬆症の評価にはコンピュータ断層撮影が有効です。 Alacreu E, Moratal D, Arana E. Opportunistic screening for osteoporosis by routine CT in Southern Europe(南ヨーロッパにおけるルーチンCTによる骨粗鬆症の機会的スクリーニング). Osteoporos Int. (2017) 28:983-90. doi: 10.1007/s00198-016-3804-3
PubMed Abstract | CrossRef Full Text | Google Scholar
30.骨粗鬆症のスクリーニング。 Lee S, Chung CK, Oh SH, Park SB. 腰椎における二重エネルギーX線吸収法で測定した骨密度と診断用CTで測定したハウンスフィールド単位との相関性。 Korean Neurosurg Soc. (2013) 54:384-9. doi: 10.3340/jkns.2013.54.5.384
PubMed Abstract | CrossRef Full Text | Google Scholar
31.骨密度測定と診断用CTで測定したハウンズフィールド単位の相関性(Korean Neurosurg Soc. (2013) 54:5.384-9. 宮原由紀子、ホームズD、キャンプJ、ミラーVM、カーンズAE. 更年期女性におけるCTとDEXAによる骨密度の較正と非較正の比較。 Climacteric. (2012) 15:374-81. doi: 10.3109/13697137.2011.618566
PubMed Abstract | CrossRef Full Text | Google Scholar
32.骨密度を測定するために、CTとDEXAの比較。 Park SH, Kim JC, Lee JE, Park IK. PET/CT時代の子宮頸がん患者における放射線治療後の骨盤不全骨折。 Radiat Oncol J. (2011) 29:269-76. doi: 10.3857/roj.2011.29.4.269
PubMed Abstract | CrossRef Full Text | Google Scholar
33.放射線治療後の骨盤内不全骨折。 Wei RL, Jung BC, Manzano W, Sehgal V, Klempner SJ, Lee SP, et al. 腹部癌に対する放射線照射後の胸椎および腰椎の骨密度低下。 Radiother Oncol. (2016) 118:430-6. doi: 10.1016/j.radonc.2016.03.002
PubMed Abstract | CrossRef Full Text | Google Scholar
.
Leave a Reply