「F」は「O」よりも電気陰性度が高いのに、なぜ「HF」は水よりも沸点が低いのですか?
いろいろと複雑な要因があります。 これは私が見つけたものです。
- 水はよりバランスのとれた水素結合ネットワーク(1 つの受容体と 3 つの受容体ではなく、2 つの受容体と 2 つの供与体)を作ることができ、バルク システムをより均一に相互作用させ、全体として強くすることができます。
水素結合は、#”HF “# と #”H”_2 “O “# の両方において最も強い分子間力です。 相互作用の強さは相互作用距離、相互作用角度、ネットワークの伸張性に依存します。
すべての水素結合相互作用を引き出し、純粋な水と純粋な#”HF “#を仮定すると、(無限行列から分子のセットを分離して)#””^()##””^()#:
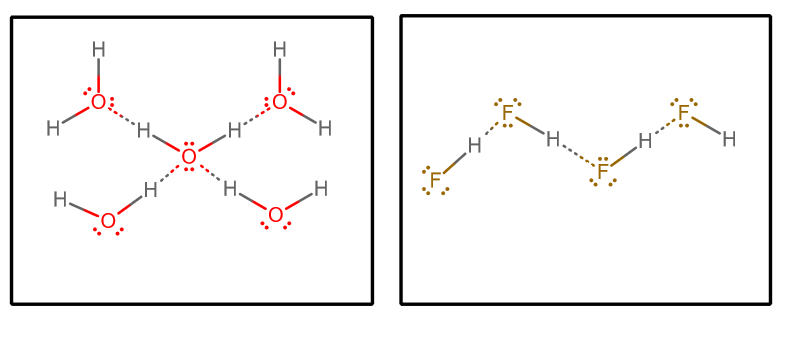
次にいくつかの要素を検討することができます。
- 水素結合供与体および受容体の数
各水分子は(ローンペアを介して)2つの水素結合相互作用を受け入れ、(水素を介して)2つの水素結合相互作用を提供することができます。
一方、各 #”HF “# 分子は 3 つの水素結合相互作用を受け入れ (孤立対を介して)、1 つだけ (水素を介して) 提供します。
したがって、水はよりバランスのとれた水素結合ネットワークを持ち、全体として気化能力が低くなっていると主張することもできます。
- #bb(“F”)# と #bb(“O”)# の電気陰性度
#”F” #はより電気陰性なので、より簡単に電子密度を保持することができ、したがってローンペアは #”O “# 上のローンペアより弱い水素結合相互作用ドナーであると期待されています。
このことから、個々の水素結合相互作用は弱く、水の沸点が#”HF “#より高いことが予想されますが、これは次の点で矛盾します。
- #bb(“HF”)# vs. #水の平均水素結合強度。 water
#”O”-“H “cdotcdot: “O”-#, #DeltaH_(“H”-“bond”) ~~”21 kJ/mol “#
#”F”-“H “cdotcdot: “F”-#, #DeltaH_(“H”-“bond”) ~~”161.1 kJ/mol “である。5 kJ/mol “#
このWikipediaのデータから、#”HF “#は水中よりも分子間で強い水素結合相互作用があることがわかります。
これは #”HF “# がずっと低い沸点を持っているという実験的な証明をサポートしませんが、これも単なる生の数字であり、例えばバルク系での相互作用角度を考慮していません。
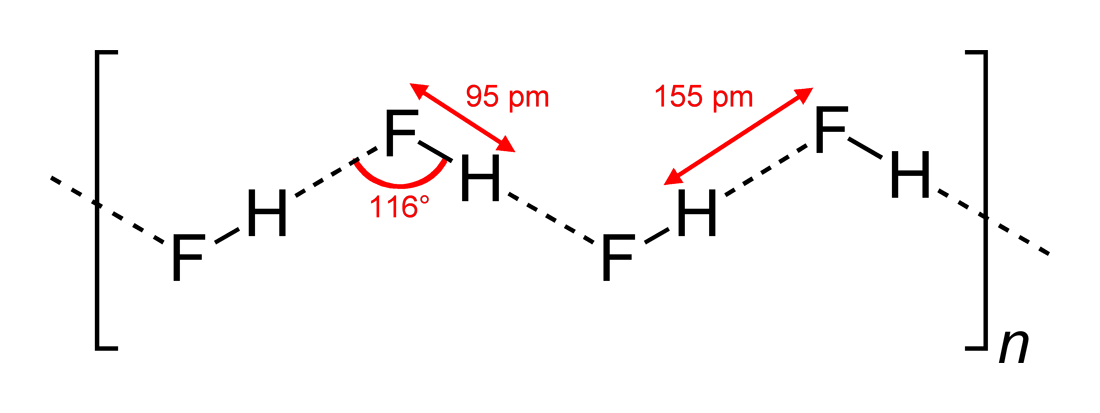
- Observed hydrogen-bonding angles and dimensions of interaction
#”HF “# は線形分子で、2次元で#116^@#の角度でジグザグの水素結合相互作用を持っていると見られてきた。 より最適な角度は#180^@#であり、その方がより直接的な双極子相互作用が得られるからです。
水は四面体の電子配置を持つ曲がった分子で、3次元で水素結合することができます。
以下は、水の水素結合相互作用の局所環境で見られる四面体クラスターの例です:
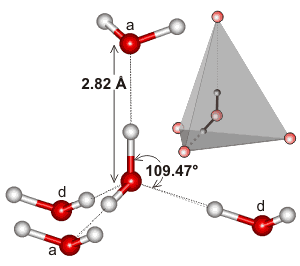 水素結合ネットワークの拡張性、およびそれが水の電子形状と一致する傾向があることが、水の沸点を高くしているのでしょう。
水素結合ネットワークの拡張性、およびそれが水の電子形状と一致する傾向があることが、水の沸点を高くしているのでしょう。 全体的に、これらは私が思いついた最も難易度の低い要因です:
- 水はよりバランスのとれた水素結合ネットワーク(1 つのドナーと 3 つのアクセプタではなく、2 つのアクセプタと 2 つのドナー)を作ることができ、バルクシステムをより均一に相互作用させるので全体として強くすることができます。
- 水はより広範な水素結合ネットワーク(2次元ジグザグ環境ではなく、3次元四面体の局所環境)を形成し、バルク系をより蒸発しにくいものにする。
- 水は一般により最適な相互作用角度を持ち、分子の電子形状により近く、分子双極子に沿って相互作用を配置するのに対し、#”HF “# は相互作用が線形であれば、(生の数値で)より強い水素結合を持つことになります。
Leave a Reply