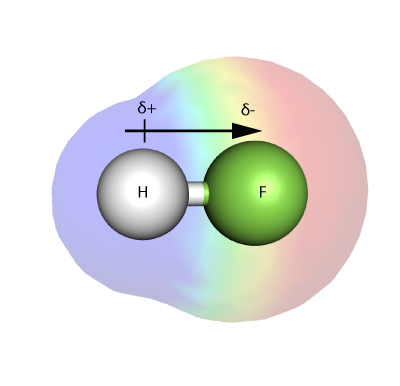
電気陰性度とは何ですか?
電気陰性度
電気陰性度とは、分子中の原子が、結合中の電子をどれだけ強く自分に引き寄せることができるかを示す尺度である。
電気陰性度に影響を与える要因:
1) 原子番号
原子番号とは、原子の核にある陽子の数のことです。
2)原子半径
化学元素の原子半径は通常、原子核の中心から電子の最外層の境界までの距離で測定されます。
酸素原子の原子半径の例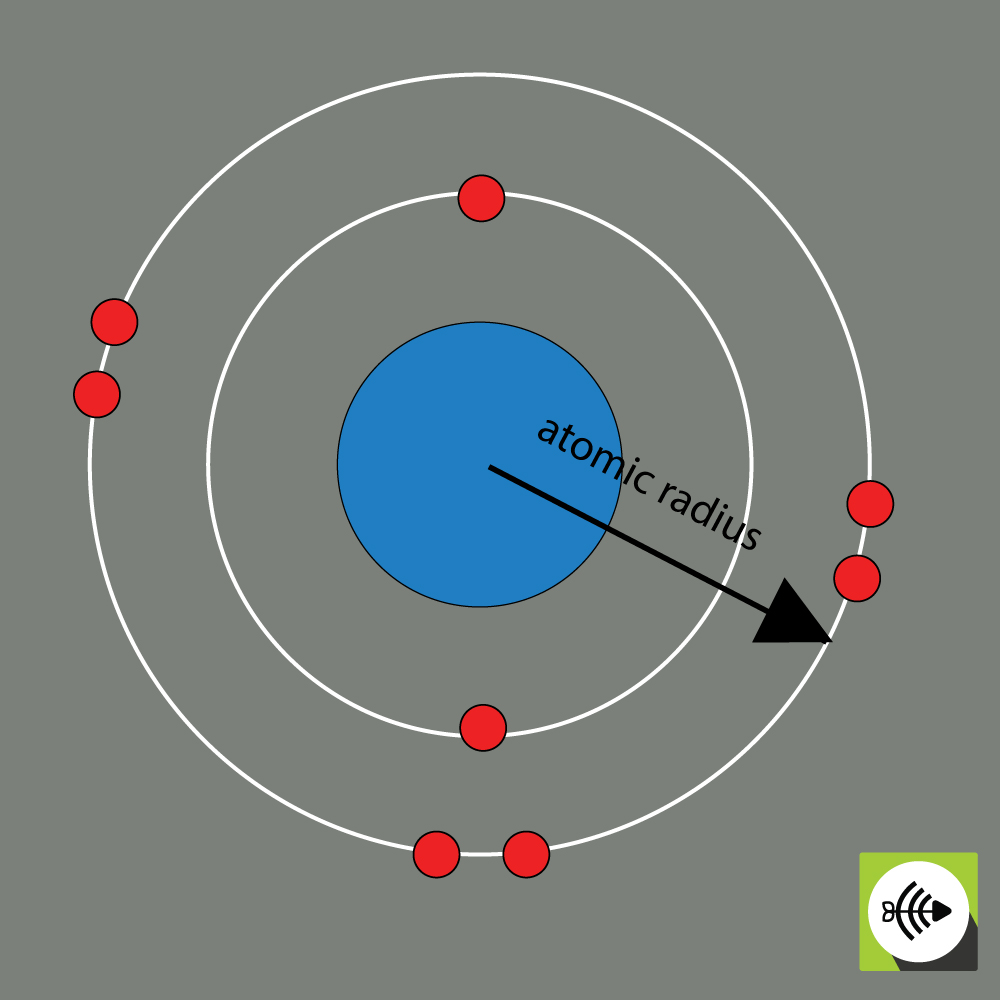
電気陰性度は何で測るのか
電気陰性度の測定で最もよく用いられるのはポーリングスケールで、ノーベル賞を2度受賞したライナスポーリングが考案したものです。 元素の電気陰性度の尺度は、各元素が(互いに)どの程度強く結合電子を引きつけることができるかを示すものです。 
なぜ酸素は窒素よりも電気陰性度が高いのでしょうか?
酸素は原子番号が高い
- 酸素には原子核に 8 つの陽子がありますが、窒素はたったの 7 つしかないのです。
- 結合電子のペアは、酸素の原子核からの方が窒素よりも強く引かれるので、酸素の電気陰性度が大きくなります。
なぜ酸素が硫黄より電気陰性度が高いのか。
- 酸素のエネルギー準位は2つ、硫黄は3つ
- 硫黄の結合電子は原子核から離れている
- 結合電子が原子核から離れている場合。 7791>酸素の結合電子は、硫黄の結合電子よりも原子核からの引力が強くなります
- したがって、酸素はより電気陰性な原子です
先に進む前に、価電子について読んでおいてください。 価電子

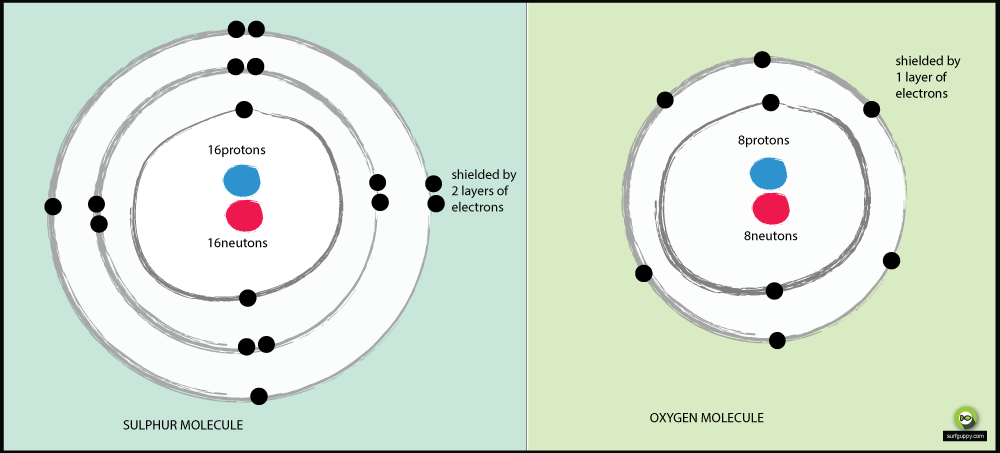
小さい原子ほど電気陰性度が高い
周期表に存在する電気陰性度の傾向
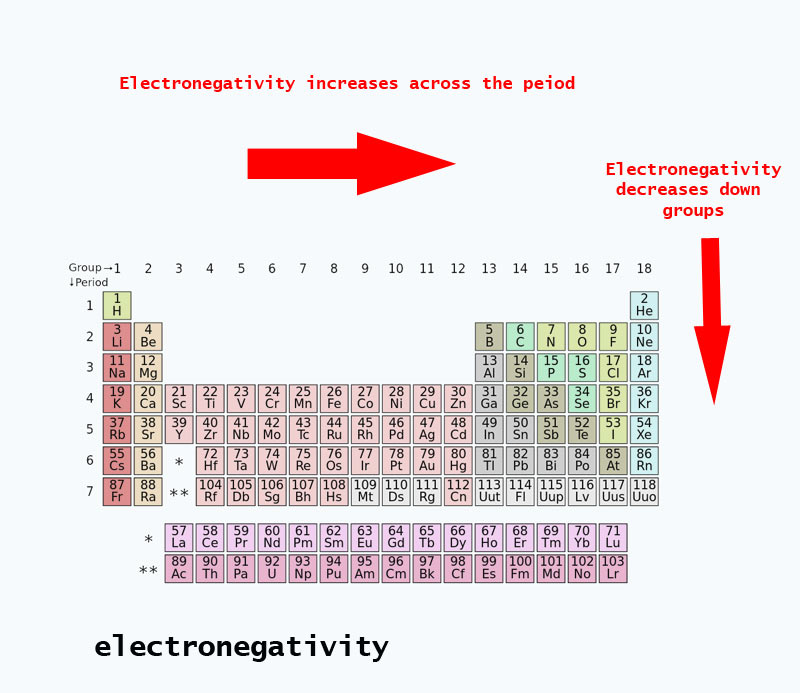
周期表を移動すると、原子核内の陽子の数が増えるので(エネルギーレベルは増加せず)電気陰性度が高くなる。
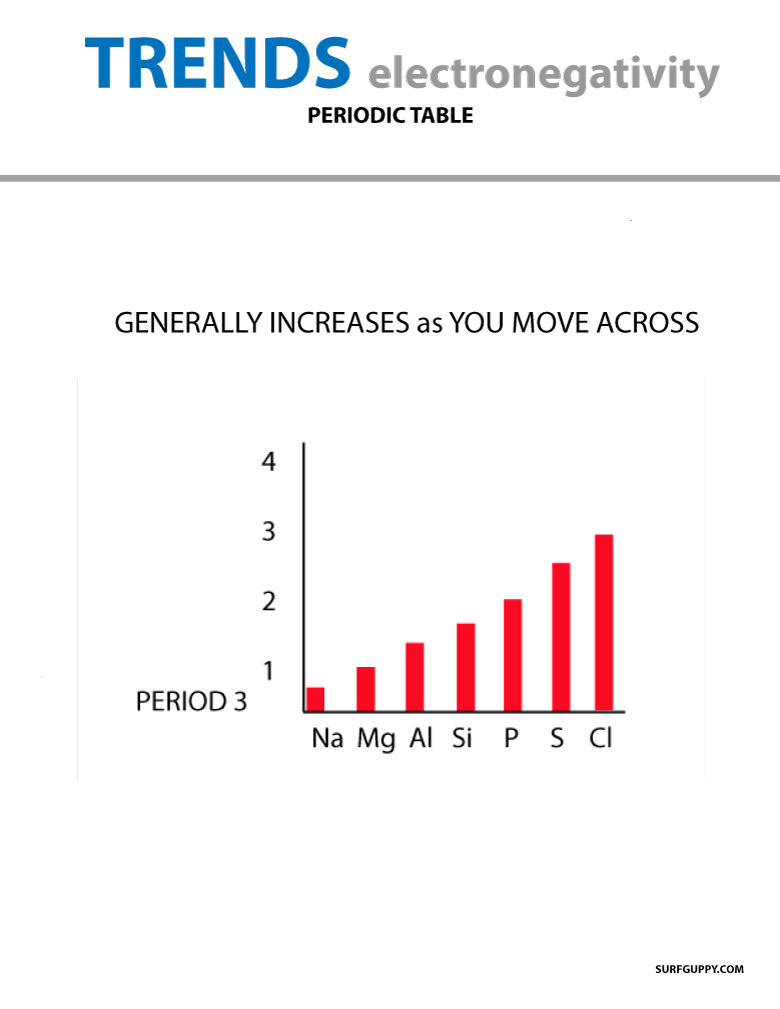
ELECTRONEGATIVITY GENERALY INCREASES ACROSS THE PERIODIC TABLE 原子番号がグループダウンするとエネルギーレベルも増加する。 原子半径は大きくなり、電気陰性度は減少する。
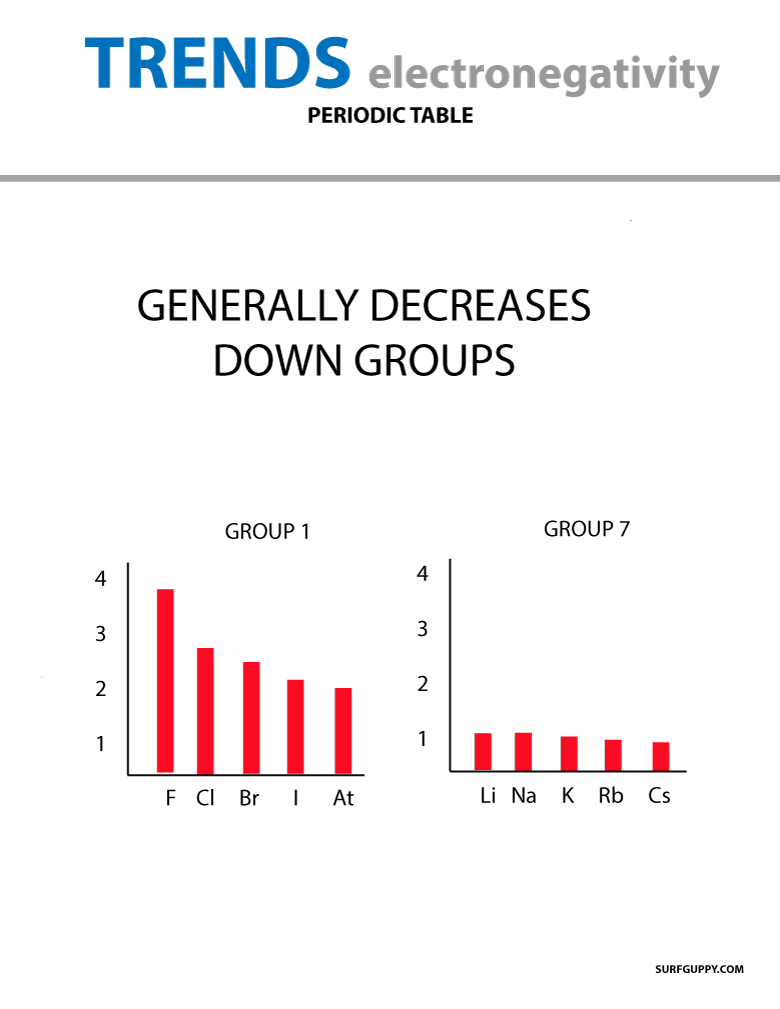
ELECTRONEGATIVITY GENERALY DECREASE DOWN GROUPS IN APERIODIC TABLE PERIODIC TABLE OF ELECTRONEGATIVITY
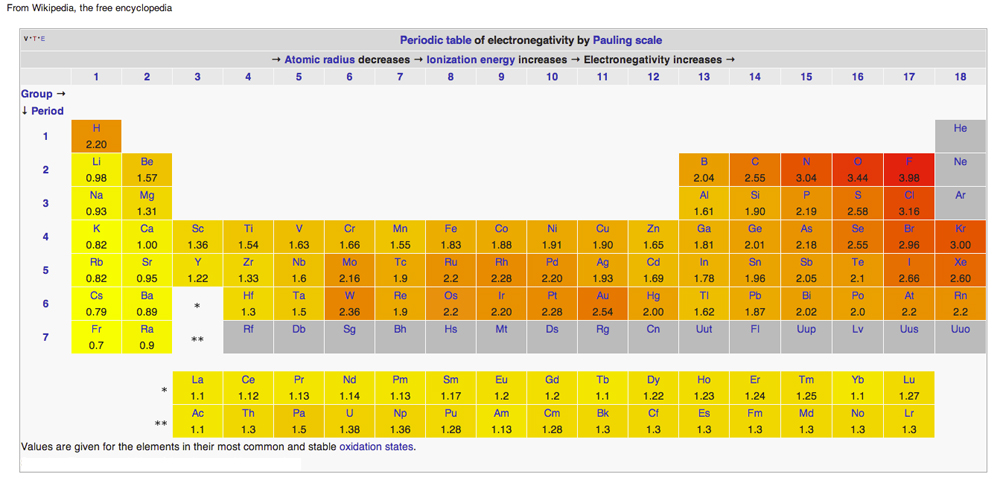 Diagram from Wikipedia issued under Creative Common Licenses
Diagram from Wikipedia issued under Creative Common Licenses
Leave a Reply