未分画ヘパリンの薬理学
本剤はICUでの抗凝固療法の定番であり、その特性をよく理解しておくことが望ましい。
化学的性質と分子構造
ヘパリンはムコ多糖類の異種混合物で、グリコサミノグリカンと呼ばれています。
それは本質的に重合した二糖類、デンプンで、
それぞれの繰り返し二糖類はさまざまな硫酸化をされています。
2糖ポリマーがさまざまな長さであるため、ヘパリンの平均分子量は3~30kDaである。
そのポリマーの長さは実にランダムです。
ヘパリンの「単位」とは一体何なのでしょうか。
ヘパリン1単位は、1mlの猫の血液を0℃で24時間液状にしておくために必要な量です。 この異常に動物に不親切な定義は、あるWH Howellが猫の血液を冷蔵庫に一晩入れておいたことに由来します。 血液は固まらなかったが、半分固まっただけで、液体のままであった。
Chemical Relatives
分画ヘパリン(例:エノキサパリン)のことでしょうかね。
機能的な親類は、他の間接的なトロンビン阻害剤で、フォンダパリヌクスがあります
投与と吸収
通常静脈内または皮下投与(そこから徐々に解離)です。
-
- 皮下投与の場合、効果のピークに達するまでに1~2時間かかります。
その後、分布量は40~70ml/kgで、基本的に血管内容量に限定されることになります。
胎盤を通過しないので、特に妊娠中に有用です。
飲んだらどうなる?
経口ヘパリンはバイオアベイラビリティが非常に悪いです。 分子が大きすぎ、電荷がマイナスなので、吸収されにくいのです。 このため、ほとんど循環体積の中だけに分布しています。 勇敢な男たちは、ヘパリンを使って料理をし、経口での生物学的利用能を高めることを試みました。 さらに、45人の勇者が2万単位のヘパリンを飲み、APTTを検査したところ、平均で2.3秒増加したことが判明しました。これは大したことではありませんが、ある程度の吸収があることを証明しています。 2141>
代謝とクリアランス
2つのメカニズムがあります:急速な飽和クリアランスと遅い一次クリアランスです。
半減期は用量によって異なります。
25単位/Kgの半減期=30分
100単位/Kgの半減期=60分
400単位/Kgの半減期=150分
低用量になると。 半減期は非常に短くなります(輸液したヘパリンのほとんどがマクロファージや内皮細胞に直接結合し、そこで分解されるため)。
Rapid Saturable Zero-Order Clearance:
- ヘパリン結合タンパク質、マクロファージおよび内皮細胞への結合に起因するものです。
- こうして結合したヘパリンは使い物にならなくなり、やがて解重合されます。
Slow First-Order Clearance:
- Renal excretion… かもしれませんね? 正直なところ、腎臓ではないでしょう。 大量投与後、尿中に少量排泄されます。
- 現在、MIMSでは「ヘパリンの代謝運命はよくわかっていない」と認めつつ、網状内皮系がヘパリンの隔離と破壊に関与している可能性に言及しています。
作用機序
ヘパリンは体内ではマスト細胞の分泌顆粒に存在する。 また、ヒトの凝固カスケードとは似ても似つかない様々な無脊椎動物を含む多数の動物に存在します。
ヘパリンはアンチトロンビンIIIの活性を1000倍に高めます。
アンチトロンビンIIIに結合して、活性部位に構造変化を起こさせることによってこれを行います。
私の子供じみた図では、アンチトロンビンIIIの分子尾部がちらつくのは、活性部位が増えたことを表しています。
こうして活性化したアンチトロンビンIIIはいくつかの因子-特にXaとIIa(トロンビン)-を不活性化するのですが、ここで大事な点に行き当たります。
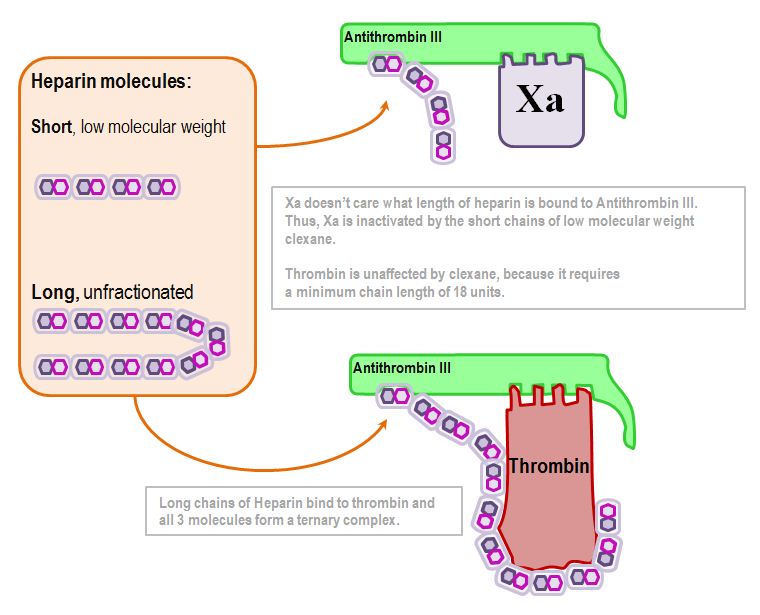
トロンビンの不活性化はヘパリン分子の長さに依存する:
18個の2糖単位が重要な数字である(約5kDa)
Xaの不活性化は長さに依存しない:どんな種類のヘパリンでも、それに結合する限りアンチトロンビン-ⅢがXaを不活性化させるのだ。
このことが、低分子ヘパリンと未分画ヘパリンの薬物動態の違いの根底にあるのです。
したがって、要約すると、未分画ヘパリンはトロンビンに影響し、低分子量ヘパリンはXaのみに影響するのである。
これはまた、APTTを測定しても、クレキサン投与が治療的かどうかがわからない理由にもなります。
未分画ヘパリンは第9因子活性にも作用しますが、第7因子活性には作用しないのです。 したがって、内在性経路と共通経路が影響を受け、APTTが増加する。 外因性経路は影響を受けず、PTはあまり上昇しない。 トロンビンは低分子ヘパリンに影響されないので、APTTは基本的に変化しません。
使用上の注意
- さて、その抗凝固ですが、これはもっと大きな話題になります。 APTTモニタリングは重要な問題です。
- 要するに、ヘパリンはDVT予防、血栓症や血栓塞栓症の治療、急性冠症候群、緩流透析回路の維持に用いられます。
- 妊娠中のDVTに対する薬理療法は、これまで未分画ヘパリンに依存していました。 未分画とLMWHを比較したPROTECT試験では、DVTの発生率に大きな差は見られませんでしたが(それでも約5.6%)、LMWH群ではPEが少なく、HITSも少ない傾向がありました。
禁忌
- 出血したら、ヘパリンを考えなおさなければならない。 このように、実用的な観点から禁忌を大まかにまとめています。 侵襲的処置の危険が迫っていることが主な禁忌です。
- 唯一の絶対的禁忌は、過去にHITまたはHITTの病歴があることです。
相互作用
他の抗凝固薬で抗凝固している人の出血リスクを高めるという馬鹿みたいに明白な傾向を除けば、ヘパリンには本物の薬理学的相互作用はほとんどありません。
| Effects of heparin are potentiated by | Effects of heparin are antagonised by |
| Hydroxycholoroquine | Antihistamine |
| Probenecid | ジゴキシン |
| バルプロ酸ナトリウム | テトラサイクリン |
| ニコチン |
慢性合併症
Heparin->
-
- Immune-mediated thrombocytopenia well discussed by Franchini in 2005
-
- 未分画ヘパリンでより頻繁に関連する
- 高齢者で頻繁に見られる。 小児では前例がない
- 心臓外科や整形外科の患者はリスクが高い
- 一般的にヘパリン開始後5-10日で発症
-
- Immune-mediated thrombocytopenia well discussed by Franchini in 2005
-
- 2種類のフレーバーがある。 タイプ1、タイプ2の2種類があります。
HITS Type1。
- 軽度の一過性血小板減少症。 血小板数100以上
- ヘパリン中止で完全に回復
- 特許の10%までで発生
- 血栓症のリスク増加とは無関係
- おそらく免疫起源でもない
HITSタイプ2.A.B.C.A.B.B.B.B.B.B.B.B.B.B.B.B.B.B.B:
- ひどい血小板減少症で、血小板数はゼロになるかもしれません
- 特許の1%程度で発生します
- 30%で血栓症を伴います
- この複合体は血小板第4因子(PF4)とヘパリンからなる複合体で、血小板表面に形成されているので抗体ができるのでしょう。
- HIT抗体がこの複合体に結合すると、血小板の活性化および凝集が起こり、凝固傾向(すべての血小板が活性化するため)と同時に出血傾向(網膜内皮系で抗体が結合した血小板を破壊するため)
HIT 患者が発症しても抗凝固療法は行う必要があります。
直接トロンビン阻害薬が選択される治療法です。
ヘパリン慢性使用によるその他の影響
- 骨減少症
- ヘパリンは何らかの原因で破骨細胞を活性化し、骨吸収が亢進する。
- Mineralocorticoid deficiency
- Heparin seems to antagonize the effects of ACTH
- Weird side effects
- Alopecia- who knows how.
- ASTとALTの上昇-原因は不明
急性毒性と過量投与
- 主な急性有害事象は出血である。
急性毒性の管理
ヘパリンを過剰に投与した場合、APTTは劇的に上昇し、ある種の出血性合併症が起こる可能性があります。 凝固カスケードを元に戻せたらいいのに」と思うかもしれません。 これはプロタミンで実現できます。
硫酸プロタミンによるヘパリーゼの回復
- 1mgで100単位を回復
- 一度に50mgまで
- 点滴でゆっくり投与
プロタミンの危険性
硫酸プロテミンは良性からかけ離れるものである。 強アルカリ性のポリペプチドで、強酸性のヘパリンと不可逆的に結合し、アンチトロンビン-3の抗凝固作用を低下させるという、異質で変わった物質です。 しかし、とんでもない量では、プロタミン自体が抗凝固剤として作用することになる。
その多くの副作用の中には、次のようなものがある。
- 血管拡張による破局的低血圧(ありがたいことに短時間(約3-4分))-これは、循環ヘパリン-プロタミン複合体によるある種の直接補完活性化方法で引き起こされる、全身性ヒスタミン放出の結果と思われる
- トロンボキサンの局所血管収縮活性による肺高血圧症。 プロタミンに対するアナフィラキシー反応
- アナフィラキシー(魚類)
ヘパリン療法への抵抗
せっかく大量のヘパリンを静脈注射してもAPTTが上昇しない状況があります。
ヘパリンに抵抗性を示す理由はいくつかあります:
- ヘパリン結合蛋白レベルの上昇(いずれも急性期反応)
- アンチトロンビン-IIIレベルの低下(すなわち…)
- ヘパリン結合蛋白レベルの上昇(いずれも急性期反応)
- ヘパリンクリアランスの増加(肝臓疾患など)
- 第VIII因子濃度の上昇
アンチトロンビン-IIIレベルの低下(いずれも急性期反応)
UpToDate にアンチトロンビンIII欠損症に関する良い論文が掲載されています。 遺伝的に十分な量を合成できないか、肝臓が損傷して十分な量を生産できないかのどちらかです。 あるいは、DICやMAHA、バイパス回路などで、何らかの形で使い果たされた場合です。
AT-III欠乏症の治療は、予想通り、AT-IIIの補充です。
高価な精製因子が入手できない場合は、FFPで十分です。
ヘパリン抵抗性の患者の有効な凝固
採用できる戦略は複数存在します。 具体的な選択は、何がヘパリン抵抗性の原因になっているかによります。 一般的には、治療目標が達成されるまで、投与量を増やし続けることが想定されていると思います。 しかし、抗凝固療法が決定的に重要な状況もあり、そのようなシナリオの1つが心肺バイパス回路です。
-未分画ヘパリンの代わりに低分子ヘパリンに変更する
-クリオプレシピテートおよび/または新鮮凍結血漿を投与する(ATIII欠損が確認された場合)
-アンチトロンビンIII濃縮液を投与あるいは直接トロンビン阻害剤(ヒルジンまたはアルゴバトラン)など他のものを使うことも検討できます br>
-アンチトロンビン阻害剤(ヒュルスリンまたはアルゴバトラン)
-アンチトロンビン阻害剤(ヒュルスリン)




Leave a Reply