Zanzare autodistruttive e roditori sterilizzati: la promessa dei gene drive
Austin Burt e Andrea Crisanti hanno cercato per otto anni di dirottare il genoma della zanzara. Volevano bypassare la selezione naturale e inserire un gene che si sarebbe diffuso nella popolazione più velocemente di una mutazione trasmessa dal solito processo di ereditarietà. In fondo alla loro mente c’era un modo per prevenire la malaria diffondendo un gene per mettere fuori gioco le popolazioni di zanzare in modo che non possano trasmettere la malattia.
Crisanti ricorda di aver fallito più e più volte. Ma finalmente, nel 2011, i due genetisti dell’Imperial College di Londra ottennero i risultati sul DNA che avevano sperato: un gene che avevano inserito nel genoma della zanzara si era irradiato attraverso la popolazione, raggiungendo più dell’85% dei discendenti degli insetti1.
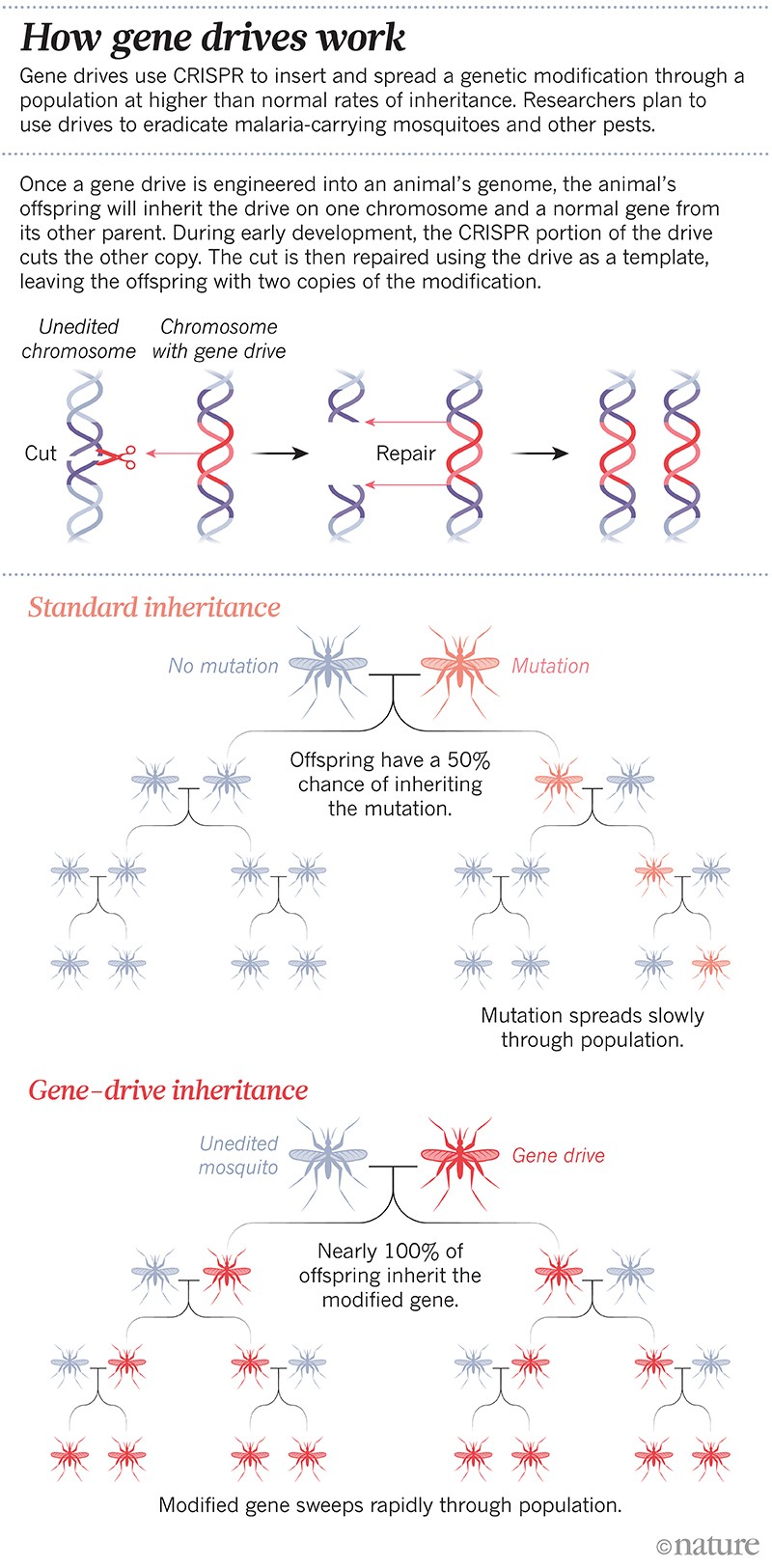
Era il primo ‘gene drive’ ingegnerizzato: una modifica genetica progettata per diffondersi attraverso una popolazione a tassi di eredità più alti del normale. Le unità genetiche sono diventate rapidamente una tecnologia di routine in alcuni laboratori; gli scienziati possono ora montare un’unità in mesi. La tecnica si basa sullo strumento di editing genico CRISPR e alcuni pezzi di RNA per alterare o silenziare un gene specifico, o inserirne uno nuovo. Nella generazione successiva, l’intera unità si copia sul suo cromosoma partner in modo che il genoma non abbia più la versione naturale del gene scelto, e abbia invece due copie dell’unità genica. In questo modo, il cambiamento viene trasmesso fino al 100% della prole, invece di circa il 50% (vedi ‘Come funzionano i drive genici’).
Dal 2014, gli scienziati hanno ingegnerizzato sistemi di gene drive basati su CRISPR in zanzare, moscerini della frutta e funghi, e attualmente li stanno sviluppando nei topi. Ma questo è solo l’inizio della storia. Le domande sulla possibilità di un gene drive sono state soppiantate da altre incognite: quanto bene funzioneranno, come testarli e chi dovrebbe regolare la tecnologia. Le unità genetiche sono state proposte come un modo per ridurre o eliminare le malattie trasmesse dagli insetti, controllare le specie invasive e persino invertire la resistenza agli insetticidi nei parassiti. Nessun gene drive ingegnerizzato è stato ancora rilasciato in natura, ma la tecnologia potrebbe in linea di principio essere pronta già tra tre anni, dice Crisanti. Egli collabora con Target Malaria, un consorzio di ricerca internazionale senza scopo di lucro che cerca di utilizzare le zanzare a trazione genetica per il controllo della malaria in Africa. Il 1° luglio, il gruppo ha rilasciato un lotto di prova di zanzare – geneticamente modificate ma non ancora dotate di gene drive – in un villaggio del Burkina Faso.
I gene drive sono diversi da qualsiasi soluzione ecologica mai testata prima, dice Fredros Okumu, direttore scientifico dell’Ifakara Health Institute di Dar es Salaam, Tanzania. “Le unità genetiche si diffonderanno da sole”, dice. “Dobbiamo preparare la gente e condividere le informazioni apertamente con tutti i paesi interessati.”
Le sfide tecniche non sono così scoraggianti come quelle sociali e diplomatiche, dice il bioingegnere Kevin Esvelt del Massachusetts Institute of Technology (MIT) Media Lab di Cambridge, che è stato tra i primi a costruire un gene drive basato su CRISPR. “Tecnologie come questa hanno conseguenze nel mondo reale per la vita delle persone che possono essere quasi immediate.”
Viste le potenziali preoccupazioni sulle unità genetiche, Nature esplora cinque domande chiave sulla tecnologia e le sue applicazioni.
Funzioneranno le unità genetiche?
Costruire un gene drive per manipolare o sradicare una popolazione è come scegliere una battaglia con la selezione naturale, e quella battaglia potrebbe non essere facile da vincere.
Appena i ricercatori hanno iniziato a produrre regolarmente gene drive in laboratorio, gli animali hanno sviluppato resistenza contro di loro – accumulando mutazioni che hanno impedito ai drive di diffondersi. Nei test di due drive inseriti nei moscerini della frutta, per esempio, le varianti genetiche che conferiscono resistenza si sono formate frequentemente2. Più comunemente, le mutazioni alterano una sequenza che CRISPR è impostato per riconoscere, impedendo al gene di essere modificato. In esperimenti con zanzare in gabbia, Crisanti e il ricercatore di Target Malaria Tony Nolan hanno visto un gene drive diminuire gradualmente in frequenza su più generazioni a causa di mutazioni resistenti al gene target3. I risultati hanno scosso il campo. La resistenza renderebbe le unità genetiche impotenti?
Non necessariamente – se i ricercatori selezionano il giusto obiettivo. Alcuni geni sono altamente conservati, il che significa che qualsiasi cambiamento è probabile che uccida i loro proprietari. Scegliere questi geni come obiettivo dell’unità significa meno mutazioni e meno resistenza. Nel settembre 2018, Crisanti e il suo team hanno schiantato una popolazione di zanzare Anopheles gambiae in gabbia con il 100% di efficienza4 facendo un’unità che interrompe un gene della fertilità chiamato doublesex. Con il drive in atto, le zanzare femmine non possono mordere e non depongono uova; entro 8-12 generazioni, le popolazioni in gabbia non producevano affatto uova. E poiché è cruciale per la procreazione, doublesex è resistente alle mutazioni, comprese quelle che conferirebbero resistenza a un costrutto drive.
Il team ha condotto nove esperimenti in gabbia di più di un milione di inserzioni di drive che mirano a doublesex e non ha visto alcuna resistenza, dice Crisanti. Ora il team sta adattando il drive per tagliare non uno ma due loci sul gene doublesex, come trattare una malattia con una combinazione di farmaci. “Voglio assicurarmi che la probabilità di sviluppare resistenza sia molto, molto remota prima di dire che la tecnologia è pronta per il campo”, dice Crisanti.
Nei mammiferi, gli scienziati hanno sfide molto più fondamentali della resistenza da affrontare. L’anno scorso, Kim Cooper e i suoi colleghi dell’Università della California, San Diego (UCSD), ingegnerizzato gli inizi di un gene drive in un mammifero – un disco che interrompe un gene del mouse, Tyr, e trasforma i cappotti degli animali ‘bianco5. L’unità era solo 72% efficiente a copiarsi nel genoma e non ha funzionato bene nella linea germinale maschile, dice Cooper. Sospetta che questo sia dovuto al fatto che la divisione cellulare avviene in tempi diversi nella formazione di uova e sperma, che sembra influenzare la capacità dell’unità di copiare con successo da un cromosoma all’altro.
In quell’esperimento, l’unità non si è auto-propagata e Cooper non ha seguito il tratto su più generazioni, quindi sottolinea che tecnicamente non può essere considerata un’unità genetica. “C’è ancora tanto lavoro da fare per dimostrare che qualcosa di simile è anche fattibile”, aggiunge.
A cos’altro servono le unità geniche?
Anche se le applicazioni per le zanzare dominano il campo, gli usi proposti delle unità geniche includono anche la conservazione di ecosistemi delicati e la velocizzazione del lavoro di laboratorio.
Alcuni organismi hanno genomi che sono difficili da manipolare, ma così facendo potrebbero aiutare i ricercatori a studiarli. Prendiamo la Candida albicans, un patogeno fungino umano spesso resistente ai farmaci. Come ricercatore post-dottorato presso il Broad Institute e il MIT di Cambridge, Massachusetts, Rebecca Shapiro ha sviluppato un sistema6 per guidare le mutazioni nel fungo con quasi il 100% di efficienza. Ora può allevare il fungo per silenziare due geni indipendenti e lasciare in eredità queste mutazioni alla prole. “Funziona in modo follemente efficiente”, dice Shapiro, ora all’Università di Guelph in Canada. Alla UCSD, Cooper sta usando le unità genetiche per uno scopo simile, per creare e studiare tratti complessi nei topi.
Il programma Genetic Biocontrol of Invasive Rodents (GBIRd) vuole fare di più con i topi a guida genica che studiarli in laboratorio. GBIRd, una partnership di università, governi e organizzazioni non governative gestita dal gruppo non-profit Island Conservation, vuole usare la tecnologia per eliminare i roditori invasivi dalle isole, dove portano scompiglio nella fauna nativa. I pesticidi sono attualmente utilizzati per questo scopo, ma sono costosi e difficili da usare su isole più grandi con popolazioni umane. Sono fattibili solo su circa il 15% delle isole, dice Royden Saah, responsabile del programma GBIRd. “
I membri del GBIRd David Threadgill della Texas A&M University di College Station e Paul Thomas dell’Università di Adelaide in Australia stanno sviluppando tecnologie di gene-drive nei topi, anche se Saah stima che ci vorranno diversi anni prima che queste unità funzionino con successo.
Nel frattempo, alcuni ricercatori sulle zanzare sperano di provare qualcosa di più sottile che spazzare via completamente le popolazioni di insetti come mezzo per prevenire le malattie. In un preprint di maggio7, Omar Akbari e i suoi colleghi di UCSD hanno ingegnerizzato le zanzare Aedes aegypti per esprimere un anticorpo che ha protetto gli insetti contro tutti e quattro i principali ceppi di dengue. Ora stanno attaccando quell’anticorpo a un’unità per vedere se si diffonderà. Akbari sta anche costruendo un gene drive universale che attiva una tossina quando qualsiasi virus, non solo la dengue, infetta A. aegypti. “Vogliamo costruire un cavallo di Troia nella zanzara”, dice Akbari. “Quando una zanzara viene infettata da un virus – che sia dengue, Zika, chikungunya, febbre gialla, qualsiasi cosa – attiva il nostro sistema, che uccide la zanzara.”
Può essere controllato il gene drive?
Prima che Kevin Esvelt costruisse un singolo gene drive basato su CRISPR, si svegliava con i sudori freddi pensando alle ramificazioni. “Mi sono reso conto, oh hey, questo non sarà solo per la malaria, questo è potenzialmente qualcosa che ogni individuo che può fare un moscerino della frutta transgenico potrebbe costruire per modificare tutti i moscerini della frutta.”
Non è una sorpresa, quindi, che nel 2014, quando Esvelt e il genetista George Church hanno costruito la loro prima unità genica alla Harvard Medical School di Boston, Massachusetts, hanno contemporaneamente costruito un’unità di inversione per sovrascrivere l’unità originale su comando8.
Il resto del campo ha seguito l’esempio, sviluppando unità geniche con controlli integrati, sovrascritte esterne o entrambi. A finanziare la maggior parte di questo sforzo è la Defense Advanced Research Projects Agency (DARPA), il braccio di ricerca del Dipartimento della Difesa degli Stati Uniti. Nel 2017, il programma Safe Genes della DARPA ha annunciato che stava spendendo 65 milioni di dollari in sette gruppi di ricerca statunitensi che studiano come controllare, contrastare e invertire i drive genici. “Stiamo mitigando il potenziale di uso improprio, sia accidentale che nefasto”, dice Renee Wegrzyn, la responsabile del programma Safe Genes.
Esvelt, finanziato nella fase iniziale del programma, ha ideato un drive auto-esauribile noto come daisy drive. L’unità è progettata per perdere un anello alla volta, come cogliere un fiore da una catena collegata testa a gambo, fino a quando si esaurisce in diverse generazioni9.
Alla UCSD, il team finanziato da DARPA di Akbari sta sviluppando unità genetiche che non dovrebbero essere in grado di diffondersi oltre una popolazione bersaglio di zanzare o mosche. Una di queste unità richiede un rilascio continuo per molte generazioni. Quando questi rilasci si fermano, si diluisce con versioni wild-type del gene e si cancella entro quattro anni. Questo potrebbe essere abbastanza lungo per eliminare un virus come Zika o dengue da una popolazione di zanzare, dice Akbari. “È qualcosa che è, secondo me, un po’ più sicuro e ancora abbastanza efficace”. Il team ha già prodotto diverse versioni di queste unità per A. aegypti, il principale vettore del virus della dengue10.
Il team Target Malaria sta anche sviluppando una contromisura, finanziata da DARPA, per fermare la diffusione dell’unità doublesex in una popolazione.
Come si possono sperimentare le unità genetiche?
Al posto di una prova sul campo – che il contratto DARPA Safe Genes vieta espressamente e per la quale i ricercatori concordano che la tecnologia non è pronta – i team stanno scalando gli esperimenti in gabbia e costruendo modelli ecologici per esplorare i benefici e i rischi di un rilascio selvaggio in sicurezza.
Nella città di Terni in Italia centrale, Crisanti e Nolan hanno arricchito le loro gabbie di zanzare con condizioni ambientali variabili. “Vogliamo aumentare la scala per testarlo su diversi background genetici, in scenari più realistici”, dice Nolan, che ora gestisce un laboratorio alla Liverpool School of Tropical Medicine, Regno Unito. Lui e Crisanti vogliono replicare il comportamento di accoppiamento naturale – come i maschi che formano sciami per attirare le femmine – per vedere come influisce sulla diffusione di un’unità genetica.
La dinamica della diffusione dell’unità in quelle gabbie finora è “promettente”, dice Crisanti – l’unità è passata in modo efficiente senza segni di resistenza. Se non sorgono preoccupazioni negli esperimenti di gabbie più grandi, allora il team consegnerà la tecnologia a gruppi indipendenti per i test, con l’obiettivo di ottenere l’approvazione normativa in circa tre anni, dice.
Il team di Target Malaria sta anche costruendo modelli ecologici di potenziali luoghi di rilascio per elaborare le dinamiche sul campo. Lo studio più recente11 modella le popolazioni di zanzare in più di 40.000 insediamenti in Burkina Faso e nei paesi circostanti. Prende in considerazione fiumi, laghi e precipitazioni, così come i dati di campo sul movimento delle zanzare. I risultati11 mostrano che l’introduzione ripetuta, piuttosto che un singolo rilascio, di zanzare modificate nel corso di alcuni anni attraverso i villaggi sarà necessario per ridurre il numero complessivo degli insetti.
“La teoria dice che, in linea di principio, se si rilascia una volta si diffonderebbe in tutto il continente. La realtà è che accadrebbe molto lentamente”, dice il biologo della popolazione Charles Godfray all’Università di Oxford, Regno Unito, un collaboratore di Target Malaria e il ricercatore principale dello studio.
Un’altra preoccupazione è che i drive genici hanno il potenziale di alterare intere popolazioni e quindi interi ecosistemi. Essi potrebbero anche, in teoria, influenzare negativamente la salute umana causando il parassita della malaria per evolvere per essere più virulento o per essere portato da un altro ospite, dice il biologo molecolare e bioeticista Natalie Kofler. Lei è il direttore fondatore del gruppo Editing Nature alla Yale University di New Haven, Connecticut, che mira ad affrontare le tecnologie genetiche ambientali in tutto il mondo. “Questa tecnologia ha il potenziale per essere immensamente potente e per cambiare il corso delle cose che potremmo non essere in grado di prevedere”, dice Kofler.
Chi decide quando usare un gene drive?
Per le prove sui farmaci, una società può iniziare a preparare un test sul campo solo un anno o due in anticipo. Le unità genetiche avranno bisogno di più tempo, dice Okumu. L’anno scorso, ha fatto parte di un gruppo di lavoro scientifico di 15 membri, organizzato dalla Fondazione per i National Institutes of Health, che ha presentato una serie di raccomandazioni12 per l’utilizzo di zanzare a guida genica nell’Africa sub-sahariana.
Il rapporto sottolinea che i governi, le comunità e gli scienziati locali avranno bisogno di tempo per assorbire la scienza ed essere abilitati a regolare la tecnologia. “Lo dico con tutta convinzione – alla fine, le persone migliori per prendere queste decisioni sono i paesi stessi”, dice Okumu.
Nel 2017, Kofler ha riunito un gruppo di scienziati ed etici per affrontare le questioni sociali che circondano le unità genetiche13. “Le domande principali si concentrano sulla giustizia”, dice Kofler. Nelle discussioni sul rilascio di un organismo geneticamente modificato in un ambiente africano, i gruppi che sono stati storicamente emarginati hanno il diritto di far parte del processo decisionale, dice.
Okumu vuole che gli scienziati africani sviluppino e testino la tecnologia dei gene-drive a livello locale, il che richiederà il rispetto e la volontà dei finanziatori di sostenere tali sforzi. “La gente teme l’ignoto, e l’ignoto in questo momento viene presentato da una prospettiva occidentale”, dice Okumu. “Non vedo l’ora di un giorno in cui potremo costruire questi costrutti nei nostri laboratori, e in questo modo costruire la fiducia locale.”
Nell’agosto 2018, l’Agenzia nazionale per la biosicurezza del Burkina Faso ha autorizzato Target Malaria a rilasciare un ceppo di zanzara maschile sterile geneticamente modificato, il primo del suo genere nel continente africano. La scorsa settimana, il team ha rilasciato circa 6.400 zanzare che sono state geneticamente modificate ma non ospitano unità genetiche. Gli scienziati sperano che il rilascio migliorerà la percezione della ricerca e fornirà dati per i rilasci futuri.
E anche se i topi a guida genetica sono lontani dal rilascio, GBIRd sta già lavorando con valutatori di rischio, etici ed ecologi per identificare un’isola per una prova sul campo iniziale. “Vogliamo essere sicuri di fare le cose per bene”, dice Saah. “Non importa quanto velocemente si muovono le tecnologie, possiamo far progredire le scienze sociali e l’etica ora.”
.
Leave a Reply