I livelli di FT3 possono facilitare l’individuazione di infiammazione o catabolismo e malnutrizione nei pazienti in dialisi? | Nefrologia
INTRODUZIONE
La funzione tiroidea alterata che colpisce i pazienti eutiroidei in condizioni gravi è stata associata a una minore sopravvivenza. Ci riferiamo alla sindrome da bassa T3 per descrivere le alterazioni della funzione tiroidea che colpiscono un’alta percentuale della popolazione (fino al 75% dei pazienti ricoverati)1 e comportano una diminuzione dell’FT3, T4 libero (FT4) normale o leggermente basso e tireotropina (TSH) normale. Questi cambiamenti sono interpretati come il meccanismo di adattamento dell’organismo di fronte alla malattia e si verificano quando c’è una diminuzione della conversione periferica di T4 e FT3, senza che sia presente alcuna malattia specifica della tiroide. Un’alta prevalenza di bassi livelli di FT3 è stata descritta anche in pazienti con malattia renale cronica (CKD) senza una storia di malattia tiroidea,2 e i livelli di FT3 sono stati identificati come predittori indipendenti di mortalità sia nei pazienti in emodialisi (HD)3 che in quelli in dialisi peritoneale (PD)4 . Non è noto se la causa di questa riduzione di FT3 è solo il meccanismo di adattamento fisiologico che riduce il metabolismo di base quando la malattia è presente, o se è un’alterazione associata a CKD o dialisi e la sua correzione potrebbe contribuire a migliorare la sopravvivenza di questi pazienti. I livelli di FT3 possono essere bassi nei pazienti CKD a causa di vari meccanismi, quali: 1) malnutrizione: Una diminuzione dell’assunzione di cibo potrebbe portare a una riduzione della conversione di T4 in FT3 e infine diminuire la produzione di energia e fermare il catabolismo proteico; 2) infiammazione: Nella CKD si verifica un’infiammazione cronica che può anche essere associata alla diminuzione dell’FT3 durante la dialisi;4,5 3) insufficienza renale in sé: Questo è causato dall’accumulo di tossine uremiche che alterano la funzione tiroidea, come l’acidosi metabolica o una diminuzione dell’escrezione di iodio; o alterazioni associate alle tecniche di dialisi come l’uso di eparina durante l’HD o piccole perdite di T4 o T3 nell’effluente peritoneale.2 Pertanto, la ridotta funzione tiroidea nei pazienti in dialisi potrebbe essere un marker di malnutrizione-infiammazione, o essere secondaria all’insufficienza renale cronica o alla particolare tecnica di dialisi utilizzata.
Lo scopo principale di questo studio è stato quello di valutare l’incidenza della sindrome da bassa T3 nei pazienti stabili in dialisi (HD e PD) e la sua associazione con i diversi marker di malnutrizione e infiammazione.
MATERIALE E METODO
Questo è uno studio descrittivo, trasversale, che ha coinvolto pazienti dializzati cronici (32 in HD e 11 in PD) nell’Ospedale Generale di Segovia durante il mese di aprile 2008. Tutti i pazienti erano in dialisi cronica da almeno 3 mesi ed erano stabili da un punto di vista clinico. “Stabile” è stato definito come nessun ricovero ospedaliero, infezioni intercorrenti o malattie registrate durante il mese precedente lo studio. Undici pazienti sono stati successivamente esclusi dallo studio: Quattro a causa di una malattia della tiroide precedentemente identificata e sette che stavano assumendo farmaci che potevano influenzare la funzione tiroidea.
Il TSH, l’FT4 e l’FT3 della sezione trasversale sono stati misurati mediante immunoanalisi basata sull’elettrochemiluminescenza (ECLIA), utilizzando un analizzatore E170 (Roche Diagnostics, Mannheim, Germania). La sensibilità per i test TSH, FT4 e FT3 era di 0,005mcU/l, 0,3pmol/l e 0,4pmol/l, rispettivamente. I valori di riferimento erano: TSH 0,4-5mcU/l, FT4 11-23pmol/l e FT3 3,9-6,8pmol/l. Abbiamo misurato gli anticorpi antitiroidei (anti-TPO e anti-TG) utilizzando un test di immunoassorbimento (Aeskulisa Aesku Diagnostics, Germania) al fine di escludere malattie autoimmuni (valori superiori a 150U/ml per gli anti-TPO o 50U/ml per i TG erano considerati positivi). Allo stesso tempo, sono stati testati i parametri biochimici ed ematologici associati alla nutrizione e all’infiammazione: albumina, prealbumina, transferrina, colesterolo, ematocrito, creatinina, pH, bicarbonato e proteina C-reattiva (CRP), utilizzando metodi di laboratorio di routine nel nostro ospedale. I livelli dell’ormone della crescita (GH) e del fattore di crescita insulino-simile (IGF-1) sono stati stabiliti anche mediante radioimmunodosaggio in un laboratorio di riferimento. I valori sono espressi in ng/ml. I test sono stati eseguiti prima della prima seduta di dialisi della settimana; i pazienti che dovevano essere sottoposti a dialisi nel pomeriggio sono stati istruiti a digiunare almeno quattro ore prima.
L’apporto calorico e proteico medio giornaliero è stato stabilito utilizzando l’indagine dietetica di tre giorni (programma software Dietsource 3.0 NovartisÆ) ed è stato corretto secondo il peso ideale del paziente. La percentuale di lipidi e carboidrati è stata registrata, così come l’assunzione di sodio, potassio e fosforo.
Lo stato nutrizionale del paziente è stato valutato mediante misurazioni antropometriche effettuate a metà settimana dopo la dialisi con tecniche standard6 e comprendenti: altezza, peso, indice di massa corporea (BMI), triceps skinfold (TSF), circonferenza del braccio (AC) e circonferenza muscolare del braccio (AMC). I risultati sono stati standardizzati calcolando la percentuale di ogni caso rispetto al 50° percentile dei dati ottenuti da una popolazione di adulti spagnoli normali della stessa età e sesso,7,8 considerando deficit moderati-gravi i casi che superavano l’80% della popolazione normale.
Al fine di ottenere una valutazione più accurata dello stato nutrizionale e della composizione corporea, è stata effettuata un’analisi vettoriale della bioimpedenza (BIVA) a metà settimana dopo la dialisi (BIA vettoriale 101; Akern, Florencia, Italia), che ha misurato resistenza (R), reattanza (Xc), angolo di fase (PA), scambio sodio-potassio (I Na/K), acqua corporea totale (TBW), acqua extracellulare (ECW), acqua intracellulare (ICW), massa cellulare, indice di massa cellulare (massa cellulare/altezza2) (BCMI), massa grassa (FM), massa senza grasso (FFM) e massa muscolare. Questi dati sono stati confrontati con i valori di soggetti normali della stessa età e peso.9
La comorbilità è stata stimata utilizzando l’indice Charlson, modificato da Beddhu.10 La dose di dialisi è stata misurata calcolando il KT/V, e l’assunzione di proteine è stata stimata sulla base del tasso catabolico proteico normalizzato per il peso corrente (nPCR).
L’analisi statistica è stata effettuata utilizzando il pacchetto software SPSS, versione 11.0 per Windows. I valori sono stati espressi come percentuali o medie ± SD; un valore di p
RESULTS
Le caratteristiche cliniche dei 32 pazienti possono essere trovate nella tabella 1. Il KT/V medio in HD era 1,6 ± 0,27, e in PD il KT/V medio settimanale era 2,07 ± 0,27.
I valori medi degli ormoni tiroidei erano i seguenti: TSH 2,2 ± 1,5mcU/ml, FT4 14,7 ± 2,3pmol/l e FT3 4,0 ± 0,71pmol/l. Solo due pazienti (6,3%) hanno presentato bassi valori di FT4 e altri due pazienti hanno presentato un TSH aumentato, mentre 17 pazienti (53,1%) hanno presentato bassi livelli di FT3. Non abbiamo trovato alcuna correlazione tra i livelli di FT3, FT4 e TSH. Nessun paziente ha presentato anticorpi antitiroidei. Non ci sono state differenze significative tra i livelli di FT3 secondo il sesso (4.2 ± 0.7 per gli uomini vs. 3.8 ± 0.6 per le donne; ns); i livelli di FT3 erano significativamente più alti in PD che in HD (4.5 ± 0.4 vs. 3.8 ± 0.7; p = 0.016). Non ci sono state differenze nei livelli di FT3 secondo il tipo di dialisi. Tuttavia, i pazienti PD hanno presentato concentrazioni più elevate di TSH (3.5 ± 1.3 vs. 1.7 ± 1.3mcU/ml; p = 0.002), e il BMI era anche più alto nei pazienti PD (30.6 ± 3.3 vs. 24.8 ± 4.4; p = 0.002) rispetto ai pazienti HD.
Per determinare a cosa fosse associata la diminuzione di FT3 in dialisi, abbiamo confrontato i dati clinici, sociodemografici, analitici, antropometrici e BIVA dei pazienti con basso FT3 con i valori normali ottenuti nel nostro laboratorio (
DISCUSSIONE
Di recente, bassi livelli di FT32-4 che non sono causati da una malattia della tiroide ma sono il risultato di un deterioramento della conversione periferica di FT4 in FT3 è stato descritto in un’alta percentuale di pazienti in dialisi. Questo fenomeno può essere paragonabile ad altre incidenze descritte in casi di varie malattie croniche o acute,1 ed è noto come sindrome del malato eutiroideo o sindrome da bassa T3. Tuttavia, la CKD è diversa dal resto dei casi di sindrome malata eutiroidea perché non è accompagnata da un aumento della T3 inversa (rT3).11 Questo perché, nonostante il fatto che la clearance della rT3 nei pazienti renali sia inferiore, sembra esserci una ridistribuzione della rT3 dallo spazio vascolare a quello extravascolare e un aumento della captazione cellulare della rT3.
I nostri dati confermano l’alta incidenza di pazienti con bassi livelli di FT3 (53%) sottoposti a dialisi e senza alcuna malattia tiroidea nota, che è probabilmente dovuta a una carente conversione periferica di T4 e FT3, dato che i livelli di FT3 non erano correlati ai livelli di FT4 o TSH. È stato suggerito che l’accumulo di tossine uremiche o l’acidosi metabolica possono contribuire a una diminuzione dell’FT3.12 Non abbiamo trovato alcun legame tra i livelli di pH e bicarbonato e i livelli di FT3. Non abbiamo anche trovato alcuna correlazione con la dose di dialisi misurata tramite KT/V o con il tempo che i pazienti hanno trascorso in dialisi. Vale la pena considerare che, in generale, le dosi di dialisi per i nostri pazienti erano alte (la media KT/V dei pazienti HD era 1,6 ± 0,27 e la media settimanale KT/V in PD era 2,07 ± 0,27) e l’acidosi era corretta relativamente bene (pH 7,34 ± 0,6 e bicarbonato 22,7 ± 2,8). Per quanto riguarda il tipo di dialisi, abbiamo trovato che i pazienti in dialisi PD avevano livelli più alti di FT3, il che contraddice leggermente i risultati previsti, dato che nella PD ci si possono aspettare maggiori perdite di T4 e T3 nell’effluente.13 Tuttavia, è stato anche dimostrato che queste perdite sono minime: Meno di 10μg di T4 e meno di 0.1μg di T3 al giorno, che è meno del 10% e dell’1% rispettivamente rispetto al tasso di produzione di T4 e T3. Di conseguenza, i nostri risultati confermano che la mancanza di conversione periferica come risposta alla malnutrizione è molto più importante della perdita peritoneale, e nel caso di questo studio, i pazienti con PD hanno registrato risultati nutrizionali migliori, compreso un BMI più alto. Coincidiamo con i risultati di altri autori e riteniamo che la diminuzione dell’FT3 nei pazienti in dialisi sia principalmente la risposta adattativa dell’organismo alla malattia con lo scopo di ridurre il metabolismo di base ed evitare i catabolismi.2 Nel caso delle malattie croniche, a volte è difficile accertare se la diminuzione dell’FT3 sia causata dall’attività della malattia o dalla malnutrizione associata all’attività della malattia. La funzione tiroidea non è alterata solo dal digiuno, ma anche dalla composizione della dieta; pertanto, una diminuzione dell’apporto di carboidrati provoca una maggiore riduzione dell’FT3 rispetto a una diminuzione dell’apporto di proteine. Un apporto calorico insufficiente, anche con un adeguato apporto proteico, può causare la “sindrome del malato eutiroideo”.14 Non abbiamo trovato alcuna correlazione tra i livelli di FT3 e l’apporto calorico totale (kcal/giorno) o l’apporto calorico corretto secondo il peso ideale o reale. Non abbiamo anche trovato differenze nella composizione della dieta tra pazienti con FT3 normale e diminuita e per questo motivo siamo riluttanti a sostenere l’ipotesi che una diminuzione dell’FT3 nei pazienti in dialisi sia dovuta a un apporto insufficiente. Tuttavia, abbiamo trovato un’associazione tra i livelli di FT3 e alcuni parametri biochimici e antropometrici di malnutrizione, come prealbumina, transferrina, BMI, AC, AMC o massa muscolare misurata tramite bioimpedenza. Pertanto, sembra che i livelli di FT3 siano associati alla malnutrizione ma non alla mancanza di apporto calorico. Inoltre, abbiamo trovato una correlazione inversa con i livelli di CRP. Durante le infezioni o la sepsi c’è una riduzione degli ormoni tiroidei attraverso vari meccanismi, tuttavia, fondamentalmente si verifica a causa di una diminuzione della conversione periferica di FT4 a T3. La riduzione degli ormoni tiroidei è associata alla gravità del processo15 e sembra, almeno in parte, essere mediata dalle citochine.16,17 L’infiammazione cronica che si verifica nella CKF sembra anche essere associata a una diminuzione dell’FT3 nell’HD.4,5 Negli studi di Zocalli et al. è stata trovata una diminuzione dei livelli di FT3 in entrambi i tipi di pazienti in dialisi rispetto ai soggetti sani; essi indicano anche che i livelli di FT3 sono correlati inversamente ai livelli di interleuchina 6 e CRP. La possibilità che la diminuzione di FT3 sia il risultato della malattia o dell’età che è associata a una riduzione del metabolismo energetico di base dovrebbe anche essere considerato, tuttavia nel nostro studio non abbiamo trovato alcuna correlazione tra FT3 e l’età o comorbidità in generale, tuttavia, c’era una correlazione con i parametri di infiammazione.
Di recente, l’International Society of Renal Nutrition and Metabolism (ISRNM)18 ha suggerito di sostituire il termine “malnutrizione” con “protein-energy wasting” (PEW) per definire questa situazione che colpisce i pazienti in dialisi, dato che “malnutrizione” nel senso stretto della parola significa “assunzione insufficiente” e, la situazione che si osserva spesso in questi pazienti è un metabolismo alterato (metabolismo eccessivo o mancanza di anabolismo), promosso da citochine infiammatorie, che porta alla perdita di proteine o riserve energetiche. Crediamo che una diminuzione dell’FT3 sia il meccanismo adattativo dell’organismo per difendersi dal deperimento proteico che non è causato da una mancanza di apporto, ma piuttosto dall’infiammazione o dalla mancanza di sostanze anabolizzanti che sono associate alla CKF. Prendendo questo in considerazione, i risultati di uno studio condotto da Lim et al.2 sono interessanti perché, sebbene le dosi di FT3 somministrate a soggetti normali non alterino il bilancio proteico, i pazienti HD con bassi livelli di FT3 hanno sperimentato un aumento del catabolismo. Questi dati suggeriscono che i pazienti che sperimentano una diminuzione della conversione periferica di T4 in FT3 si difendono da una situazione catabolica e che la T3 peggiorerebbe la malnutrizione proteica aumentando il catabolismo.
Al momento non esiste ancora un marcatore affidabile per la massa muscolare e il catabolismo proteico nei pazienti in dialisi, dato che la creatinina sierica o la generazione di urea possono essere influenzate dalla dose di dialisi. Secondo le raccomandazioni dell’ISRNM,18 la perdita di massa muscolare dovrebbe essere inclusa nei criteri PEW dato che può essere molto importante sia clinicamente che prognosticamente. Data la buona correlazione trovata nel nostro studio tra i livelli di FT3 e la massa muscolare, e tenendo conto che l’FT3 probabilmente varia rapidamente nelle malattie cataboliche, suggeriamo che i livelli di FT3 dovrebbero essere utilizzati come indicatore precoce del catabolismo e come marcatore per misurare la risposta a certe terapie che mirano a trattarlo, per esempio, per valutare la risposta a supplementi nutrizionali o sostanze anabolizzanti.
CONCLUSIONE
La metà dei nostri pazienti in dialisi ha presentato livelli diminuiti di FT3 nel siero senza alterazione del TSH o dell’FT4 (sindrome del basso FT3). Questa riduzione sembra essere causata da un’alterata conversione periferica di FT4 in FT3. Questi livelli sono fondamentalmente correlati con i parametri di malnutrizione e infiammazione e potrebbero essere considerati un marcatore precoce di catabolismo o PEW.
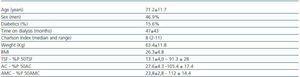
Tabella 1. Caratteristiche sociodemografiche e antropometriche
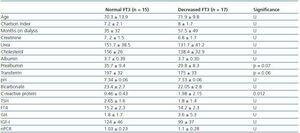
Tabella 2. Differenze sociodemografiche e analitiche tra pazienti con FT3 normale (>3.95) e pazienti con FT3 diminuito
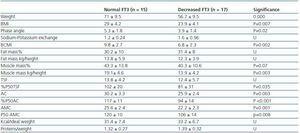
Tabella 3. Differenze antropometriche e BIVA tra pazienti con FT3 normale (> 3,95) e pazienti con FT3 diminuito
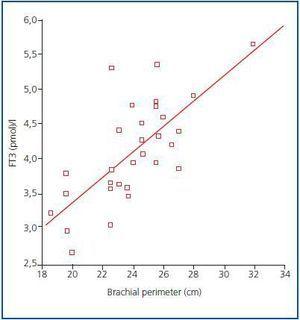
Figura 1.
Leave a Reply