Frontiers in Plant Science
The Different Types of Heterochrony
Negli anni 1870, Ernst Haeckel identificò i cambiamenti temporali e spaziali nello sviluppo di un discendente rispetto al suo antenato come i due meccanismi più importanti per l’evoluzione (Haeckel, 1875). Haeckel chiamò i cambiamenti spaziali eterotopia e i cambiamenti temporali eterocronia.
Tuttavia, il significato di eterocronia è cambiato da quando Haeckel ha coniato il termine. Haeckel usava il termine eterocronia per riferirsi alle deviazioni dalla sua ben nota “Legge biogenetica”, che afferma che la sequenza degli eventi di sviluppo (ontogenesi) ricapitola in gran parte la sequenza degli eventi nella storia evolutiva della specie (filogenesi) (Haeckel, 1875). Così, l’eterocronia originariamente si riferiva a un cambiamento nel tempo di apparizione di una caratteristica in una sequenza di sviluppo di un organismo, rispetto alla sequenza che si è verificata nella filogenesi dell’organismo. A metà del 20° secolo, De Beer (1951) disaccoppiò l’eterocronia dalla ricapitolazione. Usò l’eterocronia per indicare le differenze nella tempistica degli eventi di sviluppo quando si confrontano due specie affini, per spiegare come l’eterocronia potesse generare diversità tra gli organismi. Gould (1977) ha riassociato il concetto di eterocronia alla ricapitolazione, definendo l’eterocronia come “cambiamenti nel tempo relativo di apparizione e nel tasso di sviluppo di caratteri già presenti negli antenati”, enfatizzando i cambiamenti nelle dimensioni e nella forma relativa, piuttosto che nel tempo degli eventi di sviluppo, per rilevare l’eterocronia. A cavallo del 21° secolo, Smith ha proposto che sarebbe più utile definire due tipi di eterocronia: “eterocronia di crescita”, che enfatizza i cambiamenti nelle dimensioni e nella forma finali; e “eterocronia di sequenza”, che è più vicina all’uso originale di Haeckel e de Beer, e permette di spiegare la variazione fenotipica attraverso i cambiamenti nei tempi degli eventi di sviluppo (Smith, 2002, 2003; Keyte e Smith, 2014).
L’eterocronia delle sequenze (di seguito denominata “eterocronia”) può essere classificata in due categorie: paedomorfosi e peramorfosi. Rispetto allo sviluppo ancestrale, la paedomorfosi porta a un risultato giovanile o semplice, mentre la peramorfosi porta a un fenotipo adulto o più complesso. Ognuna di queste due categorie di eterocronia può risultare da una variazione nei tempi di inizio, di compensazione o di velocità di un processo di sviluppo, come proposto da Alberch et al. (1979). Questa variazione può risultare in 6 diversi tipi di eterocronia (Figura 1). La paedomorfosi può risultare dalla fine precoce di un processo di sviluppo (progenesi), da un inizio ritardato del processo (post-spostamento), o da un tasso di sviluppo più lento (neotenia). La peramorfosi è il risultato di un periodo prolungato di sviluppo dovuto a una fine più tardiva (ipermorfosi) o un inizio più precoce (pre-spostamento), o di un tasso di sviluppo più elevato (accelerazione) (Figura 1A). Esempi ipotetici di peramorfosi e paedomorfosi nell’embriogenesi vegetale e nello sviluppo vegetativo sono mostrati nelle figure 1B,C.
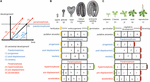
FIGURA 1. Tipi di eterocronia. (A) Rappresentazione schematica dei 6 tipi di eterocronia. La linea nera rappresenta il tempo necessario per raggiungere un certo stadio di sviluppo nell’ontogenesi ancestrale. Le linee blu mostrano i 3 tipi di paedomorfosi: progenesi (offset precoce), post-spostamento (insorgenza ritardata) e neotenia (tasso di sviluppo più lento). Le linee rosse mostrano i 3 tipi di peramorfosi: ipermorfosi (offset ritardato), pre-spostamento (insorgenza precoce), e accelerazione (tasso di sviluppo più elevato). Il disegno in (A) è basato su Alberch et al. (1979) e Geuten e Coenen (2013). (B) Scenari di eterocronia per l’embriogenesi. L’embriogenesi di Arabidopsis è presa qui come l’ipotetico sviluppo ancestrale, diviso in quattro stadi per scopi illustrativi. Un quinto stadio, in cui l’embrione ha prodotto le prime due foglie più i due cotiledoni (indicato come piantina embrionale), è proposto come lo stadio finale dell’embriogenesi peramorfica, mentre l’embriogenesi paedomorfica dovrebbe concludersi allo stadio cardiaco. (C) Scenari di eterocronia per lo sviluppo vegetativo. In questo caso, lo sviluppo vegetativo di Arabidopsis, in cui la pianta continua a produrre foglie cauline/riproduttive sul fusto prima della fioritura (disegnato in alto), rappresenta un caso ipotetico di sviluppo vegetativo peramorfo, rispetto a un ipotetico antenato che fiorisce allo stadio adulto senza produrre foglie cauline. Lo sviluppo vegetativo paedomorfo è previsto che le piante fioriscano allo stadio giovanile.
Mentre queste classificazioni sono utili per illustrare i cambiamenti nei tempi di sviluppo, quando si considerano esempi di vita reale, è spesso difficile distinguere tra diversi tipi di eterocronia. In molti casi, l’evoluzione può risultare in tipi distinti di eterocronia, ognuno dei quali si verifica in una fase discreta di un processo di sviluppo (rivisto nelle piante da Li e Johnston, 2000).
Eterocronia nell’evoluzione e nella diversificazione delle piante
Le piante terrestri (embriofite) hanno subito molte innovazioni morfologiche dalla loro comparsa nel periodo mid-Ordoviciano, circa 470 milioni di anni fa. I primi lignaggi divergenti si sono originati in un periodo di più di 100 milioni di anni, durante il Siluriano e i primi periodi del Devoniano (Kenrick e Crane, 1997; Pires e Dolan, 2012; Harrison e Morris, 2018). Le embriofite si sono evolute da un antenato delle alghe d’acqua dolce che era legato ai gruppi di carofite esistenti Charales, Coleochaetales e Zygnematales. La transizione alla crescita sulla terraferma, come osservato nelle briofite (hornworts, muschi ed epatiche), ha coinvolto l’origine delle spore, l’alternanza di generazioni di gametofiti e sporofiti, forme monoassiali e crescita tridimensionale. Le innovazioni delle piante vascolari terrestri (licofite, monofite e spermatofite) comprendevano la biforcazione, l’indeterminatezza, la dominanza sporofitica, la ramificazione ascellare e la formazione di meristemi, foglie e radici (Harrison, 2017).
Tutti i passi evolutivi di cui sopra sono stati collegati all’eterocronia. Per l’origine della sporogenesi, i dati delle briofite suggeriscono che le spore sono state prodotte direttamente dagli zigoti in un processo che coinvolge la citocinesi precoce, l’accelerazione della meiosi e la deposizione ritardata della parete dallo zigote alle meiospore (Brown e Lemmon, 2011). Lo sporofito ramificato (polisporangiofita) è stato ipotizzato che si sia evoluto attraverso una crescita vegetativa estesa della cellula apicale. Questo periodo più lungo di crescita vegetativa è stato proposto come risultato di un asse embrionale prolungato, ramificazione dei germogli, e un ritardo nella transizione alla crescita riproduttiva, producendo lo sporangio (Rothwell et al., 2014; Tomescu et al., 2014). Ulteriori studi sui fossili di piante dovrebbero fornire maggiori prove di antiche morfologie vegetali, che permetterebbero il confronto tra forme contemporanee ed estinte (Rothwell et al., 2014).
Nelle piante estinte, sono stati identificati cambiamenti eterocronici nello sviluppo dei gametofiti, nell’embriogenesi, nello sviluppo vegetativo, nella maturazione dei germogli e nella morfogenesi floreale. Il gametofito femminile di Gnetum è strutturalmente divergente dalle altre piante a causa delle differenze nei tempi della fecondazione e dello sviluppo somatico. Alterazioni temporali nella progressione del ciclo cellulare hanno contribuito a modelli temporali diversificati della spermatogenesi e della fusione dei gameti durante la fecondazione (Friedman, 1999; Tian et al., 2005). In un caso di progenesi, la fecondazione avviene in uno stadio nucleare libero dello sviluppo somatico, uno stadio giovanile rispetto all’ontogenesi somatica ancestrale, precludendo la differenziazione delle cellule uovo (Friedman e Carmichael, 1998). Lo sviluppo apomittico degli ovuli di Boechera è stato associato a modelli di espressione genica eterocroni rispetto agli ovuli non apomittici (sessuali) (Sharbel et al., 2010). Lo sviluppo delle Rafflesiaceae, una famiglia di piante oloparassite che infetta la vite, mostra due spostamenti eterocronici: un arresto allo stadio proembrionale, che può essere considerato un esempio di neotenia, e l’accelerazione della transizione dall’endofita indifferenziato alla fioritura, saltando la maturazione dei germogli vegetativi (Nikolov et al, 2014).
Un’analisi Quantitative Trait Loci (QTL) che confronta popolazioni di Eucalyptus globulus con cambiamento precoce della fase vegetativa e popolazioni in cui il cambiamento della fase vegetativa è ritardato di diversi anni ha identificato l’espressione del microRNA EglMIR156.5 come responsabile della variazione eterocronica nel cambiamento della fase vegetativa in E. globulus (Hudson et al., 2014). Un’altra analisi QTL ha concluso che l’eterocronia è alla base della variazione naturale nella forma delle foglie di Cardamine hirsuta (Cartolano et al., 2015). La mappatura QTL ha determinato che l’effetto è causato dalla variazione cis-regolatoria nel repressore floreale ChFLC, in modo tale che le popolazioni con alleli ChFLC a bassa espressione mostrano sia una fioritura precoce che un’acquisizione accelerata dei tratti delle foglie adulte, in particolare un maggior numero di foglioline. Le analisi morfometriche e QTL hanno determinato che le mutazioni eterocrone contribuiscono alla variazione naturale in Antirrhinum e all’eteroblastia della vite (Costa et al., 2012; Chitwood et al., 2016). Una Principal Component Analysis (PCA) delle traiettorie ontogenetiche della forma della foglia tra i tre generi di felci marsileacee (Marsilea, Regnellidium, e Pilularia) ha suggerito che esse mostrano un fenotipo paedomorfico, rispetto al più complesso sviluppo ancestrale, causato da un tasso di crescita accelerato e una precoce terminazione ad una forma semplificata della foglia (Pryer e Hearn, 2009).
La diversità evolutiva nell’architettura delle infiorescenze delle Solanaceae è modulata da spostamenti eterocronici nell’acquisizione del destino floreale (Lippman et al, 2008; Park et al., 2012). Un confronto dei trascrittomi della maturazione del meristema di cinque specie di Solanaceae addomesticate e selvatiche ha rivelato un picco di divergenza di espressione, che assomiglia al modello della “clessidra inversa” per l’embriogenesi animale, che afferma che un periodo di divergenza a metà sviluppo guida la variazione morfologica (Lemmon et al., 2016). Nelle graminacee, un ritardo nella transizione dal meristema del germoglio (SM) al meristema floreale (FM) porta a pannocchie più complesse (Kyozuka et al., 2014). I pioppi (Populus sp.) e i salici (Salix sp.) portano infiorescenze unisessuali compatte note come “amenti”, che sono stati proposti per essere evoluti da una semplificazione della forma della pannocchia da una transizione precoce da SM a FM (Cronk et al., 2015). I cambiamenti eterocronici hanno anche contribuito alla variazione naturale nel tempo di fioritura e nell’architettura dei germogli tra le popolazioni di Mimulus guttatus (Baker e Diggle, 2011).
La diversità morfologica del perianzio nelle Dipsacoideae è causata da cambiamenti eterocronici nell’inizio degli organi, in particolare nel numero di sepali (Naghiloo e Claßen-Bockhoff, 2017). La grande diversità di forma dei sepali tra le specie di Iris è dovuta più all’eterocronia che ai cambiamenti eterotopici (Guo, 2015). Uno studio in Brassicaceae ha mostrato che l’evoluzione della monosimmetria della corolla dal fiore ancestrale polisimmetrico ha coinvolto uno spostamento eterocronico nell’espressione dei geni CYC2 (un clade di fattori di trascrizione TCP) dall’espressione adassiale precoce nei meristemi floreali ancestrali, a una successiva espressione adassiale nello sviluppo dei petali (Busch et al., 2012). L’espressione eterocrona, ma non eterotopica, di CYC2 è stata anche associata a una perdita di cellule coniche papillate nei petali e a un passaggio al sistema di impollinazione degli uccelli in Lotus (Ojeda et al., 2017). Una morfologia paedomorfica, in cui i fiori tengono il polline maturo in strutture non aperte simili a gemme, ha portato all’impollinazione specializzata in un clade di viti del Madagascar (Euphorbiaceae) (Armbruster et al., 2013). L’evoluzione del capitello cleistogamo da uno stato ancestrale chasmogamo è un classico esempio di paedomorfosi, poiché la forma cleistogama mostra tratti giovanili (Lord e Hill, 1987). La cleistogamia nelle Asteraceae si è evoluta specificamente attraverso il pre-spostamento e la progenesi dello sviluppo floreale, così come la neotenia di tutti i verticilli diversi dal gineceo (Porras e Muñoz, 2000). La diversità delle morfologie floreali all’interno di Jaltomata, un genere di Solanaceae, è dovuta all’ipermorfosi e all’accelerazione di alcuni tratti della corolla (Kostyun et al., 2017). La diversità delle orchidee farfalla delle Azzorre è anche causata da spostamenti floreali eterocronici (Bateman et al., 2014). Recentemente, Ronse de Craene (2018) ha sottolineato l’importanza dell’eterocronia in tre processi di sviluppo: la fillotassi, lo sviluppo di primordi stame-petali comuni e l’obdiplostemonia, collegando i cambiamenti del tasso di crescita con l’iniziazione ritardata degli organi. I tassi di crescita eterocronici del perianzio e dello stile, e l’allungamento precoce dell’ipanto, sono responsabili della grande diversità di specie all’interno del genere Eugenia, morfologicamente omogeneo (Vasconcelos et al., 2018). Infine, l’espressione eterocronica dell’allele fw2.2, che influisce sulla divisione cellulare nei primi mesi dello sviluppo del frutto, è responsabile della variazione naturale delle dimensioni dei frutti di pomodoro (Cong et al., 2002).
Studiare i mutanti eterocronici per chiarire il controllo genetico dei tempi
Lo studio dei mutanti interessati dai tempi di sviluppo ha fatto luce sui percorsi genetici che controllano la morfogenesi e le transizioni di sviluppo. L’eterocronia può essere causata da un’attivazione o repressione anticipata o ritardata di queste vie.
I mutanti lec, dicer-like1 (dcl1) ed extra cotiledone (xtc) di Arabidopsis thaliana rappresentano fenotipi eterocronici che hanno aiutato a definire i programmi di maturazione dei semi. I mutanti lec producono cotiledoni con caratteristiche di identità fogliare (Meinke, 1992), un chiaro esempio di omeosi: la sostituzione di una struttura con un’altra. Tuttavia, è spesso difficile distinguere tra omeosi ed eterocronia, poiché l’omeosi può essere il risultato sia dell’eterocronia che dell’eterotopia (Li e Johnston, 2000; Geuten e Coenen, 2013). Durante la tarda embriogenesi, LEC2 promuove la maturazione dei semi e reprime l’identità postembrionale (Stone et al., 2008). Come i mutanti lec, i mutanti dcl1 mostrano fenotipi peramorfici durante l’embriogenesi, poiché lo sviluppo dei cloroplasti e l’espressione dei geni della proteina di stoccaggio dei semi si verificano prima che negli embrioni wild type. DCL1 è richiesto per la biogenesi dei microRNA, che reprimono la maturazione dei semi attraverso i regolatori principali LEC2 e FUSCA3 (Nodine e Bartel, 2010; Willmann et al., 2011). I mutanti xtc1, xtc2, e la programmazione alterata del meristema1 (amp1) mostrano un fenotipo omeotico in cui le prime una o due foglie sono trasformate in cotiledoni (Conway e Poethig, 1997). In questi tre mutanti, la transizione da globoso a cuore è ritardata, causando un meristema di germoglio allargato, che porta alla formazione di organi extra durante l’embriogenesi. Questo fenotipo può essere interpretato come ipermorfosi, un tipo di peramorfosi, poiché lo sviluppo dell’embrione è esteso ad una forma più sviluppata (come lo scenario peramorfico in Figura 1B). Tuttavia, se lo sviluppo vegetativo è scelto come punto di riferimento, i mutanti lec rappresenterebbero un caso di pre-spostamento (peramorfosi), e xtc1, xtc2, e amp1 rappresenterebbero post-spostamento (paedomorfosi) nell’acquisizione dell’identità fogliare. AMP1 è richiesto per la repressione traslazionale mediata dai miRNA sulla membrana ER (Li et al., 2013).
La regolazione genetica della transizione da giovane ad adulto, chiamata anche cambiamento di fase vegetativa, è stata studiata utilizzando sia mutanti paedomorfi che peramorfi. Gli screening dei mutanti che mostrano un fenotipo adulto precoce (peramorfo) hanno prodotto alleli di geni legati alla biogenesi dei piccoli RNA come zippy/ago7, sgs3 e rdr6 (Hunter et al., 2003; Peragine et al., 2004), mentre i mutanti con un fenotipo adulto tardivo (paedomorfo) sono dovuti a un aumento dei livelli di miRNA (Gillmor et al., 2014; Xu M. et al., 2016, 2018; Guo et al., 2017). La base genetica di questi fenotipi è spiegata dall’espressione alterata dei microRNA strettamente correlati miR156 e miR157, i principali regolatori del cambiamento di fase vegetativa che agiscono reprimendo i fattori di trascrizione SPL sia a livello trascrizionale che traslazionale, in modo soglia-dipendente (Wu e Poethig, 2006; Chuck et al., 2007; Poethig, 2013; He et al., 2018). Entrambe le famiglie di geni MIR156 e SPL sono direttamente regolate da marchi epigenetici: MIR156 è attivato da H3K4me3 e H3K4ac, che sono promossi dal complesso SWR1-C e dal rimodellatore della cromatina BRAHMA, ed è represso da H3K27me3, che è promosso dalle proteine Polycomb SWINGER e CURLY LEAF e dal rimodellatore della cromatina PICKLE (Xu M. et al., 2016; Xu Y. et al., 2016; Xu M. et al., 2018). I geni SPL sono attivati dall’acetilazione degli istoni mediata dal complesso SAGA-like e repressi dall’H2AUb mediata dalle proteine Polycomb RING1A e RING1B (Kim et al., 2015; Li et al., 2017). Lo studio di piante con perdita o guadagno di funzione dei geni SPL ha anche definito una via endogena di fioritura in cui alcuni geni SPL promuovono l’espressione di miR172, che a sua volta promuove la fioritura reprimendo i repressori di fioritura della famiglia APETALA2 (Wang et al., 2009; Wu et al., 2009; Huijser e Schmid, 2011).
Oltre alle principali transizioni di sviluppo, la morfogenesi degli organi può anche essere influenzata dall’attivazione eterocronica dei regolatori genetici. Per esempio, la germinazione precoce degli embrioni di Brassica rapa risulta in organi con mosaici di identità di cotiledoni e foglie (Fernandez, 1997), e l’espressione temporale differenziale della classe II dei geni TEOSINTE BRANCHED1/CYCLOIDEA/PROLIFERATION CELL FACTOR (TCP) risulta in foglie con dimensioni e forma diverse (Efroni et al, 2008).
Meccanismi che guidano i cambiamenti nei tempi di sviluppo nelle piante (eterocronia trascrizionale, metabolica e cellulare)
L’eterocronia trascrizionale si riferisce a un cambiamento nei tempi di attivazione o repressione dell’espressione genica, ed è spesso causata da cambiamenti nelle regioni geniche cis-regolatrici (Pham et al., 2017). L’eterocronia trascrizionale nei percorsi genetici di cui sopra è un modo comune di produrre fenotipi eterocronici. Il controllo metabolico delle vie che regolano le transizioni di sviluppo (indicato qui come “eterocronia metabolica”), e il controllo temporale della proliferazione, espansione e differenziazione cellulare (indicato qui come “eterocronia cellulare”) sono altri meccanismi che guidano l’eterocronia nelle piante (Figura 2). I processi trascrizionali, metabolici e cellulari sono interconnessi, quindi l’origine molecolare dell’eterocronia può essere dovuta a una combinazione di meccanismi.

FIGURA 2. Meccanismi che guidano l’eterocronia nelle piante. (A) Eterocronia cellulare. È mostrata la sequenza di foglie a rosetta prodotte durante lo sviluppo vegetativo. Il fenotipo delle piante Arabidopsis Columbia wild type è preso come ipotetico stato ancestrale; sono mostrati anche uno scenario paedomorfo (neotenia) e uno scenario peramorfo (accelerazione). Le frecce rappresentano la direzione dell’onda dell’arresto della divisione cellulare in un gradiente basipetale, dove le cellule sotto la linea tratteggiata si stanno ancora dividendo attivamente mentre le cellule sopra si stanno espandendo e/o differenziando. (B) Eterocronia trascrizionale e metabolica. Una rappresentazione grafica dell’abbondanza prevista del microRNA miR156/7 e dei suoi obiettivi, i geni SPL, così come l’abbondanza di zucchero lungo il tempo dello sviluppo vegetativo, corrispondente ai fenotipi in (A). Le linee tratteggiate rappresentano la soglia di abbondanza di miR156/7 e SPL che porta alla giovinezza (sopra la soglia) o all’età adulta (sotto la soglia). In questo caso, un ritardo nella repressione di miR156 e nell’attivazione dell’espressione SPL e della produzione di zucchero porta alla paedomorfosi, mentre un decadimento precoce di miR156 e una precoce attivazione dell’espressione SPL e della produzione di zucchero porta alla peramorfosi. Questi disegni sono rappresentazioni semplificate e non riflettono le esatte abbondanze in natura. Il modello reale di abbondanza di miR156/SPL è più vicino a quello raffigurato per lo stato di “peramorfosi”.
L’eterocronia metabolica può essere influenzata da ormoni, zuccheri e segnali redox (Jia et al., 2017). La biosintesi differenziale, il trasporto e la percezione di ormoni come l’auxina, l’acido jasmonico (JA), la gibberellina e l’acido abscisico influenzano l’eterocronia controllando i regolatori dei processi di sviluppo. Per esempio, i mutanti nei FATTORI DI RISPOSTA DELL’AUXINA (ARF) ARF3 e ARF4 ritardano la transizione adulta (Fahlgren et al., 2006; Hunter et al., 2006), e l’omeostasi dell’auxina controlla la transizione dal mantenimento delle cellule staminali floreali alla formazione del gineceo (Yamaguchi et al., 2017). Il JA esogeno può ritardare la transizione adulta posticipando il declino dell’espressione del miR156 (Beydler et al., 2016), e la gibberellina accelera la fioritura liberando i geni SPL dalla repressione delle proteine DELLA (Yu et al., 2012). Lo stato nutrizionale è stato associato al controllo del cambiamento di fase vegetativa fin dall’inizio del 20° secolo (Goebel, 1908). Lo zucchero prodotto dalla fotosintesi è necessario per l’acquisizione di tratti adulti ed è parzialmente responsabile della diminuzione dell’espressione di miR156 nel tardo sviluppo vegetativo (Yang et al., 2013; Yu et al., 2013; Buendía-Monreal e Gillmor, 2017). HEXOKINASE1 (HXK1) e Trealosio-6-fosfato (T6P) sono importanti per la repressione mediata dallo zucchero di miR156, promuovendo così il cambiamento di fase vegetativa e la fioritura (Wahl et al., 2013; Yang et al., 2013).
A livello cellulare, l’organogenesi consiste in una sequenza di tre fasi: lo stabilimento della polarità, la proliferazione cellulare e l’espansione cellulare (Walcher-Chevillet e Kramer, 2016). La tempistica dell’inizio e della fine di queste fasi è cruciale per le dimensioni e la forma degli organi, e l’eterocronia in questa sequenza porta alla diversificazione delle dimensioni e della forma degli organi (Figura 2). La transizione dalla proliferazione cellulare all’espansione e differenziazione cellulare richiede un coordinamento tra il ciclo cellulare e la crescita cellulare (Sablowski e Carnier Dornelas, 2014). Nelle foglie di piante modello, questa transizione si muove come un’onda basipetale di arresto del ciclo cellulare che inizia nella parte distale del primordio e si sposta verso la base. Le cellule dietro il fronte di arresto mitotico diventano altamente vacuolate e iniziano ad espandersi (Donnelly et al., 1999; Czesnick e Lenhard, 2015). Tuttavia, altre specie di piante possono mostrare una crescita diffusa e gradienti di arresto del ciclo cellulare acropetali o bidirezionali (Das Gupta e Nath, 2015). L’acquisizione della capacità fotosintetica è necessaria per il passaggio dalla divisione cellulare all’espansione cellulare (Andriankaja et al., 2012). Questo passaggio è correlato al ruolo dello zucchero nel promuovere la via Target of Rapamycin (TOR) e nel reprimere la chinasi 1 (SnRK1) legata al saccarosio-non-fermentante: TOR e T6P inducono l’espansione cellulare promuovendo la sintesi macromolecolare, mentre SnRK1 promuove il catabolismo (Tsai e Gazzarrini, 2014; Sablowski, 2016). Due microRNA giocano ruoli opposti in questo spostamento cellulare: il miR319 reprime l’espressione dei fattori TCP di classe II, che sono inibitori della proliferazione cellulare, mentre il miR396 limita l’espressione dei GROWTH REGULATING FACTORS (GRF), che ritardano il differenziamento (Das Gupta e Nath, 2015; Maugarny-Calés e Laufs, 2018). La transizione da un meristema apicale di germoglio indeterminato a un meristema floreale determinato coinvolge anche la regolazione temporale dell’identità cellulare. La tempistica dell’attivazione di AGAMOUS di KNUCKLES, che a sua volta reprime WUSCHEL, definisce la finestra temporale di indeterminazione e di conseguenza le dimensioni e il numero di organi (Sun et al., 2014).
Conclusione
La comprensione della regolazione temporale dello sviluppo delle piante è necessaria per apprezzare meglio la diversità delle forme vegetali che vediamo in natura, per spiegare l’evoluzione morfologica delle piante e per manipolare l’architettura vegetale a beneficio dell’agricoltura. Come sottolineato sopra, meccanismi trascrizionali, metabolici e cellulari interconnessi guidano l’eterocronia nelle specie esistenti. Ulteriori ricerche su questi percorsi nelle angiosperme e nei lignaggi vegetali basali dovrebbero rivelare di più sui cambiamenti nei tempi di sviluppo che hanno guidato l’evoluzione dello sviluppo nelle piante.
Contributi degli autori
MB-M ha concepito e scritto il manoscritto. CSG ha curato e rivisto il manoscritto.
Conflict of Interest Statement
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Alberch, P., Gould, S., Oster, G., and Wake, D. (1979). Dimensione e forma nell’ontogenesi e nella filogenesi. Paleobiologia 5, 296-317. doi: 10.1017/S0094837300006588
CrossRef Full Text | Google Scholar
Andriankaja, M., Dhondt, S., DeBodt, S., Vanhaeren, H., Coppens, F., DeMilde, L., et al. Uscita dalla proliferazione durante lo sviluppo della foglia in Arabidopsis thaliana: un processo non così graduale. Dev. Cell 22, 64-78. doi: 10.1016/j.devcel.2011.11.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Armbruster, W. S., Lee, J., Edwards, M. E., e Baldwin, B. G. (2013). Paedomorfia floreale porta alla specializzazione secondaria nell’impollinazione di Madagascar Dalechampia (Euphorbiaceae). Evolution 67, 1196-1203. doi: 10.1111/evo.12002
PubMed Abstract | CrossRef Full Text | Google Scholar
Baker, R. L., e Diggle, P. K. (2011). Nodo-specifica ramificazione e cambiamenti eterocronici alla base di differenze a livello di popolazione in Mimulus guttatus (Phrymaceae) architettura tiro. Am. J. Bot. 98, 1924-1934. doi: 10.3732/ajb.1100098
PubMed Abstract | CrossRef Full Text | Google Scholar
Bateman, R. M., Rudall, P. J., Bidartondo, M. I., Cozzolino, S., Tranchida-Lombardo, V., Carine, M. A., et al. (2014). Speciazione via heterochrony floreale e presunta commutazione ospite micorrizica di orchidee farfalla endemica sull’arcipelago delle Azzorre. Am. J. Bot. 101, 979-1001. doi: 10.3732/ajb.1300430
PubMed Abstract | CrossRef Full Text | Google Scholar
Beydler, B. D., Osadchuk, K., Cheng, C.-L., Manak, J. R., and Irish, E. E. (2016). La fase giovanile del mais vede upregulation dei geni di risposta allo stress ed è esteso da JA esogeno. Plant Physiol. 171, 2648-2658. doi: 10.1104/pp.15.01707
PubMed Abstract | CrossRef Full Text | Google Scholar
Brown, R. C., e Lemmon, B. E. (2011). Spore prima degli sporofiti: ipotizzando l’origine della sporo-genesi alla transizione algale – vegetale. Nuovo Phytol. 190, 875-881. doi: 10.1111/j.1469-8137.2011.03709.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Buendía-Monreal, M., e Gillmor, C. S. (2017). Repressione convergente di miR156 da zucchero e il modulo CDK8 di Arabidopsis Mediator. Dev. Biol. 423, 19-23. doi: 10.1016/j.ydbio.2017.01.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Busch, A., Horn, S., Mühlhausen, A., Mummenhoff, K., e Zachgo, S. (2012). Monosimmetria della corolla: evoluzione di una novità morfologica nella famiglia delle Brassicaceae. Mol. Biol. Evol. 29, 1241-1254. doi: 10.1093/molbev/msr297
PubMed Abstract | CrossRef Full Text | Google Scholar
Cartolano, M., Pieper, B., Lempe, J., Tattersall, A., Huijser, P., Tresch, A., et al. (2015). Eterocronia sottende variazione naturale in Cardamine hirsuta foglia forma. Proc. Natl. Acad. Sci. U.S.A. 112, 10539-10544. doi: 10.1073/pnas.1419791112
PubMed Abstract | CrossRef Full Text | Google Scholar
Chitwood, D. H., Klein, L. L., O’Hanlon, R., Chacko, S., Greg, M., Kitchen, C., et al. (2016). Forme latenti di sviluppo ed evolutive incorporate nella foglia della vite. New Phytol. 210, 343-355. doi: 10.1111/nph.13754
PubMed Abstract | CrossRef Full Text | Google Scholar
Chuck, G., Cigan, A. M., Saeteurn, K., e Hake, S. (2007). Il mais eterocrono mutante corngrass1 risulta dalla sovraespressione di un microRNA in tandem. Nat. Genet. 39, 544-549. doi: 10.1038/ng2001
PubMed Abstract | CrossRef Full Text | Google Scholar
Cong, B., Liu, J., and Tanksley, S. D. (2002). Alleli naturali in un locus del tratto quantitativo delle dimensioni della frutta di pomodoro differiscono da mutazioni regolatrici eterocrone. Proc. Natl. Acad. Sci. U.S.A. 99, 13606-13611. doi: 10.1073/pnas.172520999
PubMed Abstract | CrossRef Full Text | Google Scholar
Conway, L. J., and Poethig, R. S. (1997). Mutazioni di Arabidopsis thaliana che trasformano le foglie in cotiledoni. Proc. Natl. Acad. Sci. U.S.A. 94, 10209-10214. doi: 10.1073/pnas.94.19.10209
PubMed Abstract | CrossRef Full Text | Google Scholar
Costa, M. M. R., Yang, S., Critchley, J., Feng, X., Wilson, Y., Langlade, N., et al. La base genetica per la variazione naturale in eteroblastica in Antirrhinum. New Phytol. 196, 1251-1259. doi: 10.1111/j.1469-8137.2012.04347.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Cronk, Q. C. B., Needham, I., and Rudall, P. J. (2015). Evoluzione degli amenti: morfologia dell’infiorescenza di Salicaceae selezionate in un contesto evolutivo e di sviluppo. Front. Plant Sci. 6:1030. doi: 10.3389/fpls.2015.01030
PubMed Abstract | CrossRef Full Text | Google Scholar
Czesnick, H., e Lenhard, M. (2015). Controllo delle dimensioni nelle piante – lezioni da foglie e fiori. Cold Spring Harb. Perspect. Biol. 7:a019190. doi: 10.1101/cshperspect.a019190
PubMed Abstract | CrossRef Full Text | Google Scholar
Das Gupta, M., e Nath, U. (2015). Divergenza nei modelli di polarità di crescita della foglia è associato con la divergenza di espressione di miR396. Plant Cell 27, 2785-2799. doi: 10.1105/tpc.15.00196
PubMed Abstract | CrossRef Full Text | Google Scholar
De Beer, G. R. (1951). Embrioni e antenati. Oxford: Clarendon Press.
Google Scholar
Donnelly, P. M., Bonetta, D., Tsukaya, H., Dengler, R. E., and Dengler, N. G. (1999). Ciclo cellulare e allargamento delle cellule nelle foglie in via di sviluppo di Arabidopsis. Dev. Biol. 215, 407-419. doi: 10.1006/dbio.1999.9443
PubMed Abstract | CrossRef Full Text | Google Scholar
Efroni, I., Blum, E., Goldshmidt, A., e Eshed, Y. (2008). Un programma di maturazione prolungato e dinamico è alla base dello sviluppo delle foglie di Arabidopsis. Plant Cell 20, 2293-2306. doi: 10.1105/tpc.107.057521
PubMed Abstract | CrossRef Full Text | Google Scholar
Fahlgren, N., Montgomery, T. A., Howell, M. D., Allen, E., Dvorak, S. K., Alexander, A. L., et al. (2006). Regolazione di AUXIN RESPONSE FACTOR3 da TAS3 ta-siRNA influenza il tempo di sviluppo e Patterning in Arabidopsis. Curr. Biol. 16, 939-944. doi: 10.1016/j.cub.2006.03.065
PubMed Abstract | CrossRef Full Text | Google Scholar
Fernandez, D. E. (1997). Basi di sviluppo dell’omeosi negli embrioni di Brassica napus a germinazione precoce: cambiamento di fase all’apice del germoglio. Development 124, 1149-1157.
PubMed Abstract | Google Scholar
Friedman, W. E. (1999). Espressione del ciclo cellulare nello sperma di Arabidopsis: implicazioni per la comprensione dei modelli di gametogenesi e fecondazione nelle piante e in altri eucarioti. Development 126, 1065-1075.
PubMed Abstract | Google Scholar
Friedman, W. E., and Carmichael, J. S. (1998). Eterocronia e innovazione dello sviluppo: evoluzione dell’ontogenesi del gametofito femminile nel gnetum, una pianta da seme altamente apomorfa. Evolution 52, 1016-1030. doi: 10.1111/j.1558-5646.1998.tb01830.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Geuten, K., and Coenen, H. (2013). Geni eterocroni nell’evoluzione e nello sviluppo delle piante. Front. Plant Sci. 4:381. doi: 10.3389/fpls.2013.00381
PubMed Abstract | CrossRef Full Text | Google Scholar
Gillmor, C. S., Silva-Ortega, C. O., Willmann, M. R., Buendía-Monreal, M., e Poethig, R. S. (2014). I geni del modulo Mediator CDK8 di Arabidopsis CCT (MED12) e GCT (MED13) sono regolatori globali delle transizioni di fase dello sviluppo. Sviluppo 141, 4580-4589. doi: 10.1242/dev.111229
PubMed Abstract | CrossRef Full Text | Google Scholar
Goebel, K. (1908). Einleitung in die Experimentelle Morphologie der Pflanzen. Leipzig: B.G. Teubner.
Google Scholar
Gould, S. J. (1977). Ontogenesi e filogenesi. Cambridge, MA: Harvard University Press.
Google Scholar
Guo, C., Xu, Y., Shi, M., Lai, Y., Wu, X., Wang, H., et al. (2017). Repressione di miR156 da miR159 regola la tempistica della transizione giovanile-adulto in Arabidopsis. Plant Cell 29, 1293-1304. doi: 10.1105/tpc.16.00975
PubMed Abstract | CrossRef Full Text | Google Scholar
Guo, J. (2015). Meccanismi per l’evoluzione dei sepali complessi e diversamente elaborati in Iris identificati dall’analisi comparativa delle sequenze di sviluppo. Am. J. Bot. 102, 819-832. doi: 10.3732/ajb.1400519
PubMed Abstract | CrossRef Full Text | Google Scholar
Haeckel, E. (1875). Die Gastrula und die Eifurchung der Thiere. Jena. Z. Naturwiss. 9, 402-508.
Google Scholar
Harrison, C. J. (2017). Sviluppo e genetica nell’evoluzione dei piani del corpo delle piante terrestri. Philos. Trans. R. Soc. B Biol. Sci. 372:20150490. doi: 10.1098/rstb.2015.0490
PubMed Abstract | CrossRef Full Text | Google Scholar
Harrison, C. J., and Morris, J. L. (2018). L’origine e la prima evoluzione dei germogli e delle foglie delle piante vascolari. Philos. Trans. R. Soc. B Biol. Sci. 373:20160496. doi: 10.1098/rstb.2016.0496
PubMed Abstract | CrossRef Full Text | Google Scholar
He, J., Xu, M., Willmann, M. R., Mccormick, K., Hu, T., Yang, L., et al. (2018). Soglia-dipendente repressione dell’espressione del gene SPL da miR156/miR157 controlla il cambiamento di fase vegetativa in Arabidopsis thaliana. PLoS Genet. 14:e1007337. doi: 10.1371/journal.pgen.1007337
PubMed Abstract | CrossRef Full Text | Google Scholar
Hudson, C. J., Freeman, J. S., Jones, R. C., Potts, B. M., Wong, M. M. L., Weller, J. L., et al. (2014). Controllo genetico dell’eterocronia in Eucalyptus globulus. G3 4, 1235-1245. doi: 10.1534/g3.114.011916
PubMed Abstract | CrossRef Full Text | Google Scholar
Huijser, P., e Schmid, M. (2011). Il controllo delle transizioni di fase dello sviluppo nelle piante. Sviluppo 138, 4117-4129. doi: 10.1242/dev.063511
PubMed Abstract | CrossRef Full Text | Google Scholar
Hunter, C., Sun, H., e Poethig, R. S. (2003). Il gene eterocronico ZIPPY dell’Arabidopsis è un membro della famiglia ARGONAUTE. Curr. Biol. 13, 1734-1739. doi: 10.1016/j.cub.2003.09.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Hunter, C., Willmann, M. R., Wu, G., Yoshikawa, M., de la Luz Gutiérrez-Nava, M., e Poethig, R. S. (2006). La repressione mediata da siRNA di ETTIN e ARF4 regola l’eteroblastia in Arabidopsis. Sviluppo 133, 2973-2981. doi: 10.1242/dev.02491
PubMed Abstract | CrossRef Full Text | Google Scholar
Jia, X. L., Chen, Y. K., Xu, X. Z., Shen, F., Zheng, Q. B., Du, Z., et al. (2017). miR156 interruttori sul cambiamento di fase vegetativa sotto la regolazione dei segnali redox in piantine di mele. Sci. Rep. 7, 1-13. doi: 10.1038/s41598-017-14671-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Kenrick, P., e Crane, P. R. (1997). L’origine e la prima evoluzione delle piante sulla terraferma. Natura 389, 33-39. doi: 10.1038/37918
CrossRef Full Text | Google Scholar
Keyte, A. L., and Smith, K. K. (2014). Eterocronia e meccanismi di temporizzazione dello sviluppo: cambiare ontogenesi nell’evoluzione. Semin. Cell Dev. Biol. 34, 99-107. doi: 10.1016/j.semcdb.2014.06.015
PubMed Abstract | CrossRef Full Text | Google Scholar
Kim, J. Y., Oh, J. E., Noh, Y. S., and Noh, B. (2015). Controllo epigenetico della transizione di fase da giovanile ad adulto da parte del complesso SAGA-like di Arabidopsis. Plant J. 83, 537-545. doi: 10.1111/tpj.12908
PubMed Abstract | CrossRef Full Text | Google Scholar
Kostyun, J. L., Preston, J. C., e Moyle, L. C. (2017). I turni di sviluppo eterocronici sottendono la diversità floreale all’interno di Jaltomata ( Solanaceae ). Evodevo 8:17. doi: 10.1186/s13227-017-0080-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Kyozuka, J., Tokunaga, H., e Yoshida, A. (2014). Controllo della forma dell’infiorescenza dell’erba dal fine-tuning del cambiamento di fase del meristema. Curr. Opin. Plant Biol. 17, 110-115. doi: 10.1016/j.pbi.2013.11.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Lemmon, Z. H., Park, S. J., Jiang, K., Van Eck, J., Schatz, M. C., e Lippman, Z. B. (2016). L’evoluzione della diversità delle infiorescenze nei nightshades e l’eterocronia durante la maturazione del meristema. Genome Res. 26, 1676-1686. doi: 10.1101/gr.207837.116
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, J., Wang, Z., Hu, Y., Cao, Y., e Ma, L. (2017). Le proteine del gruppo Polycomb RING1A e RING1B regolano la transizione di fase vegetativa in Arabidopsis. Front. Plant Sci. 8:867. doi: 10.3389/fpls.2017.00867
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, P., and Johnston, M. O. (2000). Eterocronia negli studi evolutivi delle piante attraverso il ventesimo secolo. Bot. Rev. 66, 57-88. doi: 10.1007/BF02857782
CrossRef Full Text | Google Scholar
Li, S., Liu, L., Zhuang, X., Yu, Y., Liu, X., Cui, X., et al. MicroRNA inibiscono la traduzione di mRNA bersaglio sul reticolo endoplasmatico in Arabidopsis. Cell 153, 562-574. doi: 10.1016/j.cell.2013.04.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Lippman, Z. B., Cohen, O., Alvarez, J. P., Abu-Abied, M., Pekker, I., Paran, I., et al. La fabbricazione di un’infiorescenza composta nel pomodoro e nei relativi nightshades. PLoS Biol. 6:e288. doi: 10.1371/journal.pbio.0060288
PubMed Abstract | CrossRef Full Text | Google Scholar
Lord, E. M., e Hill, J. P. (1987). “Evidence for heterochrony in the evolution of plant form”, in Development as an Evolutionary Process, eds R. A. Raff and E. C. Raff (New York, NY: Alan R. Liss), 47-70.
Google Scholar
Maugarny-Calés, A., and Laufs, P. (2018). Mettere in forma le foglie: una visione molecolare, cellulare, ambientale ed evolutiva. Development 145:dev161646. doi: 10.1242/dev.161646
PubMed Abstract | CrossRef Full Text | Google Scholar
Meinke, D. W. (1992). Un mutante omoetico di Arabidopsis thaliana con cotiledoni fogliosi. Scienza 258, 1647-1649. doi: 10.1126/science.258.5088.1647
PubMed Abstract | CrossRef Full Text | Google Scholar
Naghiloo, S., e Claßen-Bockhoff, R. (2017). I cambiamenti di sviluppo nel tempo e nello spazio promuovono la diversificazione evolutiva dei fiori: un caso di studio in Dipsacoideae. Front. Plant Sci. 8:1665. doi: 10.3389/fpls.2017.01665
PubMed Abstract | CrossRef Full Text | Google Scholar
Nikolov, L. A., Tomlinson, P. B., Manickam, S., Endress, P. K., Kramer, E. M., e Davis, C. C. (2014). Rafflesiaceae oloparassiti possiedono gli endofiti più ridotti e tuttavia danno origine ai fiori più grandi del mondo. Ann. Bot. 114, 233-242. doi: 10.1093/aob/mcu114
PubMed Abstract | CrossRef Full Text | Google Scholar
Nodine, M. D., e Bartel, D. P. (2010). MicroRNAs prevenire l’espressione genica precoce e consentire la formazione di modelli durante l’embriogenesi delle piante. Genes Dev. 24, 2678-2692. doi: 10.1101/gad.1986710
PubMed Abstract | CrossRef Full Text | Google Scholar
Ojeda, D. I., Jaén-Molina, R., Santos-Guerra, A., Caujape-Castells, J., e Cronk, Q. (2017). Temporali, ma non spaziali, cambiamenti nei modelli di espressione dei geni di identità petali sono associati con la perdita di cellule coniche papillate e il passaggio all’impollinazione degli uccelli in Lotus Macaronesian (Leguminosae). Plant Biol. 19, 420-427. doi: 10.1111/plb.12551
PubMed Abstract | CrossRef Full Text | Google Scholar
Park, S. J., Jiang, K., Schatz, M. C., and Lippman, Z. B. (2012). Tasso di maturazione meristematica determina architettura infiorescenza in pomodoro. Proc. Natl. Acad. Sci. U.S.A. 109, 639-644. doi: 10.1073/pnas.1114963109
PubMed Abstract | CrossRef Full Text | Google Scholar
Peragine, A., Yoshikawa, M., Wu, G., Albrecht, H. L., e Poethig, R. S. (2004). SGS3 e SGS2/SDE1/RDR6 sono richiesti per lo sviluppo giovanile e la produzione di si RNA trans-agenti in Arabidopsis. Genes Dev. 18, 2368-2379. doi: 10.1101/gad.1231804.nism
CrossRef Full Text | Google Scholar
Pham, T., Day, S. M., Glassford, W. J., Williams, T. M., and Rebeiz, M. (2017). L’origine evolutiva di un nuovo modello di espressione attraverso uno spostamento eterocronico estremo. Evol. Dev. 19, 43-55. doi: 10.1111/ede.12215
PubMed Abstract | CrossRef Full Text | Google Scholar
Pires, N. D., and Dolan, L. (2012). Evoluzione morfologica nelle piante terrestri: nuovi disegni con vecchi geni. Philos. Trans. R. Soc. B Biol. Sci. 367, 508-518. doi: 10.1098/rstb.2011.0252
PubMed Abstract | CrossRef Full Text | Google Scholar
Poethig, R. S. (2013). Cambio di fase vegetativa e maturazione del germoglio nelle piante, 1st Edn. New York, NY: Elsevier Inc. doi: 10.1016/B978-0-12-396968-2.00005-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Porras, R., and Muñoz, J. M. (2000). Capitello cleistogamo in Centaurea (Asteraceae): origine eterocrona. Am. J. Bot. 87, 925-933. doi: 10.2307/2656991
PubMed Abstract | CrossRef Full Text | Google Scholar
Pryer, K. M., and Hearn, D. J. (2009). Evoluzione della forma della foglia in felci marsileacee: prove di eterocronia. Evolution 63, 498-513. doi: 10.1111/j.1558-5646.2008.00562.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Ronse de Craene, L. (2018). Comprendere il ruolo dello sviluppo floreale nell’evoluzione dei fiori delle angiosperme: chiarimenti da una prospettiva storica e fisico-dinamica. J. Plant Res. 131, 367-393. doi: 10.1007/s10265-018-1021-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Rothwell, G. W., Wyatt, S. E., and Tomescu, A. M. F. (2014). L’evoluzione delle piante all’interfaccia della paleontologia e della biologia dello sviluppo: un paradigma centrato sull’organismo. Am. J. Bot. 101, 899-913. doi: 10.3732/ajb.1300451
PubMed Abstract | CrossRef Full Text | Google Scholar
Sablowski, R. (2016). Coordinamento della crescita e della divisione delle cellule vegetali: controllo collettivo o accordo reciproco? Curr. Opin. Plant Biol. 34, 54-60. doi: 10.1016/j.pbi.2016.09.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Sablowski, R., e Carnier Dornelas, M. (2014). Interazione tra crescita cellulare e ciclo cellulare nelle piante. J. Exp. Bot. 65, 2703-2714. doi: 10.1093/jxb/ert354
PubMed Abstract | CrossRef Full Text | Google Scholar
Sharbel, T. F., Voigt, M. L., Corral, J. M., Galla, G., Kumlehn, J., Klukas, C., et al. (2010). Gli ovuli apomittici e sessuali di Boechera mostrano modelli di espressione genica globale eterocrona. Plant Cell 22, 655-671. doi: 10.1105/tpc.109.072223
PubMed Abstract | CrossRef Full Text | Google Scholar
Smith, K. K. (2002). Eterocronia di sequenza e l’evoluzione dello sviluppo. J. Morphol. 252, 82-97. doi: 10.1002/jmor.10014
PubMed Abstract | CrossRef Full Text | Google Scholar
Smith, K. K. (2003). Tempo ‘s freccia: heterochrony e l’evoluzione dello sviluppo. Int. J. Dev. Biol. 47, 613-621.
Google Scholar
Stone, S. L., Braybrook, S. A., Paula, S. L., Kwong, L. W., Meuser, J., Pelletier, J., et al. Arabidopsis leafy cotyledon2 induce tratti di maturazione e attività di auxina: implicazioni per l’embriogenesi somatica. Proc. Natl. Acad. Sci. U.S.A. 105, 3151-3156. doi: 10.1073/pnas.0712364105
PubMed Abstract | CrossRef Full Text | Google Scholar
Sun, B., Looi, L. S., Guo, S., He, Z., Gan, E. S., Huang, J., et al. (2014). Meccanismo di temporizzazione dipendente dalla divisione cellulare è invocato da Polycomb eviction in cellule staminali vegetali. Scienza 343:1248559. doi: 10.1126/science.1248559
PubMed Abstract | CrossRef Full Text | Google Scholar
Tian, H. Q., Yuan, T., e Russell, S. D. (2005). Relazione tra la doppia fecondazione e il ciclo cellulare nei gameti maschili e femminili del tabacco. Sesso. Pianta Reprod. 17, 243-252. doi: 10.1007/s00497-004-0233-9
CrossRef Full Text | Google Scholar
Tomescu, A. M. F., Wyatt, S. E., Hasebe, M., e Rothwell, G. W. (2014). Evoluzione precoce del piano del corpo delle piante vascolari – i meccanismi mancanti. Curr. Opin. Plant Biol. 17, 126-136. doi: 10.1016/j.pbi.2013.11.016
PubMed Abstract | CrossRef Full Text | Google Scholar
Tsai, A. Y.-L., e Gazzarrini, S. (2014). Trealosio-6-fosfato e chinasi SnRK1 nello sviluppo e nella segnalazione delle piante: il quadro emergente. Front. Plant Sci. 5:119. doi: 10.3389/fpls.2014.00119
PubMed Abstract | CrossRef Full Text | Google Scholar
Vasconcelos, T. N. C., Lucas, E. J., Faria, J. E. Q., e Prenner, G. (2018). L’eterocronia floreale promuove la flessibilità delle strategie riproduttive nel genere morfologicamente omogeneo Eugenia (Myrtaceae). Ann. Bot. 121, 161-174. doi: 10.1093/aob/mcx142
PubMed Abstract | CrossRef Full Text | Google Scholar
Wahl, V., Ponnu, J., Schlereth, A., Arrivault, S., Langenecker, T., Franke, A., et al. (2013). Regolazione della fioritura da trealosio-6-fosfato segnalazione in Arabidopsis thaliana. Scienza 339, 704-707. doi: 10.1126/science.1230406
PubMed Abstract | CrossRef Full Text | Google Scholar
Walcher-Chevillet, C. L., e Kramer, E. M. (2016). Rompere lo stampo: capire l’evoluzione e lo sviluppo degli organi laterali in diversi modelli di piante. Curr. Opin. Genet. Dev. 39, 79-84. doi: 10.1016/j.gde.2016.06.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, J., Czech, B., and Weigel, D. (2009). miR156-regolato SPL fattori di trascrizione definire un percorso endogeno fioritura in Arabidopsis thaliana. Cell 138, 738-749. doi: 10.1016/j.cell.2009.06.014
PubMed Abstract | CrossRef Full Text | Google Scholar
Willmann, M. R., Mehalick, A. J., Packer, R. L., e Jenik, P. D. (2011). I microRNA regolano i tempi di maturazione dell’embrione in Arabidopsis. Plant Physiol. 155, 1871-1884. doi: 10.1104/pp.110.171355
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, G., Park, M. Y., Conway, S. R., Wang, J., Weigel, D., e Poethig, R. S. (2009). L’azione sequenziale di miR156 e miR172 regola i tempi di sviluppo in Arabidopsis. Cell 138, 750-759. doi: 10.1016/j.cell.2009.06.031
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, G., e Poethig, R. S. (2006). Regolazione temporale dello sviluppo del germoglio in Arabidopsis thaliana da miR156 e il suo bersaglio SPL3. Sviluppo 133, 3539-3547. doi: 10.1242/dev.02521
PubMed Abstract | CrossRef Full Text | Google Scholar
Xu, M., Hu, T., Smith, M. R., e Poethig, R. S. (2016). Regolazione epigenetica del cambiamento di fase vegetativa in Arabidopsis. Plant Cell 28, 28-41. doi: 10.1105/tpc.15.00854
PubMed Abstract | CrossRef Full Text | Google Scholar
Xu, Y., Guo, C., Zhou, B., Li, C., Wang, H., Zheng, B., et al. (2016). Regolazione del cambiamento di fase vegetativa da SWI2/SNF2 cromatina rimodellamento ATPasi BRAHMA. Plant Physiol. 172, 2416-2428. doi: 10.1104/pp.16.01588
PubMed Abstract | CrossRef Full Text | Google Scholar
Xu, M., Leichty, A. R., Hu, T., and Poethig, R. S. (2018). H2A.Z promuove la trascrizione di MIR156A e MIR156C in Arabidopsis facilitando la deposizione di H3K4me3. Development 145:dev.152868. doi: 10.1242/dev.152868
PubMed Abstract | CrossRef Full Text | Google Scholar
Yamaguchi, N., Huang, J., Xu, Y., Tanoi, K., and Ito, T. (2017). Fine-tuning dell’omeostasi dell’auxina governa la transizione dal mantenimento delle cellule staminali floreali alla formazione del gineceo. Nat. Commun. 8:1125. doi: 10.1038/s41467-017-01252-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, L., Xu, M., Koo, Y., He, J., e Poethig, R. S. (2013). Lo zucchero promuove il cambiamento di fase vegetativa in Arabidopsis thaliana reprimendo l’espressione di MIR156A e MIR156C. eLife 2: e00260. doi: 10.7554/eLife.00260
PubMed Abstract | Google Scholar | CrossRef Full Text
Yu, S., Li, C., Zhou, C. M., Zhang, T. Q., Lian, H., Sun, Y., et al. (2013). Lo zucchero è un indizio endogeno per giovanile-to-adulto transizione di fase nelle piante. eLife 2: e00269. doi: 10.7554/eLife.00269
PubMed Abstract | CrossRef Full Text | Google Scholar
Yu, S., Zhang, Y., Horrer, D., Zhang, T., Hao, Y., Feng, Y., et al. Gibberellina regola la transizione floreale Arabidopsis attraverso miR156-targeted SQUAMOSA promotore di legame – come fattori di trascrizione. Plant Cell 24, 3320-3332. doi: 10.1105/tpc.112.101014
PubMed Abstract | CrossRef Full Text | Google Scholar
Leave a Reply