Frontiers in Pharmacology
Introduzione
Il tipo più comune di demenza, il morbo di Alzheimer (AD), è accompagnato da un deterioramento cronico della funzione cognitiva e rappresenta il 60-70% dei casi di demenza (Fan e Chiu, 2014; Lu et al., 2018). Secondo una revisione del 2014, circa 35,6 milioni di persone soffrono di AD attualmente, e l’incidenza di AD sta progressivamente aumentando con l’età e colpisce circa 115,4 milioni di persone entro l’anno 2050 in tutto il mondo (Fan e Chiu, 2014). È generalmente accettato che l’AD è una complicata malattia neurodegenerativa di molteplici patologie, che principalmente associate alla degenerazione della trasmissione colinergica, allo stress ossidativo, alla neuroinfiammazione, e così via (Coyle et al., 1983; Aucoin et al., 2005; Lin e Beal, 2006; Verri et al., 2012; Heneka et al., 2015; Bassani et al., 2017). Gli inibitori dell’acetilcolinesterasi (AChE), come il donepezil, la rivastigmina e la galantamina, sono prescritti di preferenza per il trattamento clinico del MA nelle fasi iniziali (Kwon et al., 2010; Rijpma et al., 2014; Kumar e Singh, 2015). Inoltre, gli antiossidanti e gli agenti antinfiammatori sono anche proverbialmente utilizzati nella terapia adiuvante del MA (Zhou et al., 2016; Demirci et al., 2017). Tuttavia, tutti questi agenti esercitano un’efficacia limitata a causa della perdita di efficacia gradualmente con il progredire della malattia, e i farmaci sono anche associati a molti effetti collaterali tossici (Zhou et al., 2016; Jeon et al., 2017; Lu et al., 2018). Vale a dire, non esiste attualmente un trattamento soddisfacente disponibile per curare il MA o per alterare il suo corso progressivo.
Harmaline (HAL) e harmine (HAR) sono gli abbondanti alcaloidi farmacologici β-carboline di Peganum harmala L. con strutture chimiche simili (Li et al., 2017b). Possiedono una significativa attività inibitoria di AChE, monoamino ossidasi (MAO) e mieloperossidasi (MPO), effetti antiossidanti, antinfiammatori, antitumorali e anti-ipertensione, e possono anche influenzare il contenuto di vari neurotrasmettitori quindi possono portare a cambiamenti biochimici, fisiologici e comportamentali in animali ed esseri umani (Mahmoudian et al, 2002; Frison et al., 2008; Jiménez et al., 2008; Herraiz et al., 2010; Louis et al., 2010; Bensalem et al., 2014; Wang et al., 2015; Li et al., 2017a). Secondo i nostri studi precedenti, HAL e HAR hanno mostrato un’inibizione AChE simile rispetto alla galantamina in vitro (Zhao et al., 2013). Inoltre, gli alcaloidi totali (28 mg/kg) di P. harmala contengono principalmente HAL e HAR hanno esibito l’effetto migliorativo sui deficit di apprendimento e memoria indotti da scopolamina e etanolo al 30% (He et al., 2015b). Successivamente, lo studio di He et al. (2015a) ha ulteriormente confermato che HAR (20 mg/kg) potrebbe migliorare la memoria compromessa dei topi indotti da scopolamina attraverso il miglioramento delle funzioni colinergiche attraverso l’inibizione di AChE. Tuttavia, la ricerca più recente ha indicato che HAR non era solo un substrato di multidrug resistance-associated protein isoform 2 (MRP2), ma aveva anche una debole stabilità metabolica, e alla fine ha portato a una biodisponibilità sostanzialmente inferiore a quella di HAL in diversi animali (Li et al., 2017b). Pertanto, si ipotizza che il dosaggio efficace di HAL contro l’AD possa essere molto più basso di HAR. Pertanto, uno studio di confronto sistematico sugli effetti anti-amnesici e sui meccanismi dei due analoghi dovrebbe essere condotto per cercare un composto candidato preferibile per la terapia di AD.
Nello studio attuale, gli effetti modulatori di HAL e HAR sulle compromissioni della memoria indotte dalla scopolamina sono stati confrontati utilizzando la valutazione comportamentale nel Morris water maze (MWM). MWM è stato ampiamente utilizzato nello studio della neurobiologia e neurofarmacologia di apprendimento spaziale e la memoria, e che svolge un ruolo importante nella convalida dei modelli di roditori per i disturbi neurocognitivi come AD (Bromley-Brits et al., 2011). Inoltre, i saggi biochimici, il western blotting e l’analisi di immunofluorescenza sono stati eseguiti in modo completo per chiarire i possibili effetti di HAL e HAR su alcuni meccanismi sottostanti coinvolti nelle progressioni di AD. I risultati del presente studio saranno utili per valutare gli effetti anti-amnesici degli alcaloidi β-carboline in ulteriori ricerche e sviluppi, e potrebbero fornire informazioni preziose per il trattamento clinico del MA.
Materiali e metodi
Materiali
Harmalina, HAR, L-triptofano (L-Trp), 5-idrossitriptamina (5-HT), acido 5-idrossindolo-3-acetico (5-HIAA), cloruro di acetilcolina (ACh), cloruro di colina (Ch), acido γ-amminobutirrico (γ-GABA), acido L-glutammico sale monosodico monoidrato (L-Glu), L-fenilalanina (L-Phe), L-tirosina (L-Tyr), teofillina e tutte le altre sostanze chimiche utilizzate sono state acquistate da Sigma-Aldrich, Co., Ltd. (St. Louis, MO, Stati Uniti). Scopolamina hydrobromide e donepezil cloridrato monoidrato sono stati acquistati da TCI (Shanghai) Development, Co. (Shanghai, Cina). La carbossimetilcellulosa sodica (CMC-Na) e l’NaCl sono stati ottenuti dalla Meilunbio® Biotech, Co. (Dalian, Cina). Il colorante composto biossido di titanio è stato acquistato da Shanghai Dyestuffs Research Institute, Co. Ltd. (Shanghai, Cina). Il kit di quantificazione delle proteine BCA, tampone di lisi RIPA, sieroalbumina bovina (BSA), PBST (10X), 30% di ammide acrilica, 10% SDS, glicina, tampone di caricamento del campione (4X) e TEMED sono stati acquistati da YEASEN Biotechnology, Co. Ltd. (Shanghai, Cina). L’inibitore della fosfolipasi e l’inibitore della proteasi sono stati acquistati da Roche Applied Science (Foster City, CA, Stati Uniti). La membrana PVDF e il substrato ImmobilonTM Western chemiluminescente HRP sono stati acquistati da Millipore (Billerica, MA, Stati Uniti). Coniglio anti-AChE, coniglio anti-colina acetiltransferasi (ChAT), coniglio anti-MPO e anti-gliceraldeide 3-fosfato deidrogenasi (GAPDH), anticorpi anti-rabbit IgG coniugati con HRP e marker sono stati acquistati da Abcam Technology (Cambridge, MA, Stati Uniti). Acetonitrile, metanolo e acido formico di grado HPLC sono stati acquistati da Fisher Scientific, Co. (Santa Clara, CA, Stati Uniti). L’acqua deionizzata (>18 mΩ) è stata purificata da Milli-Q Academic System (Millipore, Corp., Billerica, MA, Stati Uniti). Tutte le altre sostanze chimiche erano di grado analitico.
Animali
Cento otto topi maschi C57BL/6 (di 10 settimane) sono stati ottenuti dalla valutazione della sicurezza dei farmaci e dal centro di ricerca dell’Università di Shanghai di medicina tradizionale cinese. I topi sono stati allevati in una stanza ben illuminata con aria condizionata (25 ± 1 ° C) in condizioni ambientali standard (umidità relativa: 60-65%, 12 h cicli luce-buio: luce accesa dalle 7:00 alle 19:00) e dato libero accesso al cibo per roditori e acqua di rubinetto. Tutte le procedure di utilizzo degli animali sono state in conformità con i regolamenti per la sperimentazione animale rilasciato dal Comitato di Stato della Scienza e della Tecnologia della Cina il 14 novembre 1988 e approvato dal Comitato etico sperimentale degli animali di Shanghai University of Traditional Chinese Medicine (No. SUTCM-2011-1107; Data di approvazione: 10 novembre, 2011).
Somministrazione del farmaco
In base alla differenza nella biodisponibilità di HAL e HAR, i dosaggi sono stati fissati a 2, 5, e 10 mg/kg per HAL, e 10, 20, e 30 mg/kg per HAR (Zhang, 2013; Shi et al, 2014). Centottanta topi sono stati divisi a caso in nove gruppi (12 topi per gruppo), vale a dire, gruppo di controllo (veicolo, 0,5% CMC-Na), gruppo scopolamina (1 mg/kg), gruppo donepezil (controllo positivo, 5 mg/kg), gruppi HAL (2, 5, e 10 mg/kg, cioè basso: L, medio: M, e alto: H dosaggi), e gruppi HAR (10, 20, e 30 mg/kg, cioè L, M, e H dosaggi). Come mostrato nella Figura 1, prima del test MWM, i gruppi di controllo e scopolamina sono stati somministrati per via orale con 0,5% CMC-Na soluzione, e HAL (L, M, e H dosaggi), HAR (L, M, e H dosaggi) e donepezil (5 mg / kg) gruppi sono stati somministrati tramite gavage per sette giorni consecutivi. Dal giorno 8 al giorno 16, scopolamina (1 mg / kg) è stato iniettato per via intraperitoneale (i.p.) a tutti i gruppi tranne il gruppo di controllo che ha ricevuto normale soluzione salina 30 min dopo i vari trattamenti. Successivamente, i test comportamentali sono stati eseguiti ogni giorno 30 minuti dopo l’iniezione i.p. di scopolamina o di soluzione fisiologica normale.
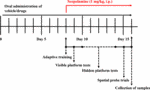
FIGURA 1. Il calendario dei disegni sperimentali e di trattamento dei topi.
Valutazione comportamentale in Morris Water Maze
Il test MWM è stato applicato per valutare gli effetti di HAL e HAR su topi apprendimento spaziale e memoria come precedentemente descritto da Richard Morris nel 1982 con piccole modifiche (Morris et al, 1982; He et al., 2015a; Singh et al., 2016).
L’attrezzatura MWM consisteva in una vasca d’acqua circolare bianca (diametro: 120 cm e altezza: 50 cm) circondata da vari spunti visivi (stella, quadrato, rettangolo e cerchio, ecc.) sui pilastri in posizione fissa durante l’intero esperimento. La vasca è stata sbiancata con l’aggiunta di un colorante non tossico, composto di biossido di titanio, a 22 ± 2°C in modo che la piattaforma fosse invisibile sotto la superficie dell’acqua. La vasca è stata virtualmente separata in quattro quadranti uguali, tra cui il sud-est, nord-est, sud-ovest e nord-ovest. Una piattaforma bianca (diametro: 10 cm e altezza: 25 cm) era centrata nel quadrante sud-ovest (Jeon et al., 2017; Kouémou et al., 2017; Lu et al., 2018). L’intera procedura sperimentale era composta da addestramento adattivo (1 giorno, una volta al giorno), test della piattaforma visibile (1 giorno, quattro prove al giorno), test della piattaforma nascosta (5 giorni, quattro prove al giorno), e prova della sonda spaziale (24 h dopo l’ultimo test della piattaforma nascosta, una volta al giorno).
Per l’addestramento adattivo (1 giorno, una volta al giorno), il primo giorno del test MWM (giorno 8 dei trattamenti farmacologici), ogni topo è stato posto all’interno del serbatoio dell’acqua per nuotare per 60 s per ricevere una sessione di acclimatazione. Il giorno successivo (giorno 9 dei trattamenti farmacologici), al fine di indagare la visuale, sensoriale e motoria dei topi, la piattaforma visibile è stata posizionata 1 cm sopra la superficie dell’acqua, e ogni topo è stato permesso di trovare la piattaforma in 60 s. Il test (1 giorno, quattro prove al giorno) è stato eseguito prima della prova piattaforma nascosta per selezionare i topi qualificati. Successivamente, la piattaforma è stata immersa 1 cm sotto la superficie dell’acqua in prove di piattaforma nascosta (5 giorni, quattro prove al giorno, giorni 10-14 di trattamenti farmacologici). L’attività di nuoto è stata registrata da una videocamera sopraelevata e analizzata tramite un sistema computerizzato di monitoraggio e analizzatore di immagini (RD1101-MWM-G, Shanghai Mobile Datum Information Technology Company, Shanghai, Cina). I topi sono stati rilasciati nel serbatoio con la testa rivolta verso la parete del serbatoio da uno dei quattro quadranti in successione (il nord-est, nord, est e sud-est) e ha permesso di trovare la piattaforma in 60 s. Se il mouse non è riuscito a individuare la piattaforma, dovrebbe essere delicatamente guidato dallo sperimentatore specifico, e ha permesso di rimanere per 15 s nella piattaforma. Dopo ogni prova, ogni topo è stato portato nella sua gabbia e lasciato asciugare sotto un riscaldatore. La latenza di fuga e il tasso di fuga sono stati registrati per ogni prova. Nella prova della sonda spaziale (giorno 15 dei trattamenti farmacologici), la piattaforma è stata rimossa dal serbatoio. Ogni topo è stato messo nel serbatoio dell’acqua dal quadrante (per l’istante, il nord-ovest) opposto dalla posizione precedente piattaforma (quadrante di destinazione) per ricevere 60 s test di ritenzione della memoria (Lee et al., 2016; Liu et al., 2017; Malik et al., 2017). Il tempo nel quadrante di destinazione e il numero di attraversamento sono stati registrati.
Raccolta di tessuti cerebrali
Il 16° giorno dopo i trattamenti farmacologici, tutti i topi sono stati anestetizzati e il plasma è stato raccolto da oftalmectomia, e poi i tessuti cerebrali sono stati raccolti dopo la decapitazione. In ogni gruppo, i cervelli di un sottoinsieme di animali sono stati utilizzati per l’analisi di immunofluorescenza e gli altri per l’analisi biochimica e western blotting. Dopo i sacrifici, i tessuti cerebrali sono stati escissi immediatamente, sciacquati con soluzione fisiologica normale, tamponato l’umidità superficiale dell’acqua con carta da filtro, e pesati. La corteccia e l’ippocampo di ogni cervello sono stati divisi in due parti (sinistra e destra) su ghiaccio, rispettivamente. Alcuni di essi sono stati fissati con paraformaldeide 4% per l’analisi di immunofluorescenza, e gli altri sono stati congelati immediatamente da azoto liquido e poi conservati a -80 ° C fino all’analisi.
Saggio biochimico
La corteccia e l’ippocampo sono stati omogeneizzati nel ghiaccio 0. 1 M tampone fosfato (0.1 M tampone fosfato (pH 7.4), e gli omogenati al 10% (w/v) sono stati centrifugati a 4°C a 12.000 rpm per 10 min, e i surnatanti sono stati separati e poi conservati a -80°C per la stima biochimica (Malik et al, 2017). I livelli di AChE, ChAT, superossido dismutasi (SOD), glutatione perossidasi (GSH-px), diadeide maleica (MDA), MPO, fattore di necrosi tumorale α (TNF-α), interleuchina 1β (IL-1β), interleuchina 6 (IL-6), interleuchina 10 (IL-10) e ossido nitrico (NO) negli omogenati della corteccia cerebrale e/o dell’ippocampo sono stati determinati tramite ELISA utilizzando kit di analisi disponibili in commercio (Jiancheng, Nanjing, Cina) secondo i protocolli del produttore. In particolare, i livelli dei suddetti fattori biochimici nella corteccia cerebrale e nell’ippocampo sono stati normalizzati utilizzando la concentrazione proteica di ogni campione. I saggi sono stati eseguiti in duplicato.
Analisi Western Blotting
La corteccia e l’ippocampo sono stati omogeneizzati in un tampone freddo come il ghiaccio 50 mM Tris-HCl (pH 7,4) contenente inibitore della fosfatasi e inibitore della proteasi. Dopo la centrifugazione (12.000 rpm) per 10 minuti a 4°C, il contenuto proteico totale è stato determinato dal kit per il dosaggio delle proteine BCA. I campioni di proteine sono stati mescolati con un quarto di volume di tampone di caricamento e poi riscaldati per 5 minuti a 100°C. 20 μg di proteine di ogni campione sono stati elettroforesi con una SDS-PAGE all’8% e trasferiti su membrane PVDF. In seguito, la membrana è stata bloccata per 1 ora con latte scremato al 5% a temperatura ambiente e incubata con anti-GAPDH (1:5000), anti-AChE (1:1000), anti-ChAT (1:1000), e anti-MPO (1:1000) a 4°C durante la notte. Successivamente, le membrane sono state accuratamente sciacquate con PBST e poi incubate con anticorpo secondario anti-rabbit coniugato con HRP (1:5000) per 2 ore a temperatura ambiente. Dopo il lavaggio completo con PBST, le bande proteiche sono state visualizzate con ECL prime kit.
Analisi in immunofluorescenza
La generazione di mieloperossidasi è stata visualizzata mediante microscopia in immunofluorescenza come descritto precedentemente con piccole modifiche (Gray et al., 2008). Dopo il fissaggio in paraformaldeide 4%, le cortecce sono state tagliate in sezioni sagittali 5 micron di spessore, e sono stati deparaffinati e trattati per l’analisi di immunofluorescenza. Le sezioni cerebrali sono state poste in una soluzione di acido citrico (pH 6.0) per la riparazione dell’antigene in un forno a microonde. Successivamente, il quenching dell’autofluorescenza è stato effettuato per 5 minuti. Dopo il blocco in 2% BSA, le sezioni sono state sondate con anti-MPO (1:100) durante la notte a 4°C. Successivamente, le sezioni sono state lavate con PBS (pH 7.4) per tre volte e incubate con anticorpo secondario anti-rabbit coniugato con HRP (1:300) per 30 minuti a temperatura ambiente. Poi, 4′,6-diamidino-2-fenilindolo (DAPI) è stato impiegato per la controcolorazione del DNA e le sezioni del cervello sono stati osservati sotto un microscopio a fluorescenza (Nikon ECLIPSE C1, Giappone), e le immagini sono state catturate di conseguenza. Qui, la fluorescenza di DAPI o MPO è stata misurata ad una lunghezza d’onda di eccitazione di 330-380 o 510-560 nm e una lunghezza d’onda di emissione di 420 o 590 nm, rispettivamente.
Effetti di HAL e HAR sui neurotrasmettitori
Procedura di estrazione
Un metodo di precipitazione rapido, affidabile e conveniente è stato applicato per preparare gli omogenati della corteccia cerebrale e campioni di plasma. Un campione di 100 μL è stato aggiunto con 200 μL di acetonitrile ghiacciato contenente 60 ng/mL di IS in una provetta da centrifuga da 1,5 mL e mescolato al vortex per 1 minuto. La miscela è stata poi centrifugata a 12.000 rpm per 10 min (4°C). Un’aliquota di 5 μL del surnatante di ciascun campione è stata iniettata nella cromatografia liquida a ultra prestazioni combinata con la spettrometria di massa quadrupolare a ionizzazione elettrospray (ESI) (UPLC-ESI-MS/MS) per l’analisi quantitativa.
UPLC-ESI-MS/MS Analisi
Le concentrazioni di vari neurotrasmettitori sono stati quantificati simultaneamente con SHIMADZU LC-30AD sistema UPLC (Shimadzu, Kyoto, Giappone) collegato ad un AB Sciex QTRAP ® 6500 spettrometro di massa a triplo quadrupolo (SCIEX, Stati Uniti) dotato di una sorgente ESI utilizzando la modalità di rilevamento dello ione positivo per il monitoraggio delle reazioni multiple. La separazione cromatografica è stata condotta utilizzando una colonna ZIC-cHILIC (150 mm × 2,1 mm, 3 μm, Merck-Sequant, Germania) con una colonna di guardia SeQuant ZIC-cHILIC (20 mm × 2,1 mm, 5 μm, Merck-Sequant, Germania). La fase mobile, acetonitrile-acqua (65:35, v/v) contenente 0,1% di acido formico è stata erogata ad una velocità di flusso di 0,2 mL/min. Per proteggere lo spettrometro di massa da contaminazioni, il flusso è stato deviato verso i rifiuti durante il primo minuto dopo l’iniezione. Tutti gli altri parametri strumentali sono stati impostati secondo il nostro studio precedente (Jiang, 2016). Il metodo UPLC-ESI-MS/MS è stato ben convalidato ed è stato applicato con successo per determinare le concentrazioni di neurotrasmettitori negli omogenati della corteccia cerebrale e nel plasma (Jiang, 2016).
Analisi statistica
La valutazione statistica è stata effettuata con software SPSS versione 18.0, e i dati sono stati espressi come media ± SD. I dati presentati sulla latenza di fuga e la lunghezza del percorso nel test MWM sono stati analizzati mediante misure ripetute a due vie ANOVA. Gli altri dati comportamentali e i cambiamenti biomarcatori in vitro sono stati testati da un modo ANOVA per confronti multipli. I risultati significativi sono stati contrassegnati secondo i valori critici convenzionali di P: #P < 0,05; ##P < 0,01; ###P < 0,001, rispetto al gruppo di controllo. ∗P < 0,05; ∗∗P < 0,01; ∗∗∗P < 0,001, rispetto al gruppo indotto dalla scopolamina.
Risultati
HAL e HAR hanno attenuato la disfunzione cognitiva dei topi trattati con scopolamina in MWM
Per determinare gli effetti di HAL (dosaggi L, M, e H) e HAR (dosaggi L, M, e H) sull’apprendimento spaziale e sulla memoria, il compito MWM è stato eseguito nei topi con deficit di memoria indotti da scopolamina. L’analisi a due vie a misure ripetute con modello misto ha mostrato che la latenza per raggiungere la piattaforma era significativamente diversa tra i gruppi sperimentali di topi (F(8,396) = 26.011, P < 0.001) e giorni di formazione di acquisizione (F(4,396) = 15.274, P < 0.001). Non c’era alcuna interazione significativa tra gruppi e giorni (F(32,396) = 1.132, P > 0.05), suggerendo che le differenze tra i gruppi erano dipendenti dal trattamento. Come presentato in Figura 2, nel test piattaforma nascosta, la latenza di fuga e la lunghezza del percorso in scopolamina indotta gruppo erano significativamente più lunghi di quelli del gruppo di controllo il quarto (Figura 2A, F (8,99) = 3.135, P < 0.01; Figura 2B, F (8,99) = 4.074, P < 0.01) e quinto giorno (Figura 2A, F (8,99) = 4.164, P < 0.01; Figura 2B, F (8,99) = 4.548, P < 0.01), indicando il modello di topi costruito con successo di deterioramento della memoria. Tuttavia, i deficit cognitivi indotti da scopolamina sono stati invertiti sia da HAL e HAR. Rispetto al gruppo scopolamina-indotto, la latenza di fuga e la lunghezza del percorso sono stati efficacemente ridotti in HAL (L, M, e dosaggi H) e HAR (M e dosaggi H) gruppi trattati il quarto (Figura 2A, F (8,99) = 4.975, P < 0.01; F (8,99) = 2.816, P < 0.05; F(8,99) = 2.795, P < 0.05; Figura 2B, F(8,99) = 3.836, P < 0.01; F(8,99) = 3.231, P < 0.01; F(8,99) = 2.658, P < 0.05; Figura 2C, F(8,99) = 4.673, P < 0.01; F(8,99) = 4.881, P < 0.01; Figura 2D, F(8,99) = 3,817, P < 0,01; F(8,99) = 3,129, P < 0,01) e quinto giorno (Figura 2A, F(8,99) = 12,637, P < 0,001; F(8,99) = 2,802, P < 0,05; F(8,99) = 2,772, P < 0,05; Figura 2B, F(8,99) = 4.014, P < 0.01; F(8,99) = 2.722, P < 0.05; F(8,99) = 2.531, P < 0.05; Figura 2C, F(8,99) = 4.574, P < 0.01; F(8,99) = 4,632, P < 0,01; Figura 2D, F(8,99) = 2,547, P < 0,05; F(8,99) = 3,905, P < 0,01). Tuttavia, quando trattati con il basso dosaggio di HAR a 10 mg / kg (gruppo di dosaggio L), nessuna diminuzione significativamente la latenza di fuga e la lunghezza del percorso per tutto il periodo di formazione sul quarto (Figura 2C, F (8,99) = 1.182, P > 0.05; Figura 2D, F(8,99) = 0.494, P > 0.05) e quinto giorno (Figura 2C, F(8,99) = 0.873, P > 0.05; Figura 2D, F(8,99) = 0.201, P > 0.05). Si può anche vedere dalla Figura 2, la latenza di fuga e la lunghezza del percorso di donepezil-trattato (5 mg / kg) sono stati notevolmente accorciati rispetto a quelli del gruppo scopolamina-indotto il quarto (Figura 2A, F (8,99) = 2.668, P < 0.05; Figura 2B, F(8,99) = 2.643, P < 0.05) e quinto giorno (Figura 2A, F(8,99) = 2.780, P < 0.05; Figura 2B, F(8,99) = 2.897, P < 0.05) durante la sessione di prova di allenamento tre.
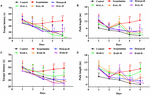
FIGURA 2. Gli effetti di HAL (2, 5, e 10 mg / kg, vale a dire basso: L, medio: M, e alto: H dosaggi) e HAR (10, 20, e 30 mg / kg, vale a dire L, M, e H dosaggi) su scopolamina indotta disturbi della memoria topi. HAL (dosaggi L, M, e H), HAR (dosaggi L, M, e H), e donepezil (5 mg/kg) sono stati somministrati tramite gavage per 7 giorni prima dell’allenamento per i test Morris water maze (MWM), e hanno continuato durante i test. I disturbi della memoria sono stati indotti da scopolamina (1 mg/kg, i.p.). La latenza di fuga (A) e la lunghezza del percorso (B) di HAL (L, M, e H dosaggi) gruppi trattati in test piattaforma nascosta per cinque giorni consecutivi, e la latenza di fuga (C) e la lunghezza del percorso (D) di HAR (L, M, e H dosaggi) gruppi trattati in test piattaforma nascosta per cinque giorni consecutivi. La barra di errore (SD) per i punti di dati in questa figura non è stato dato al fine di discriminare chiaramente la differenza tra i trattamenti. N = 12/gruppo. ##P < 0,01, rispetto al gruppo di controllo. ∗P < 0.05; ∗∗P < 0.01; ∗∗∗P < 0.001, rispetto al gruppo indotto dalla scopolamina.
Il giorno dopo il test della piattaforma nascosta, la prova della sonda spaziale è stata condotta togliendo la piattaforma per valutare la memoria spaziale di tutti i topi. Come mostrato nella Figura 3, la frequenza di passaggio è stato notevolmente diminuito nel gruppo scopolamina indotta (F (8,81) = 5.498, P < 0.05), illustrando che 1 mg / kg di scopolamina danneggiato la formazione della memoria spaziale nei topi. In particolare, a parte HAR (dosaggio L) gruppo di trattamento (F(8,81) = 0.494, P > 0.05), gli altri gruppi di trattamento di HAL (L, M, e H dosaggi) e HAR (M e H dosaggi) drammaticamente aumentato la frequenza di passaggio (F(8,81) = 11.667, P < 0.01; F(8,81) = 9.072, P < 0.01; F(8,81) = 4.507, P < 0.05; F(8,81) = 7.063, P < 0.05; F(8,81) = 8.583, P < 0.01, rispettivamente), e l’aumento del gruppo dosaggio HAL-L era più notevole rispetto agli altri gruppi (Figura 3). Inoltre, il gruppo trattato con donepezil (5 mg/kg) ha anche aumentato significativamente la frequenza di passaggio rispetto ai topi indotti da scopolamina (Figura 3, F(8,81) = 5.345, P < 0.05). Tutti questi risultati hanno suggerito che HAL (L, M e H dosaggi) e HAR (M e H dosaggi) potrebbe migliorare la capacità di memoria spaziale di scopolamina indotta topi disfunzione cognitiva, e HAL esposto effetti più forti di HAR per l’apprendimento spaziale e la memoria in MWM.
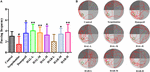
FIGURA 3. Gli effetti di HAL (2, 5, e 10 mg/kg, cioè basso: L, medio: M, e alto: H dosaggi) e HAR (10, 20, e 30 mg/kg, cioè L, M, e H dosaggi) su scopolamina-indotta disturbi della memoria topi. La frequenza dei topi che passano attraverso la posizione della piattaforma (A), e le tracce di nuoto dei topi nel serbatoio dell’acqua (B). Il cerchio verde indica la posizione della piattaforma nascosta, mentre le curve rosse rappresentano le tracce di movimento dei topi. N = 10/gruppo. #P < 0,05, rispetto al gruppo di controllo. ∗P < 0.05; ∗∗P < 0.01; vs. il gruppo indotto da scopolamina.
Effetti di HAL e HAR sul sistema colinergico, lo stress ossidativo e l’infiammazione indotti dalla scopolamina
Per chiarire ulteriormente i potenziali meccanismi di HAL e HAR nel migliorare la memoria indotta dalla scopolamina, sono stati studiati i livelli di molteplici fattori biochimici e le espressioni proteiche associate al sistema colinergico, lo stress ossidativo e l’infiammazione. Le figure 4, 5 presentano i cambiamenti di vari fattori biochimici nella corteccia o nell’ippocampo, e le figure 6-8 danno gli effetti di HAL e HAR sulle espressioni proteiche nella corteccia dei topi.
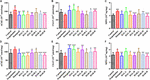
FIGURA 4. Gli effetti di HAL (2, 5 e 10 mg/kg, cioè basso: L, medio: M e alto: H dosaggi) e HAR (10, 20, e 30 mg / kg, vale a dire L, M, e H dosaggi) sulle attività di acetilcolinesterasi (AChE), colina acetiltransferasi (ChAT), e mieloperossidasi (MPO) nella corteccia cerebrale (A-C) e hipocampus (D-F) di scopolamina indotta deterioramento cognitivo topi, rispettivamente. I dati sono stati espressi come media ± SD (n = 10). #P < 0.05; ##P < 0.01; ###P < 0.001, rispetto al gruppo di controllo. ∗P < 0.05; ∗∗P < 0.01; ∗∗∗P < 0.001, rispetto al gruppo indotto dalla scopolamina.
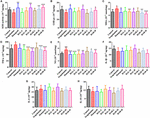
FIGURA 5. Gli effetti di HAL (2, 5 e 10 mg/kg, cioè basso: L, medio: M e alto: H) e HAR (10, 20 e 30 mg/kg, cioè i dosaggi L, M e H) sull’attività o la produzione di superossido dismutasi (SOD) (A), glutatione perossidasi (GSH-px) (B), maleica diadeide (MDA) (C), fattore di necrosi tumorale α (TNF-α) (D) e ossido nitrico (NO) (E) nella corteccia cerebrale di scopolamina indotta deterioramento cognitivo topi, rispettivamente. I dati sono stati espressi come media ± SD (n = 10). #P < 0.05; ##P < 0.01; ###P < 0.001, rispetto al gruppo di controllo. Interleuchina 1β (IL-1β) (F), interleuchina 6 (IL-6) (G) e interleuchina 10 (IL-10) (H). ∗P < 0,05; ∗∗P < 0,01; ∗∗∗P < 0,001, rispetto al gruppo indotto dalla scopolamina.
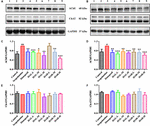
FIGURA 6. Gli effetti di HAL (2, 5, e 10 mg / kg, vale a dire basso: L, medio: M, e alto: H dosaggi) e HAR (10, 20, e 30 mg / kg, vale a dire L, M, e H dosaggi) sui livelli di espressione proteica di acetilcolinesterasi (AChE), e colina acetiltransferasi (ChAT) nella corteccia cerebrale (A, C, E) e hipocampus (B, D, F) di scopolamina indotta deterioramento cognitivo topi. I dati sono stati espressi come media ± SD (n = 3). #P < 0.05; ##P < 0.01, rispetto al gruppo di controllo. ∗P < 0.05; ∗∗P < 0.01; ∗∗∗P < 0.001, rispetto al gruppo indotto da scopolamina.

FIGURA 7. Gli effetti di HAL (2, 5, e 10 mg / kg, vale a dire basso: L, medio: M, e alto: H dosaggi) e HAR (10, 20, e 30 mg / kg, vale a dire L, M, e H dosaggi) sui livelli di espressione proteica della mieloperossidasi (MPO) nella corteccia cerebrale (A, C) e hipocampus (B, D) di scopolamina indotta deterioramento cognitivo topi. I dati sono stati espressi come media ± SD (n = 3). #P < 0.05; ##P < 0.01, rispetto al gruppo di controllo. ∗P < 0.05; ∗∗P < 0.01; ∗∗∗P < 0.001, rispetto al gruppo indotto dalla scopolamina.

FIGURA 8. Gli effetti di HAL (2, 5, e 10 mg / kg, vale a dire basso: L, medio: M, e alto: H dosaggi) e HAR (10, 20, e 30 mg / kg, vale a dire L, M, e dosaggi H) sulla generazione di mieloperossidasi (MPO) nella corteccia cerebrale di scopolamina indotta disturbi cognitivi topi visualizzati da microscopia immunofluorescenza.
Effetti di HAL e HAR sui deficit colinergici
Per chiarire gli effetti di HAL e HAR sulla funzione colinergica cerebrale, sono stati valutati i cambiamenti nelle attività e livelli proteici di AChE e ChAT nei tessuti corticali e ippocampali di tutti i topi. Come mostrato nelle figure 4A,D, il trattamento con scopolamina a 1 mg / kg significativamente aumentato l’attività di AChE nella corteccia e ippocampo (F (8,81) = 10.553, P < 0.01; F (8,81) = 6.177, P < 0.05). Tranne HAR-L gruppo di dosaggio nella corteccia, l’altro HAL (L, M e H dosaggi) e HAR (M e H dosaggi) gruppi di trattamento notevolmente ridotto l’attività AChE (Figura 4A, F (8,81) = 10.837, P < 0.01; F (8,81) = 8.621, P < 0.05; F (8,81) = 15.177, P < 0.01; F(8,81) = 8,615, P < 0,05; F(8,81) = 16,330, P < 0,001; Figura 4D, F(8,81) = 46,593, P < 0,001; F(8,81) = 34,179, P < 0.001; F(8,81) = 7,968, P < 0,05; F(8,81) = 4,769, P < 0,05; F(8,81) = 49,802, P < 0,001; F(8,81) = 46,665, P < 0,001). Allo stesso modo, gruppo trattato con donepezil evidentemente diminuito le attività di AChE rispetto ai livelli nel gruppo scopolamina indotta (Figura 4A, F (8,81) = 13.138, P < 0,01; Figura 4D, F (8,81) = 7.400, P < 0,05). Inoltre, la scopolamina indotta gruppo visualizzato una significativa diminuzione dell’attività di ChAT sia nella corteccia e ippocampo (Figura 4B, F (8,81) = 5.481, P < 0.05; Figura 4E, F (8,81) = 4.874, P < 0.05). Tuttavia, HAL (dosaggi L e M) e HAR (dosaggi M e H) amministrazioni apprezzabilmente aumentato l’attività ChAT nella corteccia (Figura 4B, F (8,81) = 7.956, P < 0.05; F (8,81) = 8.390, P < 0.05; F (8,81) = 7.835, P < 0.05; F(8,81) = 51.927, P < 0.001), e i livelli di ChAT di tutti i gruppi di trattamento HAL e HAR nell’ippocampo erano significativamente superiori a quelli del gruppo scopolamina-indotto (Figura 4E, F(8,81) = 18.139, P < 0.001; F(8,81) = 9.665, P < 0.01; F(8,81) = 14.113, P < 0.01; F(8,81) = 5.178, P < 0.05; F(8,81) = 7.599, P < 0.05; F(8,81) = 11,953, P < 0,01), e l’effetto del gruppo di dosaggio HAL-L sull’attività ChAT era più significativo rispetto ai gruppi di somministrazione HAR.
Come illustrato nella Figura 6, rispetto al gruppo di controllo, i livelli di espressione proteica di AChE nella corteccia cerebrale e ippocampo del gruppo scopolamina indotta sono stati notevolmente aumentati (Figura 6C, F (8,18) = 36.632, P < 0.01; Figura 6D, F (8,18) = 14.823, P < 0.05), mentre i livelli proteici di ChAT erano quasi invariato (Figure 6E,F). Dopo i trattamenti con HAL (L, M e H dosaggi), HAR (M e H dosaggi) e donepezil, ad eccezione di HAR (L dosaggio), i livelli proteici di AChE nella corteccia sono stati ridotti notevolmente rispetto alla scopolamina indotta gruppo (Figura 6C, F (8,18) = 50.590, P < 0.001; F(8,18) = 16.950, P < 0.05; F(8,18) = 30.993, P < 0.01; F(8,18) = 23.821, P < 0.01; F(8,18) = 52.196, P < 0.001; F(8,18) = 29.284, P < 0.01), mentre i livelli di ChAT non erano alterati (Figura 6E). E gli effetti simili sui livelli di AChE e ChAT sono stati visti con HAL e HAR (L, M, e H dosaggi) amministrazioni nell’ippocampo (Figura 6D, F (8,18) = 41.195, P < 0.001; F(8,18) = 28,111, P < 0,01; F(8,18) = 47,611, P < 0,001; F(8,18) = 30,539, P < 0,01; F(8,18) = 33,225, P < 0,01; F(8,18) = 40,032, P < 0,001; Figura 6F). Inoltre, gli effetti inibitori di HAR sull’espressione della proteina AChE erano dose-dipendenti, mentre HAL aveva un notevole effetto inibitorio a bassa dose di 2 mg/kg (Figura 6). Così, HAL e trattamenti HAR impedito contro scopolamina indotta elevazione dell’attività AChE e l’espressione proteica e la riduzione dell’attività ChAT, che ha dimostrato che HAL e HAR potrebbe migliorare la funzione del sistema colinergico, e alleviare la disfunzione comportamentale. In particolare, HAL ha manifestato un miglioramento significativo a basso dosaggio.
Effetti di HAL e HAR sui marcatori di stress ossidativo
Sono stati misurati gli effetti di HAL e HAR sulle attività degli enzimi antiossidanti SOD, GSH-px, e il livello di MDA nella corteccia. Come indicato nella Figura 5, il gruppo indotto da scopolamina visibilmente attenuato le attività SOD e GSH-px rispetto al gruppo di controllo (Figura 5A, F(8,81) = 12.254, P < 0.01; Figura 5B, F(8,81) = 4.577, P < 0.05). Mentre, HAL (dosaggio H), HAR (M e H dosaggi), e donepezil amministrazioni significativamente aumentato l’attività SOD (Figura 5A, F (8,81) = 13.287, P < 0.01; F (8,81) = 13.424, P < 0.01; F (8,81) = 34.510, P < 0.001; F(8,81) = 8,670, P < 0,01), e HAL, HAR (entrambi i dosaggi H) e trattamenti donepezil chiaramente sollevato l’attività di GSH-px (Figura 5B, F(8,81) = 6,010, P < 0,05; F(8,81) = 6,008, P < 0,05; F(8,81) = 6,860, P < 0,05). Inoltre, con HAL, HAR (entrambi i dosaggi M e H) e donepezil (5 mg / kg) trattamenti, l’attenuazione significativa del livello di MDA aumento è stato osservato rispetto ai topi scopolamina indotta (Figura 5C, F (8,81) = 9.302, P < 0.01; F(8,81) = 6.565, P < 0.05; F(8,81) = 12.690, P < 0.01; F(8,81) = 33.627, P < 0.001; F(8,81) = 5.874, P < 0.05). Questi risultati hanno suggerito che HAL e HAR possono prevenire il danno ossidativo indotto dalla scopolamina attraverso la protezione della corteccia dallo stress ossidativo. In particolare, il danno ossidativo potrebbe essere migliorato solo ad alti dosaggi sia per HAL che per HAR, e i miglioramenti di HAL e HAR erano comparabili in generale.
Effetti di HAL e HAR sui livelli di infiammazione
Sono stati analizzati gli effetti di HAL e HAR sulle attività dei fattori infiammatori MPO, TNF-α, IL-1β, IL-6, IL-10 e il livello di NO nella corteccia o nell’ippocampo. Le attività di MPO (corteccia e ippocampo) e TNF-α (corteccia) erano elevate nei topi indotti da scopolamina rispetto ai topi di controllo (Figura 4C, F(8,81) = 34.740, P < 0.001; Figura 4F, F(8,81) = 6.729, P < 0.05; Figura 5D, F(8,81) = 6.316, P < 0.05), ma i livelli di IL-1β, IL-6, e IL-10 non sono stati modificati (Figure 5F-H). Tuttavia, HAL, HAR (entrambi i dosaggi M e H) e amministrazioni donepezil portato ad una significativa riduzione dell’attività MPO nella corteccia e ippocampo in modo dose dipendente (Figura 4C, F (8,81) = 10.435, P < 0.01; F(8,81) = 32.309, P < 0.001; F(8,81) = 16.397, P < 0.01; F(8,81) = 31.291, P < 0.001; F(8,81) = 7,129, P < 0,05; Figura 4F, F(8,81) = 7,212, P < 0,05; F(8,81) = 10,533, P < 0.01; F(8,81) = 9,150, P < 0,01; F(8,81) = 18,903, P < 0,001; F(8,81) = 11,641, P < 0,01), e i trattamenti HAL (dosaggi L, M, e H), HAR (dosaggi M e H) e donepezil indeboliscono anche l’attività di TNF-α nella corteccia (Figura 5D, F(8,81) = 10.377, P < 0,01; F(8,81) = 28,257, P < 0,001; F(8,81) = 31,088, P < 0,001; F(8,81) = 15,966, P < 0,001; F(8,81) = 23,530, P < 0,001; F(8,81) = 5,909, P < 0,05). Inoltre, a parte il gruppo di dosaggio HAR-L, una notevole attenuazione dell’aumento del livello di NO è stata trovata negli altri topi di trattamento HAL, HAR e donepezil rispetto ai topi con amnesia indotta da scopolamina (Figura 5E, F(8,81) = 21.319, P < 0.001; F(8,81) = 12.996, P < 0.01; F(8,81) = 11.911, P < 0.01; F(8,81) = 5.227, P < 0.05; F(8,81) = 8.799, P < 0.01; F(8,81) = 17,349, p < 0,001), e gli effetti inibitori di HAL su TNF-α e NO erano più pronunciati di quelli di HAR.
Come mostrato nella Figura 7, rispetto ai topi di controllo, i livelli di espressione proteica di MPO corticale e ippocampale in scopolamina indotta topi erano elevati (Figura 7C, F (8,18) = 29.975, P < 0.01; Figura 7D, F (8,18) = 32.014, P < 0.01). Dopo le somministrazioni di donepezil, HAL, e HAR (dosaggi L, M, e H), le espressioni proteiche di MPO erano apparentemente caduto nella corteccia e ippocampo rispetto alla scopolamina indotta gruppo. Inoltre, i risultati della determinazione immunofluorescenza anche rivelato che HAL e trattamenti HAR potrebbe ridurre notevolmente l’espressione MPO della corteccia con un modo dose-dipendente, e le inibizioni di HAL e HAR erano comparabili (Figura 8). Tutti questi risultati implicano che HAL e HAR potrebbe abbattere la scopolamina indotta lesioni infiammatorie attraverso l’inibizione della corteccia e ippocampo da infiammazione.
Effetti modulatore di HAL e HAR sui neurotrasmettitori di Scopolamina-trattati topi
Vari neurotrasmettitori plasmatici e corticale sono stati stimati utilizzando UPLC-ESI-MS/MS e le alterazioni sono presentate nelle figure 9, 10, rispettivamente. Sulla base del metodo per la determinazione dei neurotrasmettitori stabilito in precedenza, i contenuti di ACh, Ch, L-Trp, 5-HT, L-Glu, L-Phe, L-Tyr nel plasma e ACh, Ch, L-Trp, γ-GABA, L-Glu, L-Phe, L-Tyr nella corteccia erano sopra il limite inferiore di quantificazione, e quindi tutti sono stati quantificati con successo.
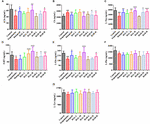
FIGURA 9. Gli effetti di HAL (2, 5, e 10 mg / kg, vale a dire basso: L, medio: M, e alto: H dosaggi) e HAR (10, 20, e 30 mg / kg, vale a dire L, M, e H dosaggi) sul contenuto di neurotrasmettitori nel plasma di scopolamina indotta disturbi cognitivi topi. N = 10/gruppo. ACh (A), Ch (B), L-Trp (C), 5-HT (D), L-Glu (E), L-Phe (F), L-Tyr (G). #P < 0,05; ##P < 0,01; ###P < 0,001, rispetto al gruppo di controllo. ∗P < 0.05; ∗∗P < 0.01; ∗∗∗P < 0.001, rispetto al gruppo indotto dalla scopolamina.
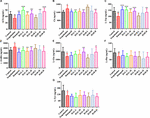
FIGURA 10. Gli effetti di HAL (2, 5, e 10 mg/kg, cioè basso: L, medio: M, e alto: H dosaggi) e HAR (10, 20, e 30 mg/kg, cioè L, M, e H dosaggi) sul contenuto di neurotrasmettitori nella corteccia cerebrale di scopolamina indotta disturbi cognitivi topi. N = 10/gruppo. ACh (A), Ch (B), L-Trp (C), γ-GABA (D), L-Glu (E), L-Phe (F), L-Tyr (G). #P < 0,05; ##P < 0,01, rispetto al gruppo di controllo. ∗P < 0.05; ∗∗P < 0.01; ∗∗∗P < 0.001, rispetto al gruppo indotto da scopolamina.
Dopo l’induzione di scopolamina al dosaggio di 1 mg/kg, le concentrazioni di ACh, L-Trp, 5-HT, L-Glu e L-Phe sono diminuite nel plasma (Figura 9A, F(8,81) = 11.453, P < 0.01; Figura 9C, F(8,81) = 23.137, P < 0.001; Figura 9D, F(8,81) = 7.359, P < 0.05; Figura 9E, F(8,81) = 55.531, P < 0.001; Figura 9F, F(8,81) = 6.330, P < 0.05), mentre con nessun impatto su L-Tyr (Figura 9G, F(8,81) = 2.091, P > 0.05). Tuttavia, quando i trattamenti con HAL e HAR ad alto dosaggio, il contenuto di ACh e L-Glu sono stati elevati (Figure 9A, E), e il contenuto di L-Trp sono stati evidentemente sollevati con HAL (L, M, e H dosaggi) e HAR (M e H dosaggi) amministrazioni in modo dose-dipendente (Figura 9C). Inoltre, i topi trattati con HAL e HAR (dosaggi M e H) hanno mostrato un aumento significativo del livello di 5-HT rispetto ai topi indotti da scopolamina (Figura 9D). Ma, le somministrazioni HAL e HAR non hanno modulato il contenuto di L-Phe e L-Tyr (Figure 9F,G). Inoltre, HAL (dosaggio H) così come HAR (dosaggi M e H) ha prodotto un effetto sulla riduzione del contenuto di Ch nel plasma (Figura 9B).
Inoltre, la Figura 10 mostra le variazioni dei neurotrasmettitori nella corteccia cerebrale. Dopo l’induzione di scopolamina, i contenuti di ACh, L-Trp, L-Glu, L-Phe, e L-Tyr erano ovviamente diminuiti (Figura 10A, F(8,81) = 11.296, P < 0.01; Figura 10C, F(8,81) = 10.979, P < 0.01; Figura 10E, F(8,81) = 7.216, P < 0.05; Figura 10F, F(8,81) = 10.340, P < 0.01; Figura 10G, F(8,81) = 6.834, P < 0.05), mentre i contenuti di Ch e γ-GABA erano significativamente aumentati nella corteccia rispetto al gruppo di controllo (Figura 10B, F(8,81) = 7.377, P < 0.05; Figura 10D, F(8,81) = 5.580, P < 0.05). Tuttavia, i contenuti di ACh erano osservabilmente elevati in HAL (L, M e H dosaggi) e HAR (M e H dosaggi) gruppi, e il contenuto di L-Trp sono stati notevolmente sollevato in HAL (L, M e H dosaggi) e HAR (H dosaggio) gruppi, e le quantità di L-Glu sono stati anche elevati al dosaggio elevato di HAL e HAR gruppi (Figure 10A,C,E). Inoltre, i trattamenti HAL (L, M, e H dosaggi) e HAR (H dosaggio) ha portato ad una diminuzione evidente di Ch e γ-GABA livelli rispetto al gruppo scopolamina indotta (Figure 10B,D). Tuttavia, diverse dosi di HAL e HAR hanno mostrato un effetto trascurabile sulla diminuzione di L-Phe e L-Tyr indotta dalla scopolamina (Figure 10F,G). In generale, gli effetti di HAL sui neurotrasmettitori plasmatici e corticali importanti erano più prominenti di quelli di HAR (Figure 9, 10).
Discussione
La malattia di Alzheimer è un disturbo neurodegenerativo progressivo mortale con l’aumento della popolazione anziana e dell’aspettativa di vita, ed è urgente trovare nuovi farmaci che possano trattare efficacemente il MA (Kouémou et al., 2017). È generalmente noto che l’ipofunzione colinergica, lo stress ossidativo e la neuroinfiammazione sono una delle caratteristiche principali del MA (Abd-El-Fattah et al., 2014; Demirci et al., 2017). La scopolamina è un antagonista non selettivo del recettore colinergico muscarinico (Jang et al., 2013; Kaur et al., 2017). Numerosi studi hanno dimostrato che la scopolamina può compromettere la capacità di apprendimento e di memoria nell’uomo e nei modelli animali, e il modello di AD indotto da scopolamina è ampiamente utilizzato per studiare il deficit cognitivo e lo screening di farmaci anti-AD (Goverdhan et al., 2012). La scopolamina porta a deficit cognitivi associati a una riduzione della neurotrasmissione colinergica, a un aumento dello stress ossidativo e a un’elevata infiammazione nel cervello (Lin e Beal, 2006). Di conseguenza, i farmaci possono efficacemente migliorare la funzione colinergica e / o attenuare lo stress ossidativo e l’infiammazione, e può invertire l’apprendimento e la memoria in scopolamina indotta topi AD, e sarà infine prezioso per il trattamento di AD.
In precedenza, He et al. (2015a) ha dimostrato che HAR potrebbe inibire l’attività AChE e significativamente migliorato l’apprendimento spaziale e la memoria di topi cognitivamente compromessa, compresi APP / PS1 transgenici e scopolamina indotta topi AD. Nel presente studio, gli effetti migliorativi della memoria di HAL (2, 5 e 10 mg/kg) e HAR (10, 20 e 30 mg/kg) su topi indotti da scopolamina sono stati confrontati utilizzando la valutazione comportamentale MWM. Scopolamina (1 mg / kg) è stato verificato per danneggiare l’apprendimento spaziale e la capacità di memoria dei topi nel compito MWM, che era coerente con i nostri studi precedenti (He et al., 2015a; Liu et al., 2017). Dopo i trattamenti con HAL (dosaggi L, M e H) e HAR (dosaggi M e H), la latenza di fuga e la lunghezza del percorso sono stati diminuiti e la frequenza di passaggio sono stati aumentati in modo efficace (Figure 2, 3), dimostrando che le somministrazioni di HAL e HAR hanno notevolmente migliorato l’apprendimento e la memoria spaziale dei topi indotti da scopolamina, e i miglioramenti di HAL erano più significativi di quelli di HAR.
Al fine di chiarire ulteriormente il meccanismo alla base del miglioramento dell’apprendimento e della memoria di HAL e HAR nei topi indotti da scopolamina, sono state valutate le alterazioni del sistema colinergico, lo stress ossidativo e l’infiammazione. Come riportato nella letteratura precedente (Abd-El-Fattah et al., 2014; Lin et al., 2016; Demirci et al., 2017), l’iniezione di scopolamina i.p. ha portato a un’attenuazione della funzione colinergica, un elevato stress ossidativo e l’infiammazione nello studio attuale. Il donepezil è una terapia sintomatica rappresentativa per l’AD lieve e moderata come un inibitore AChE (Bohnen et al., 2005), e ricerche recenti hanno rivelato che può anche sopprimere l’infiammazione e lo stress ossidativo (Saxena et al., 2008; Yoshiyama et al., 2010). In questo studio, il donepezil (controllo positivo) potrebbe efficacemente migliorare questi cambiamenti nei topi indotti da scopolamina e migliorare il loro apprendimento e la memoria. Simile alle loro attività in vitro (Zhao et al., 2013; Liu et al., 2014), HAL e HAR a diversi dosaggi non solo hanno invertito l’aumento indotto da scopolamina dell’attività AChE, ma hanno anche portato all’elevazione del neurotrasmettitore ACh e alla diminuzione di Ch nella corteccia cerebrale, nell’ippocampo o nel plasma (Figure 4, 9, 10). Inoltre, i livelli proteici di AChE corticale sono stati evidentemente inibiti da HAL e HAR (Figure 6C,D). Come riportato da Oh et al. (2009), i neuroni ChAT-positivi sono stati significativamente ridotti dal trattamento con scopolamina. I presenti risultati hanno indicato che HAL e HAR potrebbero invertire la diminuzione dell’attività ChAT indotta dalla scopolamina (Figure 4B,E), mentre non hanno alcun impatto sulle espressioni proteiche di ChAT (Figure 6E,F), e deve essere ulteriormente dimostrato. Quindi, questi hanno confermato che gli effetti anti-amnesici di HAL e HAR sulla disfunzione della cognizione indotta dalla scopolamina probabilmente associati alla modifica del sistema colinergico (in particolare AChE), e HAL ha dimostrato un evidente miglioramento colinergico a basso dosaggio (2 mg/kg).
Inoltre, molti studi hanno dimostrato che l’aumento dello stress ossidativo è ampiamente considerato come un importante fattore di rischio contributivo nello sviluppo di AD (Ghumatkar et al., 2015; Lu et al., 2018). HAL e HAR potrebbero servire come antiossidanti endogeni e sono stati trovati a possedere una capacità antiossidante scavenging radicali liberi (Tse-Susanna et al., 1991; Berrougui et al., 2006a,b). In questo studio, la sovrapproduzione di ROS (un prodotto della perossidazione lipidica, MDA) e la riduzione degli enzimi antiossidanti (SOD e GSH-px) sono stati osservati nei topi indotti da scopolamina (Figura 5). Tuttavia, HAL e HAR amministrazioni osservabilmente attivato gli enzimi antiossidanti di SOD e GSH-px e soppresso la formazione di MDA nella corteccia dei topi scopolamina indotta demenza (Figura 5), e poi migliorato la capacità di difesa antiossidante, indicando gli effetti neuroprotettivi di HAL e HAR. In particolare, gli effetti antiossidanti di HAL e HAR erano generalmente comparabili.
Inoltre, ci sono prove crescenti che suggeriscono che il deterioramento della memoria è associato a un aumento della neuroinfiammazione (Abd-El-Fattah et al., 2014). Secondo lo studio di Bensalem et al. (2014), HAL e HAR hanno dimostrato una significativa inibizione su MPO con l’IC50 di 0,08 e 0,26 μM, rispettivamente. L’attività antinfiammatoria di HAR è stata raggiunta attraverso l’inibizione di TNF-α e NO in cellule di topo RAW264 e THP-1 umane stimolate dal lipopolisaccaride (Patel et al., 2012). In particolare, gli alti livelli di citochine pro-infiammatorie (TNF-α e MPO) e mediatori infiammatori (NO) sono stati rilevati nel cervello di topi con amnesia indotta da scopolamina (Figure 4, 5). Lo studio attuale ha confermato che i trattamenti HAL e HAR potrebbero inibire simultaneamente la generazione di NO e l’upregulation di TNF-α e MPO, e le azioni inibitorie di HAL su TNF-α e NO erano più evidenti di quelle di HAR (Figure 4, 5). Inoltre, i risultati delle analisi di western blotting e di immunofluorescenza dimostrano ulteriormente che i livelli di espressione proteica di MPO sono stati soppressi in modo prominente da HAL e HAR (Figure 7, 8), suggerendo che la capacità di HAL e HAR di contrastare i deficit di memoria potrebbe essere mediata dalla soppressione dei marcatori infiammatori TNF-α, MPO, e NO.
Come è noto, AD è associato a livelli inadeguati di vari neurotrasmettitori (Kumar e Singh, 2015; Svob Strac et al, 2015). Studi precedenti hanno riportato che i topi che hanno ricevuto scopolamina da sola hanno mostrato una notevole diminuzione della reattività del sistema colinergico, come indicato da una diminuzione del livello di ACh e un aumento dell’attività AChE insieme a una diminuzione dell’attività ChAT (Lee et al., 2014). Un modello animale transgenico di AD ha dimostrato un calo del livello di Glu (Nilsen et al., 2012), e la metabolomica del siero e del plasma ha anche indicato una diminuzione di Trp, 5-HT, Glu, Phe, Tyr in topi modello di AD o pazienti (Vermeiren et al., 2014; González-Domínguez et al., 2015; Weng et al., 2015; Corso et al., 2017; Li et al., 2018). Corrispondentemente, i nostri risultati hanno dimostrato che la demenza indotta da scopolamina era accompagnata dalla diminuzione di ACh, L-Trp, 5-HT, L-Glu, L-Phe, L-Tyr e l’elevazione di Ch e γ-GABA, che è in accordo con gli studi precedenti (Scali et al, 1999; Nilsen et al., 2012; Lee et al., 2014; Vermeiren et al., 2014; González-Domínguez et al., 2015; Kumar e Singh, 2015; Weng et al., 2015; Zhou et al., 2016; Corso et al., 2017; Liu et al., 2017). I neurotrasmettitori svolgono un ruolo importante nel circuito cerebrale coinvolto in molti aspetti dell’apprendimento e della memoria, in particolare i neurotrasmettitori colinergici, serotoninergici, glutametargici e GABAergici (Vermeiren et al., 2014; Kumar e Singh, 2015; Zhou et al., 2016). È degno di nota che, ad eccezione di L-Phe e L-Tyr, le altre alterazioni potrebbero essere efficacemente invertite da entrambe le somministrazioni di HAL e HAR nel plasma e nella corteccia, e le modulazioni di HAL erano più evidenti di quelle di HAR (Figure 9, 10). Di conseguenza, la regolazione di questi neurotrasmettitori da parte di HAL e HAR può essere utile per migliorare l’apprendimento e la capacità di memoria dei topi affetti da demenza.
In generale, HAL (2, 5 e 10 mg/kg) e HAR (20 e 30 mg/kg) hanno mostrato un miglioramento della neurotrasmissione colinergica attraverso la soppressione di AChE e l’induzione di ChAT, migliorando la difesa antiossidante aumentando le attività di SOD e GSH-px e riducendo la produzione di MDA, migliorando gli effetti antinfiammatori attraverso la riduzione di TNF-α, MPO e NO, e modulando i livelli di neurotrasmettitori critici (ACh, Ch, L-Trp, 5-HT, γ-GABA, e L-Glu). Così, HAL e HAR possono agire sui bersagli multipli come terapeutici per l’AD. Inoltre, i regolamenti di HAL sulla funzione colinergica, l’infiammazione e i neurotrasmettitori erano più notevoli di quelli di HAR, e HAL ha mostrato una simile capacità antiossidante con HAR. In particolare, il dosaggio efficace di HAL (2 mg/kg) era molto più basso di quello di HAR (20 mg/kg), che può essere dovuto principalmente alle differenze nella biodisponibilità e nella stabilità metabolica dei due farmaci (Li et al., 2017b). Presi insieme, tutti questi risultati hanno rivelato che rispetto a HAR, HAL può essere un composto candidato migliore con caratteristiche anti-amnesiche e farmacocinetiche superiori per la terapia di AD.
Conclusione
In sintesi, HAL e HAR potrebbero efficacemente migliorare i danni alla memoria in un modello di topo indotto da scopolamina attraverso il miglioramento della funzione del sistema colinergico, la soppressione dello stress ossidativo e dei danni da infiammazione, e la modulazione dei neurotrasmettitori vitali nei topi dementi. Soprattutto per HAL, i regolamenti sulla funzione colinergica, l’infiammazione e i neurotrasmettitori erano più significativi di quelli di HAR, e mostravano un effetto antiossidante comparabile a HAR. In particolare, il dosaggio efficace di HAL (2 mg/kg) era molto inferiore a quello di HAR (20 mg/kg). I risultati complessivi indicano che HAL può essere un farmaco candidato superiore per il trattamento delle disfunzioni dell’apprendimento e della memoria come l’AD. Ulteriori valutazioni devono essere intraprese sugli effetti anti-amnesici e sui meccanismi molecolari di HAL, che forniranno sostanziali prove iniziali per la prevenzione e il trattamento di AD.
Contributi degli autori
S-PL e C-HW: hanno partecipato alla progettazione della ricerca, eseguito l’analisi dei dati, scritto o contribuito alla scrittura del manoscritto. S-PL, Y-WW, S-LQ, Y-PZ, GD, W-ZD, CM, Q-YL, H-DG, WL, e X-MC: hanno condotto gli esperimenti.
Finanziamento
Questo lavoro è stato sostenuto dalla National Natural Science Foundation of China e dalla Xinjiang Uygur Autonomous Region of China (Grant No. U1130303), dalla National Natural Science Foundation of China (Grant No. 81173119), dal Key Project of Ministry of Science and Technology of China (Grant No. 2012ZX09103201-051), e i Progetti di Cooperazione Tecnologica della Scienza di Shanghai, Cina (Grant No. 14495800200) assegnati a C-HW per il sostegno finanziario di questo studio.
Conflict of Interest Statement
Gli autori dichiarano che la ricerca è stata condotta in assenza di qualsiasi relazione commerciale o finanziaria che potrebbe essere interpretata come un potenziale conflitto di interessi.
Abd-El-Fattah, M. A, Abdelakader, N. F., e Zaki, H. F. (2014). Pirrolidina ditiocarbammato protegge contro il deterioramento cognitivo indotto da scopolamina nei ratti. Eur. J. Pharmacol. 723, 330-338. doi: 10.1016/j.ejphar.2013.11.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Aucoin, J. S., Jiang, P., Aznavour, N., Tong, X. K., Buttini, M., Descarries, L., et al. (2005). Denervazione colinergica selettiva, indipendente dallo stress ossidativo, in un modello murino della malattia di Alzheimer. Neuroscience 132, 73-86. doi: 10.1016/j.neuroscience.2004.11.047
PubMed Abstract | CrossRef Full Text | Google Scholar
Bassani, T. B., Turnes, J. M., Moura, E. L., Bonato, J. M., Cóppola-Segovia, V., Zanata, S. M., et al. (2017). Effetti della curcumina sulla memoria spaziale e di riconoscimento a breve termine, sulla neurogenesi adulta e sulla neuroinfiammazione in un modello di ratto indotto da streptozotocina di demenza di tipo Alzheimer. Comportamento. Brain Res. 335, 41-54. doi: 10.1016/j.bbr.2017.08.014
PubMed Abstract | CrossRef Full Text | Google Scholar
Bensalem, S., Soubhye, J., Aldib, I., Bournine, L., Nguyen, A. T., Vanhaeverbeek, M., et al. (2014). Inibizione dell’attività della mieloperossidasi da parte degli alcaloidi di Peganum harmala L. (Zygophyllaceae). J. Ethnopharmacol. 154, 361-369. doi: 10.1016/j.jep.2014.03.070
PubMed Abstract | CrossRef Full Text | Google Scholar
Berrougui, H., Isabelle, M., Cloutier, M., Hmamouchi, M., e Khalil, A. (2006a). Effetti protettivi dell’estratto di Peganum harmala L., harmina e harmalina contro l’ossidazione delle lipoproteine a bassa densità nell’uomo. J. Pharm. Pharmacol. 58, 967-974. doi: 10.1211/jpp.58.7.0012
PubMed Abstract | CrossRef Full Text | Google Scholar
Berrougui, H., Martín-Cordero, C., Khalil, A., Hmamouchi, M., Ettaib, A., Marhuenda, E., et al. Effetti vasorelaxant di harmine e harmaline estratte dai semi di Peganum harmala L. in aorta isolata di ratto. Pharmacol. Res. 54, 150-157. doi: 10.1016/j.phrs.2006.04.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Bohnen, N. I., Kaufer, D. I., Hendrickson, R., Ivanco, L. S., Lopresti, B. J., Koeppe, R. A., et al. (2005). Grado di inibizione dell’attività corticale dell’acetilcolinesterasi ed effetti cognitivi dal trattamento con donepezil nella malattia di Alzheimer. J. Neurol. Neurosurg. Psychiatry 76, 315-319. doi: 10.1136/jnnp.2004.038729
PubMed Abstract | CrossRef Full Text | Google Scholar
Bromley-Brits, K., Deng, Y., and Song, W. H. (2011). Morris water maze test per l’apprendimento e deficit di memoria in topi modello di malattia di Alzheimer. J. Vis. Exp. 53, 1-5. doi: 10.3791/2920
PubMed Abstract | CrossRef Full Text | Google Scholar
Corso, G., Cristofano, A., Sapere, N., La Marca, G., Angiolillo, A., Vitale, M., et al. (2017). Profili aminoacidici sierici in soggetti normali e in pazienti con o a rischio di demenza di Alzheimer. Dement. Geriatr. Cogn. Dis. Extra 7, 143-159. doi: 10.1159/000466688
PubMed Abstract | CrossRef Full Text | Google Scholar
Coyle, J. T., Price, D. L., and Delong, M. R. (1983). Malattia di Alzheimer: un disturbo dell’innervazione colinergica corticale. Scienza 219, 1184-1190. doi: 10.1126/science.6338589
CrossRef Full Text | Google Scholar
Demirci, K., Nazıroğlu, M., Övey,İ. S., e Balaban, H. (2017). Il selenio attenua l’apoptosi, l’infiammazione e lo stress ossidativo nel sangue e nel cervello di ratti anziani con demenza indotta da scopolamina. Metab. Brain Dis. 32, 321-329. doi: 10.1007/s11011-016-9903-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Fan, L. Y., e Chiu, M. J. (2014). Comboterapia e concetti attuali così come le strategie future per il trattamento della malattia di Alzheimer. Neuropsychiatr. Dis. Treat. 10, 439-451. doi: 10.2147/NDT.S45143
PubMed Abstract | CrossRef Full Text | Google Scholar
Frison, G., Favretto, D., Zancanaro, F., Fazzin, G., and Ferrara, S. D. (2008). Un caso di intossicazione da alcaloidi beta-carboline in seguito all’ingestione di estratto di semi di Peganum harmala. Forensic Sci. Int. 179, 37-43. doi: 10.1016/j.forsciint.2008.05.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Ghumatkar, P. J., Patil, S. P., Jain, P. D., Tambe, R. M., e Sathaye, S. (2015). Effetti nootropici, neuroprotettivi e neurotrofici della floretina in scopolamina indotta amnesia nei topi. Pharmacol. Biochem. Comportamento. 135, 182-191. doi: 10.1016/j.pbb.2015.06.005
PubMed Abstract | CrossRef Full Text | Google Scholar
González-Domínguez, R., García-Barrera, T., e Gómez-Ariza, J. L. (2015). Metabolite profiling per l’identificazione di percorsi metabolici alterati nella malattia di Alzheimer. J. Pharm. Biomed. Anal. 107, 75-81. doi: 10.1016/j.jpba.2014.10.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Goverdhan, P., Sravanthi, A., e Mamatha, T. (2012). Effetti neuroprotettivi di meloxicam e selegilina nel deterioramento cognitivo indotto da scopolamina e stress ossidativo. Int. J. Alzheimers Dis. 2012, 1-8. doi: 10.1155/2012/974013
PubMed Abstract | CrossRef Full Text | Google Scholar
Gray, E., Thomas, T. L., Betmouni, S., Betmouni, S., Scolding, N., and Love, S. (2008). Elevata attività ed espressione microgliale di mieloperossidasi nella corteccia cerebrale demielinizzata nella sclerosi multipla. Cervello Pathol. 18, 86-95. doi: 10.1111/j.1750-3639.2007.00110.x
PubMed Abstract | CrossRef Full Text | Google Scholar
He, D. D., Wu, H., Wei, Y., Liu, W., Huang, F., Shi, H. L., et al. (2015a). Effetti di harmine, un inibitore dell’acetilcolinesterasi, sull’apprendimento spaziale e la memoria di topi transgenici APP/PS1 e topi con compromissione della memoria indotta da scopolamina. Eur. J. Pharmacol. 768, 96-107. doi: 10.1016/j.ejphar.2015.10.037
PubMed Abstract | CrossRef Full Text | Google Scholar
He, D. D., Zhang, L., Liu, L., Wu, X. J., Cheng, X. M., and Wang, C. H. (2015b). Alcaloidi totali dai semi di Peganum harmala ameliorating topi capacità di apprendimento e la memoria. Chin. Tradit. Pat. Med. 37, 478-482.
Heneka, M. T., Carson, M. J., El Khoury, J., Landreth, G. E., Brosseron, F., Feinstein, D. L., et al. (2015). Neuroinfiammazione nella malattia di Alzheimer. Lancet Neurol. 14, 388-405. doi: 10.1016/S1474-4422(15)70016-5
CrossRef Full Text | Google Scholar
Herraiz, T., Gonzalez, D., Ancin-Azpilicueta, C., Arán, V. J., e Guillén, H. (2010). Alcaloidi beta-carboline in Peganum harmala e inibizione della monoamino ossidasi umana (MAO). Food Chem. Toxicol. 48, 839-845. doi: 10.1016/j.fct.2009.12.019
PubMed Abstract | CrossRef Full Text | Google Scholar
Jang, Y. J., Kim, J., Shim, J., Kim, C. Y., Jang, J. H., Lee, K. W., et al. (2013). Caffè decaffeinato impedisce scopolamina indotta compromissione della memoria nei ratti. Comportamento. Brain Res. 245, 113-119. doi: 10.1016/j.bbr.2013.02.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Jeon, S. J., Kim, B., Park, H. J., Zhang, J. B., Kwon, Y., Kim, D. H., et al. (2017). L’effetto migliorativo di 1-palmitoyl-2-linoleoyl-3-acetylglycerol sulla compromissione della memoria indotta da scopolamina tramite inibizione dell’acetilcolinesterasi e attivazione LTP. Behav. Brain Res. 324, 58-65. doi: 10.1016/j.bbr.2017.01.040
PubMed Abstract | CrossRef Full Text | Google Scholar
Jiang, B. (2016). Studio sul trasporto di alcaloidi da Peganum harmala attraverso la barriera emato-encefalica e il meccanismo del loro effetto sui neurotrasmettitori nel cervello dei ratti. Dissertazione di dottorato, Shanghai University of Traditional Chinese Medicine, Shanghai.
Jiménez, J., Riveron-Negrete, L., Abdullaev, F., Espinosa-Aguirrec, J., and Rodríguez-Arnaiza, R. (2008). Citotossicità degli alcaloidi β-carboline harmine e harmaline in saggi di cellule umane in vitro. Exp. Toxicol. Pathol. 60, 381-389. doi: 10.1016/j.etp.2007.12.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Kaur, R., Singh, V., and Shri, R. (2017). Effetti anti-amnesici delle specie di Ganoderma: un possibile meccanismo colinergico e antiossidante. Biomed. Pharmacother. 92, 1055-1061. doi: 10.1016/j.biopha.2017.06.029
PubMed Abstract | CrossRef Full Text | Google Scholar
Kouémou, N. E., Taiwe, G. S., Moto, F. C. O., Pale, S., Gwladys, N. T., Njapdounke, J. S. K., et al. (2017). Effetti nootropici e neuroprotettivi di dichrocephala integrifolia sul modello di topo scopolamina della malattia di Alzheimer. Front. Pharmacol. 8:847. doi: 10.3389/fphar.2017.00847
CrossRef Full Text | Google Scholar
Kumar, A., and Singh, A. (2015). Una revisione sulla fisiopatologia della malattia di Alzheimer e la sua gestione: un aggiornamento. Pharmacol. Rep. 67, 195-203. doi: 10.1016/j.pharep.2014.09.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Kwon, S. H., Lee, H. K., Kim, J. A., Hong, S. I., Kim, H. C., Jo, T. H., et al. (2010). Effetti neuroprotettivi dell’acido clorogenico sull’amnesia indotta da scopolamina attraverso attività anti-acetilcolinesterasi e anti-ossidative nei topi. Eur. J. Pharmacol. 649, 210-217. doi: 10.1016/j.ejphar.2010.09.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Lee, H. E., Jeon, S. J., Ryu, B., Park, S. J., Ko, S. Y., Lee, Y., et al. (2016). Swertisin, un C-glucosylflavone, migliora la compromissione della memoria indotta da scopolamina nei topi con la sua proprietà antagonista del recettore dell’adenosina A1. Comportamento. Brain Res. 306, 137-145. doi: 10.1016/j.bbr.2016.03.030
PubMed Abstract | CrossRef Full Text | Google Scholar
Lee, S., Kim, J., Seo, S. G., Choi, B. R., Han, J. S., Lee, K. W., et al. (2014). Sulforaphane allevia la compromissione della memoria indotta da scopolamina nei topi. Pharmacol. Res. 85, 23-32. doi: 10.1016/j.phrs.2014.05.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, J., Liu, Y., Li, W., Wang, Z., Guo, P., Li, L., et al. (2018). Profilo metabolico degli effetti del ginsenoside Re in un modello di topo con malattia di Alzheimer. Behav. Brain Res. 337, 160-172. doi: 10.1016/j.bbr.2017.09.027
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, S. P., Cheng, X. M., and Wang, C. H. (2017a). Una revisione sugli usi tradizionali, fitochimica, farmacologia, farmacocinetica e tossicologia del genere Peganum. J. Ethnopharmacol. 203, 127-162. doi: 10.1016/j.jep.2017.03.049
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, S. P., Zhang, Y. P., Deng, G., Wang, Y. W., Qi, S. L., Cheng, X. M., et al. (2017b). Caratteristiche di esposizione degli analoghi alcaloidi β-carboline harmaline e harmine basate sul trasportatore di efflusso della proteina di resistenza ai farmaci 2. Front. Pharmacol. 8:541. doi: 10.3389/fphar.2017.00541
CrossRef Full Text | Google Scholar
Lin, J. J., Huang, L., Yu, J., Xiang, S. Y., Wang, J. L., Zhang, J. R., et al. (2016). Fucoxantina, un carotenoide marino, inverte i danni cognitivi indotti da scopolamina nei topi e inibisce l’acetilcolinesterasi in vitro. Mar. Drugs 14:67. doi: 10.3390/md14040067
PubMed Abstract | CrossRef Full Text | Google Scholar
Lin, M. T., e Beal, M. F. (2006). Disfunzione mitocondriale e stress ossidativo nelle malattie neurodegenerative. Nature 443, 787-795. doi: 10.1038/nature05292
PubMed Abstract | CrossRef Full Text | Google Scholar
Liu, W., Yang, Y. D., Cheng, X. M., Gong, C., Li, S. P., He, D. D., et al. (2014). Rilevamento rapido e sensibile delle attività inibitrici degli inibitori di acetil- e butirralcolinesterasi da UPLC-ESIMS/MS. J. Pharm. Biomed. Anal. 94, 215-220. doi: 10.1016/j.jpba.2014.02.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Liu, W., Zhu, Y. D., Wang, Y. L., Qi, S. L., Wang, Y. W., Ma, C., et al. (2017). Effetto anti-amnesico dell’estratto e della frazione alcaloide dalle parti aeree di Peganum harmala sui deficit di memoria indotti dalla scopolamina nei topi. J. Ethnopharmacol. 204, 95-106. doi: 10.1016/j.jep.2017.04.019
PubMed Abstract | CrossRef Full Text | Google Scholar
Louis, E. D., Jiang, W., Gerbin, M., Mullaney, M. M., and Zheng, W. (2010). Relazione tra le concentrazioni di harmane e harmine nel sangue in tremore essenziale familiare, tremore essenziale sporadico e controlli. Neurotoxicology 31, 674-679. doi: 10.1016/j.neuro.2010.08.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Lu, C., Dong, L. M., Lv, J. W., Wang, Y., Fan, B., Wang, F., et al. (2018). 20(S)-protopanaxadiolo (PPD) allevia la compromissione della memoria indotta da scopolamina attraverso la regolazione dei sistemi colinergici e antiossidanti, e l’espressione di Egr-1, c-Fos e c-Jun nei topi. Chem. Biol. Interact. 279, 64-72. doi: 10.1016/j.cbi.2017.11.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Mahmoudian, M., Jalipour, H., and Dardashti, P. S. (2002). Tossicità del Peganum harmala: revisione e rapporto di un caso. Iran. J. Pharmacol. Ther. 1, 1-4.
Google Scholar
Malik, J., Kaur, J., and Choudhary, S. (2017). Estratto standardizzato di Lactuca sativa Linn. e le sue frazioni abroga l’amnesia indotta da scopolamina nei topi: un possibile meccanismo colinergico e antiossidante. Nutr. Neurosci. 1-12. doi: 10.1080/1028415X.2017.1291166 .
PubMed Abstract | CrossRef Full Text | Google Scholar
Morris, R. G., Garrud, P., Rawlins, J. A., e O’Keefe, J. (1982). Navigazione luogo compromessa nei ratti con lesioni ippocampali. Natura 297, 681-683. doi: 10.1038/297681a0
CrossRef Full Text | Google Scholar
Nilsen, L. H., Melø, T. M., Sæther, O., Witter, M. P., e Sonnewald, U. (2012). Profilo neurochimico alterato nel modello di ratto McGill-R-Thy1-APP della malattia di Alzheimer: uno studio longitudinale in vivo 1H MRS. J. Neurochem. 123, 532-541. doi: 10.1111/jnc.12003
PubMed Abstract | CrossRef Full Text | Google Scholar
Oh, J. H., Choi, B. J., Chang, M. S., e Park, S. K. (2009). L’estratto di seme di Nelumbo nucifera migliora la memoria nei ratti con amnesia indotta da scopolamina attraverso l’induzione dell’espressione della colina acetiltransferasi. Neurosci. Lett. 461, 41-44. doi: 10.1016/j.neulet.2009.05.045
PubMed Abstract | CrossRef Full Text | Google Scholar
Patel, K., Gadewar, M., Tripathi, R., Prasad, S. K., e Patel, D. K. (2012). Una revisione sull’importanza medicinale, attività farmacologica e aspetti bioanalitici dell’alcaloide beta-carbolina “Harmine”. Asian Pac. J. Trop. Biomed. 2, 660-664. doi: 10.1016/S2221-1691(12)60116-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Rijpma, A., Meulenbroek, O., and Rikkert, M. O. (2014). Inibitori della colinesterasi e supplementi nutrizionali add-on nella malattia di Alzheimer: una revisione sistematica di studi randomizzati controllati. Ageing Res. Rev. 16, 105-112. doi: 10.1016/j.arr.2014.06.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Saxena, G., Singh, S. P., Agrawal, R., and Nath, C. (2008). Effetto di donepezil e tacrina sullo stress ossidativo nel modello di demenza intracerebrale indotto da streptozotocina nei topi. Eur. J. Pharmacol. 581, 283-289. doi: 10.1016/j.ejphar.2007.12.009
PubMed Abstract | CrossRef Full Text | Google Scholar
Scali, C., Prosperi, C., Giovannelli, L., Bianchi, L., Pepeu, G., e Casamenti, F. (1999). β (1-40) peptide amiloide iniezione nel nucleo basale dei ratti induce la reazione della microglia e aumenta il rilascio corticale di acido γ-aminobutirrico in vivo. Brain Res. 831, 319-321. doi: 10.1016/S0006-8993(99)01492-4
CrossRef Full Text | Google Scholar
Shi, X. Y., Liu, W., Zhang, L., Li, S. P., Cheng, X. M., Xi, Y., et al. (2014). Farmacocinetica di harmaline, harmine e loro metaboliti nei ratti somministrati con estratti di alcaloidi totali da Peganum harmala L. Chin. Tradit. Pat. Med. 36, 1169-1175. doi: 10.3969/j.issn.1001-1528.2014.06.013
CrossRef Full Text | Google Scholar
Singh, S., Kaur, H., e Sandhir, R. (2016). Dimensioni frattali: un nuovo paradigma per valutare la memoria spaziale e l’apprendimento utilizzando Morris water maze. Behav. Brain Res. 299, 141-146. doi: 10.1016/j.bbr.2015.11.023
PubMed Abstract | CrossRef Full Text | Google Scholar
Svob Strac, D., Muck-Seler, D., e Pivac, N. (2015). Misure di neurotrasmettitori nel liquido cerebrospinale di pazienti con malattia di Alzheimer: una revisione. Psychiatr. Danub. 27, 14-24.
Google Scholar
Tse-Susanna, Y. H., Mak, I. T., e Dickens, B. F. (1991). Proprietà antiossidative di harmane e β-carboline alcaloidi. Biochem. Pharmacol. 42, 459-464. doi: 10.1016/0006-2952(91)90305-O
CrossRef Full Text | Google Scholar
Vermeiren, Y., Van Dam, D., Aerts, T., Engelborghs, S., e De Deyn, P. P. (2014). Alterazioni dei neurotrasmettitori monoaminergici in regioni cerebrali postmortem di pazienti depressi e aggressivi con malattia di Alzheimer. Neurobiol. Aging 35, 2691-2700. doi: 10.1016/j.neurobiolaging.2014.05.031
PubMed Abstract | CrossRef Full Text | Google Scholar
Verri, M., Pastoris, O., Dossena, M., Aquilani, R., Guerriero, F., Cuzzoni, G., et al. (2012). Alterazioni mitocondriali, stress ossidativo e neuroinfiammazione nella malattia di Alzheimer. Int. J. Immunopathol. Pharmacol. 25, 345-353. doi: 10.1177/039463201202500204
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, C. H., Zhang, Z. X., Wang, Y. H., and He, X. J. (2015). Alcaloidi indolici citotossici contro le linee cellulari di leucemia umana dalla pianta tossica Peganum harmala. Toxins 7, 4507-4518. doi: 10.3390/toxins7114507
PubMed Abstract | CrossRef Full Text | Google Scholar
Weng, R., Shen, S. S., Tian, Y. L., Burton, C., Xu, X. Y., Liu, Y., et al. (2015). Approccio metabolomico rivela rete metabolica integrata associata alla carenza di serotonina. Sci. Rep. 5:11864. doi: 10.1038/srep11864
PubMed Abstract | CrossRef Full Text | Google Scholar
Yoshiyama, Y., Kojima, A., Ishikawa, C., e Arai, K. (2010). Azione anti-infiammatoria di donepezil migliora la patologia tau, la perdita sinaptica, e la neurodegenerazione in un modo tauopatia del mouse. J. Alzheimers Dis. 22, 295-306. doi: 10.3233/JAD-2010-100681
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhang, L. (2013). Studio sulle compresse di rivestimento della pellicola di alcaloidi totali da Peganum harmala. Master Dissertation, Shanghai University of Traditional Chinese Medicine, Shanghai.
Zhao, T., Ding, K. M., Zhang, L., Cheng, X. M., Wang, C. H., and Wang, Z. T. (2013). Attività inibitorie dell’acetilcolinesterasi e della butirralcolinesterasi di derivati di alcaloidi β-carboline e chinoline dalle piante del genere Peganum. J. Chem. 2013:717232. doi: 10.1155/2013/717232
CrossRef Full Text | Google Scholar
Zhou, X. L., Li, Y. F., Shi, X. Z., and Ma, C. (2016). Una panoramica sulle terapie che attenuano il livello di amiloide β nella malattia di Alzheimer: prendendo di mira la neurotrasmissione, l’infiammazione, lo stress ossidativo e l’aumento dei livelli di colesterolo. Am. J. Transl. Res. 8, 246-269.
PubMed Abstract | Google Scholar
Leave a Reply